Является ли выписка из ЕГРЮЛ/ЕГРИП, распечатанная с сайта ФНС, доказательством в суде? | Yonsel.ru
Является ли выписка из ЕГРЮЛ/ЕГРИП о конкретном юридическом лице или индивидуальном предпринимателе, распечатанная с сайта ФНС, доказательством в суде? Речь идет НЕ о выписке в форме в форме электронного документа, подписанного усиленной квалифицированной электронной подписью, а именно обыкновенная распечатка с сайта www.nalog.ru.
Документы подписанные электронной подписью, уже достаточно давно приравниваются к оригиналу. Электронный документ, полученный при помощи указанного сервиса (бесплатное предоставление содержащихся в ЕГРЮЛ/ЕГРИП сведений о конкретном юридическом лице/индивидуальном предпринимателе в форме электронного документа), в соответствии с положениями пунктов 1 и 3 статьи 6 Федерального закона от 6 апреля 2011 г. № 63-ФЗ «Об электронной подписи» равнозначен выписке на бумажном носителе, которая подписана собственноручно должностным лицом налогового органа и заверена печатью. Сервис доступен по ссылке: https://service.nalog.ru/vyp/.
Сервис доступен по ссылке: https://service.nalog.ru/vyp/.
Так по адресу https://egrul.nalog.ru/ любой гражданин сможет получить сведения о государственной регистрации юридических лиц, индивидуальных предпринимателей, крестьянских (фермерских) хозяйств. Для этого в поле поиска нужно ввести наименование юридического лица / Ф.И.О. индивидуального предпринимателя или ИНН. Далее сервис обработает запрос по заданным критериям поиска и покажет всех найденных юр. лиц / ИП. Затем уже можно распечатать выписку из реестра.
Что же говорит закон, когда в качестве доказательств истец или ответчик предоставляет обыкновенную распечатку?
Согласно ст. 4 Федерального закона от 08.08.2001 N 129-ФЗ «О государственной регистрации юридических лиц и индивидуальных предпринимателей» в Российской Федерации ведутся государственные реестры, содержащие соответственно сведения о создании, реорганизации и ликвидации юридических лиц, приобретении физическими лицами статуса индивидуального предпринимателя, прекращении физическими лицами деятельности в качестве индивидуальных предпринимателей, иные сведения о юридических лицах, об индивидуальных предпринимателях и соответствующие документы.
Единство и сопоставимость указанных сведений обеспечиваются за счет соблюдения единства принципов, методов и форм ведения государственных реестров.
Государственные реестры являются федеральными информационными ресурсами.
В п. 2 ст. 7.1. вышеназванного закона указано, что сведения, содержащиеся в Едином федеральном реестре сведений о фактах деятельности юридических лиц, являются открытыми и общедоступными, за исключением сведений, доступ к которым ограничен в соответствии с законодательством Российской Федерации.
Сведения, содержащиеся в Едином федеральном реестре сведений о фактах деятельности юридических лиц, подлежат размещению в информационно-телекоммуникационной сети «Интернет», если иное не установлено настоящим Федеральным законом.
В соответствии со ст. ст. 13, 14 Федерального закона № 149-ФЗ от 27.07.2006 года «Об информации, информационных технологиях и о защите информации» федеральный информационный ресурс представляет из себя информацию, содержащуюся в федеральной информационной системе.
В силу ст. 3 ФЗ от 27.07.2006 года № 149-ФЗ «Об информации, информационных технологиях и о защите информации» одним из принципов правового регулирования отношений в сфере информации, информационных технологий и защиты информации является принцип достоверности информации.
Стоит заметить, что необходимым условием проведения регистрации в соответствии с требованиями ФЗ от 08.08.2001 N 129-ФЗ «О государственной регистрации юридических лиц и индивидуальных предпринимателей» является не только представление полного перечня документов, предусмотренного соответствующей главой указанного Закона, но и достоверность информации, подлежащей внесению в ЕГРЮЛ/ЕГРИП.
Таким образом, можно не сомневаться в достоверности данных, размещенных в открытом доступе на сайте налоговой службы.
Поделиться с друзьями
Срок действия выписки из ЕГРЮЛ
Выписка из ЕГРЮЛ – это документ, получаемый ФНС и раскрывающий информацию о регистрационных данных юридического лица. О том какой срок действия имеет выписка из ЕГРЮЛ пойдёт речь в нашей статье.
О том какой срок действия имеет выписка из ЕГРЮЛ пойдёт речь в нашей статье.
Первую выписку из ЕГРЮЛ получают сразу после регистрации, с комплектом документов: ОГРН, свидетельством о постановке на учет в ФНС, Устав с отметкой о регистрации, присвоенные коды статистики.
Бесплатная консультация юриста по телефону
Задать вопрос юристу
По Москве и области
Санкт-Петербург и область
Федеральный номер
При ведении экономической деятельности организация вправе получать информацию из реестра о любом юридическом лице, зарегистрированном на территории РФ любым доступным способом.
Об индивидуальных предпринимателях компания получает информацию из реестра ОГРНИП, об остальных – из ЕГРЮЛ.Срок действия официальной выписки из ЕГРЮЛ

При участии в государственных закупках при помощи функционала электронной торговой площадки, выписка прикрепляется при аккредитации Поставщика. В момент аккредитации срок действия выписки не должен составлять более 6 месяцев с момента получения.
После проведения аккредитации необходимости прикладывать выписку во время участия в процедуре не нужно. Но стоит заметить, что в конкурсной документации государственные Заказчики упоминают о соответствии предоставляемых сведений.
Если у компании произошли изменения, то на площадке должна появиться новая выписка, иначе поставщик будет отклонен по второй части заявки.
При нотариальном удостоверении сделки выписка не должна быть «старше» 30 дней. Некоторые нотариусы сокращают этот срок до 7 календарных дней.
При обращении в Арбитражный суд выписка должна быть получена не более 30 дней до даты составления и подачи искового заявления.
В остальных случаях срок действия выписки устанавливается исходя из положений, регламентов и порядка подачи документов в организации.
Какая информация содержится в выписке
Структура выписки представляет систему данных:
- Основные данные о юридическом лице, которые нужны для заполнения договоров, запросов и тд: ИНН, ОГРН, организационно-правовая форма (ЗАО, ПАО, ООО, МУП, ГУП и тд). Наименование: полное, сокращенное, аналог на иностранном языке (если есть). Статус: действующее, ликвидировано, в процессе реорганизации и т.д.
- Адрес компании, контактный телефон.
- Информация об уставном капитале, доле, распределении среди участников: перечисление учредителей и участников с указанием доли в уставном капитале.
- ОГРН юридического лица. Дата внесения информации в государственный реестр, ИНФС, регистрирующая данные.
- Сведения о постановке на учет в налоговом органе: ИНН, дата постановки, информация об ИНФС.
- Сведения об управляющей компании.
- Сведения о филиалах, представительствах с перечислением наименований филиалов, адресов.

- Сведения о лицах, имеющих право действовать без доверенности. В этом разделе указываются ФИО и должность сотрудника компании, который вправе представлять интересы организации без доверенности.
- Данные о компаниях, принимающих или принимавших участие в реорганизации , если компания была образована путем слияния или наоборот, прекратила существование в результате поглощения.
- Перечисление видов экономической деятельности компании – данные, чем занимается компания. ОКВЭД можно менять, если деятельность организации изменилась либо дополнять новыми кодами.
- Факт регистрации в Фонде медицинского страхования, Пенсионном фонде, ФСС.
- Данные о лицензиях. В случаях, когда деятельность организации подлежит обязательному лицензированию, то сведения о выданных лицензиях можно уточнить в этом разделе. Здесь указывается вид лицензии, дата получения, срок действия.
- Когда компания вносит изменения в уставные документы, состав учредителей, решает поменять юридический адрес или получает новый ОКВЭД, то запись об этом фиксируется.

- При каждом изменении организация получает новое свидетельство. Данные идентификации компании в таких свидетельствах остаются неизменными, а серия и номер меняются. Раздел о свидетельствах содержит информацию о том, какое из свидетельств является актуальным.
Где можно получить выписку
Неофициальную выписку можно получить на сайте ИФНС. Для получения выписки нужно внести в поле поиска ИНН организации или ОГРН. Предоставление таких выписок бесплатно: сайт ФНС является открытым источником.
Бесплатная консультация юриста по телефону
Задать вопрос юристу
По Москве и области
Санкт-Петербург и область
Федеральный номер
Неофициальную выписку можно выгрузить с помощью платных программ и сервисов, занимающихся сбором информации о деятельности организаций. В зависимости от системы, в блоке поиске потребуется внести данные ОГРН или ИНН и программа сама соберет и выдаст нужную информацию.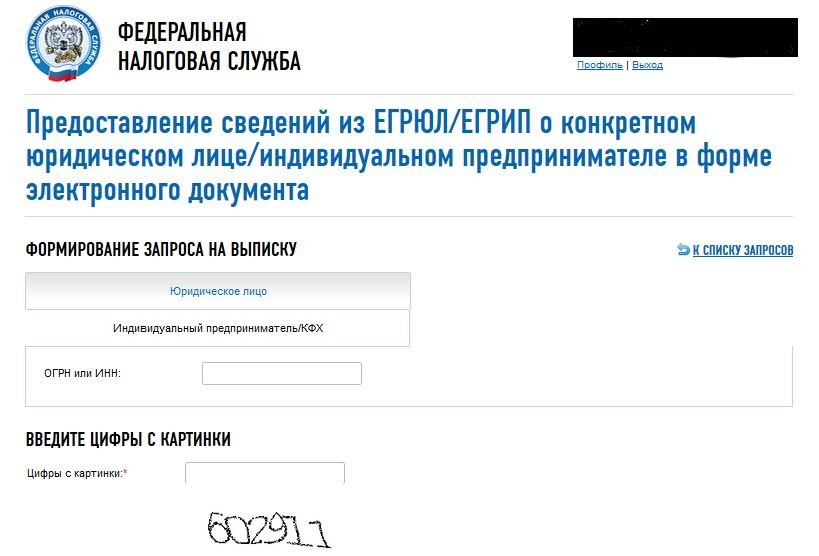
Официальную выписку получают при обращении в ФНС. Получение сведений из реестра – платная услуга, поэтому сначала нужно оплатить госпошлину за предоставление данных. А потом заполнит заявление на предоставлении сведений.
Запрос можно заполнить на сайте налоговой или обратившись лично в одно из отделений ФНС. Выписка будет готова в течение пяти рабочих дней, срочная выписка предоставляется в течение суток.
Важно знать, что при обращении в ФНС и формировании запроса третьим лицам нельзя получить информацию о паспортных данных участников организации, а также о банковских счетах.
Эти данные вправе получить представители организации, подав запрос на выписку о собственной компании.Кто может попросить предоставить выписку из ЕГРЮЛ
Выписку из ЕГРЮЛ организация получает по факту регистрации. Выписка нужна компании для организации и ведения коммерческой деятельности. 
- Банковские организации запрашивают выписку при открытии счета, выдаче кредитов, тендерных займов, банковских гарантий. Если вы намерены перечислять заработную плату сотрудникам на пластиковые карты, то вам нужно будет заключить договор на зарплатный проект.
- Государственные предприятия и саморегулируемые организации, осуществляющие выдачу лицензий, запрашивают уставные документы, свидетельства и выписку. Дело в том, что лицензирующие организации несут ответственность за каждое выданное свидетельство и лицензию. Выписка – подтверждение правоспособности организации. Кроме того, в выписке регистрируется ОКВЭД, который исключает возможность получения лицензии на образовательную деятельность организацией торговли.
- Выписка нужна при обращении в суд. Место регистрации организации, правоспособность руководителя, подтверждается данными из выписки. Выписка не требуется только Индивидуальным предпринимателям, поскольку место регистрации ИП совпадает с адресом прописки.

- Выписка может пригодиться при обращении к нотариусу. Следует учесть что каждый нотариус устанавливает свои сроки давности получения выписки, поэтому перед обращением следует связаться для уточнения информации по этому вопросу.
- Юридическим лицам, государственным организациям выписка нужна перед заключением договора с целью проверки контрагента, уточнения данных реквизитов, а также установления соответствия требованиям: не нахождения в стадии ликвидации, реорганизации, наличие лицензий(если деятельность лицензируется).
Основные понятия
ИНН – это идентификационный номер налогоплательщика. Как и ОГРН этот номер присваивается фирме один раз. КПП – код причины постановки, может меняться. Допустим, при смене юридического адреса, открытии филиала или представительства не обязательно заново регистрировать фирму. Достаточно подать заявление в ФНС на изменение информации в ЕГРЮЛ.
Единый государственный реестр юридических лиц – это федеральная база данных, содержащая сведения о государственной регистрации юридических лиц, изменениях, которые происходят в компании.
Виды выписок из ЕГРЮЛ
Официальная выписка – это документ, получаемый в отделении ФНС. Все листы выписки прошиваются, нумеруются, ставится печать отделения ФНС и подпись лица, ответственного за выдачу сведений.
Неофициальная выписка – это документ, получаемый с помощью официального источника egrul.nalog.ru. В настоящий для получения выписки многие компании пользуются коммерческими сервисами. Выбор способа остается за организацией: коммерческие сервисы удобны в плане автоматизации процессов ответственных работников, но не всегда выгружают полезную информацию.
Государственный источник содержит актуальные данные, в том числе, о последних изменениях, но не всегда доступен.
Официальная выписка имеет юридическую силу, так как содержащееся в ней сведения заверены органом, ответственным за регистрацию юридических лиц, ведение реестров и внесение изменений.
Выписки из неофициальных источников используются организациям для проверки контрагентов, уточнения реквизитов, сбора данных об учредителях и аффилированных лицах и получения информации о последних изменениях, вносимых в ЕГРЮЛ.
Заключение
Для обеспечения деятельности многим государственным структурам необходима информация о субъектах хозяйствования, которую они могут получить лишь в налоговой службе. Для них выписка из ЕГРЮЛ бесплатно предоставляется.
При этом они могут как пользоваться данными реестра в интернете, так и получать необходимые сведения на электронных носителях. Федеральным органам власти для получения данных от налоговой необходимо обратиться в ФНС или ее межрегиональную инспекцию. Только там им оформят соответствующий доступ.
Субъектам местного самоуправления или территориальным органам власти можно обратиться в местное управление ФНС. При этом любой из них должен предоставить заявку по утвержденной в налоговой службе форме.
Следует учесть, что для Центрального банка, всех органов государственной власти и местного самоуправления срок действия доступа не устанавливается, он является неограниченным.
ФНС сообщила о расширении зоны использования новой услуги «Личный кабинет налогоплательщика — индивидуального предпринимателя»
предприниматель бизнесмен галстукФедеральная налоговая служба РФ сообщила о расширении зоны опытной эксплуатации интерактивного сервиса «Личный кабинет налогоплательщика — индивидуального предпринимателя» до 20 регионов Российской Федерации.
Как и ряд уже действующих на сайте ФНС услуг, новый сервис для индивидуальных предпринимателей разработан без привязки к Единой системе идентификации и аутентификации (ЕСИА).
В момент запуска, чуть более месяца назад, тестирование было доступно налогоплательщикам–индивидуальным предпринимателям Республики Башкортостан и Татарстан, Алтайского и Приморского краев, Воронежской, Ленинградской, Нижегородской, Оренбургской, Ростовской областей, Ханты-Мансийского автономного округа. Теперь подключиться к сервису могут индивидуальные предприниматели Республики Саха (Якутия), Краснодарского и Ставропольского краев, Волгоградской, Новосибирской, Самарской, Свердловской, Томской, Челябинской и Ярославской областей, говорится в сообщении.
Как сообщает ФНС, сервис позволяет индивидуальному предпринимателю:
- получать актуальную информацию о статусе налоговых платежей, переплатах, исполненных налоговым органом решениях о зачете и возврате излишне уплаченных или взысканных сумм, о неисполненных налогоплательщиком требованиях на уплату налога;
- рассчитать и выбрать оптимальный режим налогообложения;
- получать сведения из ЕГРИП, сообщать об участии в российских и иностранных организациях;
- обращаться в налоговый орган, подавать заявления о прекращении деятельности в качестве ИП, отслеживать информацию о прохождении своих документов и др.
Авторизоваться в сервисе можно как с помощью логина и пароля к Личному кабинету налогоплательщика для физических лиц, так и с помощью квалифицированной электронной подписи на носителе (USB-ключа) или универсальной электронной карты (УЭК), говорится в сообщении ФНС.
Для тех, кто не имеет этих средств доступа, для получения доступа к “Личному кабинету налогоплательщика – индивидуального предпринимателя” необходимо посетить один из офисов инспекции ФНС России и получить регистрационную карту, на которой будет указан логин (ИНН) и пароль для входа в систему.
Как следует из информации, предоставленной ФНС, в существующем варианте сервис не предполагает использования Единой системы идентификации и аутентификации, что позволило бы обращаться к услугам, доступным на портале ФНС, тем 9,3 миллиона человек, которые имеют подтвержденную учетную запись (61% от 15,22 миллиона, всего зарегистрированных в ЕСИА).
Между тем, еще в сентябре 2014 года на заседании подкомиссии по использованию IT при предоставлении государственных и муниципальных услуг регионам и федеральным органам, на чьих сайтах для авторизации используются системы, отличные от ЕСИА, было поручено до 31 декабря 2014 года исправить ситуацию и предоставлять доступ к информации, содержащейся в государственных информационных системах и размещенной в Интернете, исключительно через ЕСИА. (Презентация по вопросу >>>)
В конце октября на заседании правительственной комиссии по использованию информационных технологий для улучшения качества жизни и условий ведения предпринимательской деятельности, конкретно обсуждались механизмы предоставления приоритетных госуслуг ФНС в электронной форме. Тогда глава ведомства Михаил Мишустин пообещал “дальнейшую интеграцию сервисов сайта Федеральной налоговой службы на едином портале государственных услуг” и рассказал, что ФНС разрабатывает “Личный кабинет налогоплательщика – индивидуального предпринимателя”.
Тогда глава ведомства Михаил Мишустин пообещал “дальнейшую интеграцию сервисов сайта Федеральной налоговой службы на едином портале государственных услуг” и рассказал, что ФНС разрабатывает “Личный кабинет налогоплательщика – индивидуального предпринимателя”.
Тем не менее, этот новый сервис в ЕПГУ так и не интегрирован, и подключиться к нему без посещения налоговой инспекции могут лишь обладатели усиленной квалифицированной электронной подписи, выданной доверительным удостоверяющим центром Минкомсвязи России, т.е. физический USB-ключ с сертификатом подписи.
В декабре Минэкономразвития представило отчет по итогам проведенного очередного обследования качества предоставления электронных услуг федеральных органов власти. Согласно отчету, на ЕПГУ представлено 34 услуги ФНС (ведомство входит в первую тройку по числу работающих услуг), а такие услуги, как предоставление пользователям выписки из Единого государственного реестра налогоплательщиков и государственная регистрация юридических лиц, физических лиц в качестве индивидуальных предпринимателей и крестьянских (фермерских) хозяйств, входят в число приоритетных услуг и пользуются большой популярностью.
При этом к услугам ведомства имеются претензии. Как следует из результатов мониторинга, подача заявления в электронной форме сложна и доступна только технически подготовленному специалисту.
Подготовка заявления возможна только в специализированной программе (а не просто через форму на ЕПГУ). Также заявления, поданные через ЕПГУ, часто теряются ведомством и его отделениями, а статус заявления не всегда оперативно актуализируется.
В итоге человеку проще и быстрее подать заявление по стандартной процедуре, чем обращаться через ЕПГУ, говорится в отчете.
CCM111, водный экстракт Antrodia cinnamomea, регулирует иммунную активность посредством STAT3 и NF-κB путей.
Coussens, L. M. & Werb, Z. Воспаление и рак. Природа 420 , 860–867, DOI: 10.1038 / nature01322 (2002).
ADS CAS Статья PubMed PubMed Central Google Scholar
Гривенников С. И., Гретен Ф.Р. и Карин М. Иммунитет, воспаление и рак. Ячейка 140 , 883–899, DOI: 10.1016 / j.cell.2010.01.025 (2010).
И., Гретен Ф.Р. и Карин М. Иммунитет, воспаление и рак. Ячейка 140 , 883–899, DOI: 10.1016 / j.cell.2010.01.025 (2010).
CAS Статья PubMed PubMed Central Google Scholar
Meng, F. & Lowell, C.A. Индуцированная липополисахаридом (LPS) активация макрофагов и передача сигнала в отсутствие киназ семейства Src Hck, Fgr и Lyn. J Exp Med 185 , 1661–1670 (1997).
CAS Статья PubMed PubMed Central Google Scholar
Фудзивара Н. и Кобаяши К. Макрофаги при воспалении. Препарат Curr предназначен для лечения аллергии на воспаление 4 , 281–286 (2005).
CAS Статья PubMed Google Scholar
Винсент, Дж. Л., Чжан, Х., Сабо, К. и Прейзер, Дж. C. Влияние оксида азота при септическом шоке. Am J Respir Crit Care Med 161 , 1781–1785, DOI: 10.1164 / ajrccm.161.6.9812004 (2000).
C. Влияние оксида азота при септическом шоке. Am J Respir Crit Care Med 161 , 1781–1785, DOI: 10.1164 / ajrccm.161.6.9812004 (2000).
CAS Статья PubMed Google Scholar
Риччиотти, Э. и Фитцджеральд, Г.А. Простагландины и воспаление. Артериосклер Thromb Vasc Biol 31 , 986–1000, DOI: 10.1161 / ATVBAHA.110.207449 (2011).
CAS Статья PubMed PubMed Central Google Scholar
Кляйн, У. и Гош, С. Две стороны передачи сигналов NF-kappaB в развитии и терапии рака. Раковая клетка 20 , 556–558, DOI: 10.1016 / j.ccr.2011.10.026 (2011).
CAS Статья PubMed PubMed Central Google Scholar
Oeckinghaus, A. & Ghosh, S. Семейство факторов транскрипции NF-kappaB и его регуляция. Колд-Спринг-Харбор: биологические перспективы 1 , a000034, DOI: 10.1101 / cshperspect.a000034 (2009).
Колд-Спринг-Харбор: биологические перспективы 1 , a000034, DOI: 10.1101 / cshperspect.a000034 (2009).
Артикул PubMed PubMed Central Google Scholar
Лоуренс Т. Путь ядерного фактора NF-kappaB при воспалении. Колд-Спринг-Харбор: биологические перспективы 1 , a001651, DOI: 10.1101 / cshperspect.a001651 (2009).
Артикул PubMed PubMed Central Google Scholar
Старк, Г. Р. и Дарнелл, Дж. Э. мл. Путь JAK-STAT в двадцать. Иммунитет 36 , 503–514, DOI: 10.1016 / j.immuni.2012.03.013 (2012).
CAS Статья PubMed PubMed Central Google Scholar
Марреро, М. Б., Венема, В. Дж., Хе, Х., Колдуэлл, Р. Б. и Венема, Р. С. Ингибирование с помощью пути JAK / STAT индукции стимулированной IFN-гамма и ЛПС синтазы оксида азота в гладкомышечных клетках сосудов. Biochem Biophys Res Commun 252 , 508–512, DOI: 10.1006 / bbrc.1998.9678 (1998).
Biochem Biophys Res Commun 252 , 508–512, DOI: 10.1006 / bbrc.1998.9678 (1998).
CAS Статья PubMed Google Scholar
Бах, Э.А., Аге, М., Шрайбер, Р.D. Гамма-рецептор IFN: парадигма передачи сигналов рецептора цитокина. Ежегодный обзор иммунологии 15 , 563–591, DOI: 10.1146 / annurev.immunol.15.1.563 (1997).
CAS Статья PubMed Google Scholar
Чоудхури, Ф. З. и Фаррар, Дж. Д. STAT2: изменяющий форму антивирусный супер-STAT. Jak-Stat 2 , e23633, DOI: 10.4161 / jkst.23633 (2013).
Артикул PubMed PubMed Central Google Scholar
Гонсалес-Навахас, Дж. М., Ли, Дж., Дэвид, М. и Раз, Э. Иммуномодулирующие функции интерферонов типа I. Природные обзоры. Иммунология 12 , 125–135, DOI: 10.1038 / nri3133 (2012).
Природные обзоры. Иммунология 12 , 125–135, DOI: 10.1038 / nri3133 (2012).
CAS PubMed PubMed Central Google Scholar
Ли, X., Леунг, С., Куреши, С., Дарнелл, Дж. Э. мл. И Старк, Г. Р. Формирование гетеродимеров STAT1-STAT2 и их роль в активации транскрипции гена IRF-1 интерфероном-альфа. Журнал биологической химии 271 , 5790–5794 (1996).
CAS Статья PubMed Google Scholar
Ло, Х. В., Цао, X., Чжу, Х. и Али-Осман, Ф. Циклооксигеназа-2 является новой транскрипционной мишенью ядерных сигнальных осей EGFR-STAT3 и EGFRvIII-STAT3. Исследование молекулярного рака 8 , 232–245, DOI: 10.1158 / 1541-7786.mcr-09-0391 (2010).
CAS Статья PubMed PubMed Central Google Scholar

Хиллмер, Э. Дж., Чжан, Х., Ли, Х. С. и Ватович, С. Передача сигналов STAT3 в иммунитет. Цитокины и фактор роста отзывы 31 , 1–15, DOI: 10.1016 / j.cytogfr.2016.05.001 (2016).
Артикул Google Scholar
Ю, Х., Пардолл, Д. и Джов, Р. STATs при онкологическом воспалении и иммунитете: ведущая роль STAT3. Природные обзоры. Рак 9 , 798–809, DOI: 10.1038 / nrc2734 (2009).
CAS Статья PubMed PubMed Central Google Scholar
Акира, С.& Takeda, K. Передача сигналов толл-подобного рецептора. Природные обзоры. Иммунология 4 , 499–511, DOI: 10.1038 / nri1391 (2004).
CAS Статья PubMed Google Scholar
Лестер, С. Н. и Ли, К. Толл-подобные рецепторы в противовирусном врожденном иммунитете. Журнал молекулярной биологии 426 , 1246–1264, DOI: 10.1016 / j.jmb.2013.11.024 (2014).
CAS Статья PubMed Google Scholar
Такеучи, О. и др. . Различная роль TLR2 и TLR4 в распознавании грамотрицательных и грамположительных компонентов клеточной стенки бактерий. Иммунитет 11 , 443–451 (1999).
CAS Статья PubMed Google Scholar
Дитрих, Н., Лиененклаус, С., Вайс, С. и Гекара, Н. О. Активация толл-подобного рецептора 2 мыши вызывает ответы интерферона I типа из эндолизосомных компартментов. PloS one 5 , e10250, DOI: 10.1371 / journal.pone.0010250 (2010).
ADS Статья PubMed PubMed Central Google Scholar
Миеттинен М., Саренева Т., Юлкунен И. и Матикайнен С.IFN активируют экспрессию гена toll-подобных рецепторов при вирусных инфекциях. Гены и иммунитет 2 , 349–355, DOI: 10.1038 / sj.gene.6363791 (2001).
CAS Статья PubMed Google Scholar
Озинский, А. и др. . Репертуар распознавания патогенов врожденной иммунной системой определяется взаимодействием между толл-подобными рецепторами. Труды Национальной академии наук Соединенных Штатов Америки 97 , 13766–13771, DOI: 10.1073 / pnas.250476497 (2000).
ADS CAS Статья PubMed PubMed Central Google Scholar
Лу, Ю. К., Йе, В. К. и Охаши, П. С. Путь передачи сигнала LPS / TLR4. Цитокин 42 , 145–151, DOI: 10.1016 / j.cyto.2008.01.006 (2008).
CAS Статья PubMed Google Scholar
Alexopoulou, L., Holt, A.C., Medzhitov, R. & Flavell, R.A. Распознавание двухцепочечной РНК и активация NF-kappaB Toll-подобным рецептором 3. Nature 413 , 732–738, DOI: 10,1038 / 35099560 (2001).
ADS CAS Статья PubMed Google Scholar
Liu, BS, Stoop, JN, Huizinga, TW & Toes, RE IL-21 усиливает активность пути TLR-MyD88-STAT3, но не классического пути TLR-MyD88-NF-kappaB у человека B клетки для увеличения выработки антител. Журнал иммунологии (Балтимор, Мэриленд: 1950) 191 , 4086–4094, DOI: 10.4049 / jimmunol.1300765 (2013).
CAS Статья Google Scholar
Liu, B. S., Cao, Y., Huizinga, T. W., Hafler, D. A. & Toes, R. E. TLR-опосредованная активация STAT3 и ERK контролирует секрецию IL-10 В-клетками человека. евро J Immunol 44 , 2121–2129, DOI: 10.1002 / eji.201344341 (2014).
CAS Статья PubMed Google Scholar
Шэн-Хуа Ву, Л. Р. и Тун-Чу, С. Antrodia camphorata («ню-чанг-чи»), новая комбинация лекарственного гриба на Тайване. Бот. Бык. Акад. Грех 38 , 273–275 (1997).
Google Scholar
Geethangili, M. & Tzeng, Y.М. Обзор фармакологических эффектов Antrodia camphorata и его биоактивных соединений. Доказательная дополнительная и альтернативная медицина: eCAM 2011 , 212641, DOI: 10.1093 / ecam / nep108 (2011).
Артикул Google Scholar
Chen, C.H., Yang, S. W. и Shen, Y. C. Новые стероидные кислоты из Antrodia cinnamomea, грибкового паразита Cinnamomum micranthum. Журнал натуральных продуктов 58 , 1655–1661 (1995).
CAS Статья PubMed Google Scholar
Чен, Дж. Дж., Лин, У. Дж., Ляо, К. Х. и Ши, П. С. Противовоспалительные бензоиды из Antrodia camphorata. Журнал натуральных продуктов 70 , 989–992, DOI: 10.1021 / np070045e (2007).
CAS Статья PubMed Google Scholar
Мужской, К.Б. и др. . Исследование ингибирующих эффектов изолятов Antrodia camphorata с использованием импедансной спектроскопии на основе клеток насекомых: ингибирование в зависимости от химической структуры. Химические исследования в токсикологии 21 , 2127–2133, DOI: 10.1021 / tx800202a (2008).
CAS Статья PubMed Google Scholar
Hsieh, Y.H. et al. . Антрокамфин А, противовоспалительное средство из плодового тела Taiwanofungus camphoratus, и его механизмы. Журнал сельскохозяйственной и пищевой химии 58 , 3153–3158, DOI: 10.1021 / jf
8p (2010).
CAS Статья PubMed Google Scholar
Chien, S. C. et al. . Противовоспалительное действие новых производных янтарной и малеиновой кислоты плодового тела Antrodia camphorata. Журнал сельскохозяйственной и пищевой химии 56 , 7017–7022, DOI: 10.1021 / jf801171x (2008 г.).
CAS Статья PubMed Google Scholar
Yang, S. S. et al. . Новые компоненты с ингибирующей активностью iNOS из мицелия Antrodia camphorata. Planta medica 75 , 512–516, DOI: 10.1055 / s-0029-1185305 (2009).
CAS Статья PubMed Google Scholar
Хсеу, Ю. К. и др. . Противовоспалительный потенциал Antrodia Camphorata за счет ингибирования iNOS, COX-2 и цитокинов через путь NF-kappaB. Международная иммунофармакология 5 , 1914–1925, DOI: 10.1016 / j.intimp.2005.06.013 (2005).
CAS Статья PubMed Google Scholar
Li, M. H. et al. . Экстракт Antrodia cinnamomea подавляет дифференцировку клеток Th27 и облегчает псориазиформное воспаление кожи, вызванное имиквимодом. Американский журнал китайской медицины 43 , 1401–1417, DOI: 10,1142 / s01
x15500792 (2015).Артикул PubMed Google Scholar
Wen, C. L. et al. . Противовоспалительное действие метанольного экстракта мицелия Antrodia cinnamomea как in vitro , так и in vivo . Журнал этнофармакологии 137 , 575–584, DOI: 10.1016 / j.jep.2011.06.009 (2011).
Артикул PubMed Google Scholar
Гринхилл, К. Дж. и др. . Транс-сигнализация IL-6 модулирует TLR4-зависимые воспалительные реакции через STAT3. Журнал иммунологии (Балтимор, Мэриленд: 1950) 186 , 1199–1208, DOI: 10.4049 / jimmunol.1002971 (2011).
CAS Статья Google Scholar
О’Ши, Дж. Дж. и др. . Путь JAK-STAT: влияние на болезнь человека и терапевтическое вмешательство. Годовой обзор медицины 66 , 311–328, DOI: 10.1146 / annurev-med-051113-024537 (2015).
Артикул PubMed Google Scholar
Лоуренс Т. и Фонг С. Разрешение воспаления: противовоспалительная роль NF-kappaB. Международный журнал биохимии и клеточной биологии 42 , 519–523, DOI: 10.1016 / j.biocel.2009.12.016 (2010).
CAS Статья Google Scholar
О’Ши, Дж. Дж., Холланд, С. М. и Стаудт, Л. М. JAK и STAT при иммунитете, иммунодефиците и раке. Медицинский журнал Новой Англии 368 , 161–170, DOI: 10.1056 / NEJMra1202117 (2013).
Артикул PubMed Google Scholar
Норкина, О. и др. . Острый алкоголь активирует факторы транскрипции STAT3, AP-1 и Sp-1 через семейство киназ Src, способствуя выработке IL-10 в моноцитах человека. Журнал биологии лейкоцитов 82 , 752–762, DOI: 10.1189 / jlb.0207099 (2007).
CAS Статья PubMed Google Scholar
Чен, Ю. Ф. и др. . Жанкуевая кислота А, выделенная из Taiwanofungus camphoratus, представляет собой новый селективный антагонист TLR4 / MD-2 с противовоспалительными свойствами. Журнал иммунологии (Балтимор, Мэриленд: 1950) 192 , 2778–2786, DOI: 10.4049 / jimmunol.1301931 (2014).
CAS Статья Google Scholar
Lo, H. W., Cao, X., Zhu, H. & Ali-Osman, F. Циклооксигеназа-2 является новой транскрипционной мишенью ядерных сигнальных осей EGFR-STAT3 и EGFRvIII-STAT3. Mol Cancer Res 8 , 232–245, DOI: 10.1158 / 1541-7786.mcr-09-0391 (2010).
CAS Статья PubMed PubMed Central Google Scholar
Леви Дж. А. Неожиданная плейотропная активность RANTES. Журнал иммунологии (Балтимор, Мэриленд: 1950) 182 , 3945–3946, DOI: 10.4049 / jimmunol.09 (2009).
CAS Статья Google Scholar
Мюррей, Дж. и др. . Регулирование апоптоза нейтрофилов фактором некроза опухоли альфа: потребность в TNFR55 и TNFR75 для индукции апоптоза in vitro . Кровь 90 , 2772–2783 (1997).
CAS PubMed Google Scholar
Christensen, P. J. et al. . Характеристика продукции моноцитов хемоаттрактантного белка-1 и IL-8 при аллогенном иммунном ответе. Журнал иммунологии (Балтимор, Мэриленд: 1950) 151 , 1205–1213 (1993).
Google Scholar
Roediger, B. et al. . IL-2 является критическим регулятором функции врожденных лимфоидных клеток группы 2 во время легочного воспаления. Журнал аллергии и клинической иммунологии 136 , 1653–1663 e1651–1657, DOI: 10,1016 / j.jaci.2015.03.043 (2015).
Weber, G. F. et al. . Интерлейкин-3 усиливает острое воспаление и является потенциальной терапевтической мишенью при сепсисе. Science (Нью-Йорк, Нью-Йорк) 347 , 1260–1265, DOI: 10.1126 / science.aaa4268 (2015).
ADS CAS Статья Google Scholar
Hitoshi, Y. et al. . Распределение В-клеток, положительных по рецептору ИЛ-5.Экспрессия рецептора IL-5 на Ly-1 (CD5) + B-клетках. Журнал иммунологии (Балтимор, Мэриленд: 1950) 144 , 4218–4225 (1990).
CAS Google Scholar
Джин, В. и Донг, С. Цитокины IL-17 в иммунитете и воспалении. Новые микробы и инфекции 2 , e60, DOI: 10.1038 / emi.2013.58 (2013).
CAS Статья Google Scholar
Милькович Д. и Трайкович В. Индуцируемая активация синтазы оксида азота интерлейкином-17. Цитокины и фактор роста отзывы 15 , 21–32 (2004).
CAS Статья Google Scholar
Битти, Г. Л. и Патерсон, Ю. Регулирование роста опухоли с помощью IFN-гамма в иммунотерапии рака. Иммунологические исследования 24 , 201–210, DOI: 10.1385 / ir: 24: 2: 201 (2001).
CAS Статья PubMed Google Scholar
Kohler, A. et al. . G-CSF-опосредованное высвобождение тромбопоэтина запускает подвижность и мобилизацию нейтрофилов из костного мозга посредством индукции лигандов Cxcr2. Кровь 117 , 4349–4357, DOI: 10.1182 / blood-2010-09-308387 (2011).
Артикул PubMed PubMed Central Google Scholar
Лок, С. и др. . Клонирование и экспрессия кДНК мышиного тромбопоэтина и стимуляция продукции тромбоцитов in vivo . Природа 369 , 565–568, DOI: 10.1038 / 369565a0 (1994).
ADS CAS Статья PubMed Google Scholar
Кармелиет П. и Руис де Альмодовар, C. Лиганды и рецепторы VEGF: влияние на развитие нервной системы и нейродегенерацию. Клеточные и молекулярные науки о жизни: CMLS 70 , 1763–1778, DOI: 10.1007 / s00018-013-1283-7 (2013).
CAS Статья PubMed Google Scholar
Аггарвал Б. Б., Шисодиа С., Сандур С. К., Панди М. К. и Сетхи Г. Воспаление и рак: насколько горячая связь? Биохимическая фармакология 72 , 1605–1621, DOI: 10.1016 / j.bcp.2006.06.029 (2006).
CAS Статья PubMed Google Scholar
Хуанг, Дж. Т. и др. . Интерлейкин-4-зависимая продукция лигандов PPAR-гамма в макрофагах 12/15-липоксигеназой. Природа 400 , 378–382, DOI: 10.1038 / 22572 (1999).
ADS CAS Статья PubMed Google Scholar
Табас, И. Гибель макрофагов и дефектное разрешение воспаления при атеросклерозе. Природные обзоры. Иммунология 10 , 36–46, DOI: 10.1038 / nri2675 (2010).
CAS Статья PubMed Google Scholar
Границы | Защитный эффект экстракта воды из корней Panax notoginseng против вирусной инфекции гриппа A путем усиления антивирусных интерферон-опосредованных иммунных ответов и активности естественных киллерных клеток
Введение
Грипп, острое респираторное вирусное заболевание, вызываемое вирусом гриппа, очень заразно и ежегодно вызывает глобальные эпидемии (1–3).Младенцы и пожилые люди особенно восприимчивы к этому заболеванию, которое связано с серьезными экономическими и социальными потерями (4–6). Ежегодно во всем мире гриппом заражается около одного миллиарда человек, и, по оценкам, от этой болезни ежегодно умирает примерно 300 000–500 000 человек (7, 8).
В настоящее время вакцины и противовирусные препараты используются в основном для подавления инфекции гриппа (9). От сезонного гриппа, вызванного дрейфом антигенов, разработка эффективных вакцин в некоторой степени возможна.Однако трудно предсказать, когда произойдут вспышки новых вирусов гриппа, вызванные антигенным сдвигом. Более того, вакцины против гриппа в последнее время стали неэффективными для борьбы с новыми инфекциями (10). Следовательно, противовирусные агенты играют важную роль в борьбе с болезнями вместе с вакцинами, поскольку они могут предотвращать дальнейшее распространение болезни и лечить инфицированных в настоящее время пациентов (11).
Две группы противовирусных агентов, а именно ингибиторы нейраминидазы (NA) (перамивир, осельтамивир, ланинамивир и занамивир) и ингибиторы ионных каналов M2 (римантадин и амантадин), могут использоваться для лечения и профилактики вирусной инфекции гриппа (11, 12) .Однако длительное или многократное использование противовирусных средств способствует появлению устойчивых к лекарствам вирусов гриппа (12–14). Это привело к тому, что большинство штаммов вирусов устойчивы к ингибиторам ионного канала M2, поэтому теперь для лечения гриппа используются только ингибиторы NA. К сожалению, вирусы гриппа, устойчивые к ингибиторам NA, также появляются во всем мире. Таким образом, существует острая необходимость в новых противовирусных средствах для предотвращения пандемий гриппа. По этой причине большое внимание было уделено выявлению природных соединений, обладающих активностью против гриппа.Например, экстракты из таких растений, как Salacia reticulata (15), Ribes nigrum folium (16), Cryptoporus volvatus (17) и Psoraleae semen (18), проявили мощную противовирусную активность против вируса гриппа А.
Panax notoginseng root (PNR), также известный как sanchi или Radix Notoginseng, представляет собой хорошо известную пищевую добавку, добавку к здоровому пище и традиционной медицине из рода Panax (Araliaceae) (19, 20).Он использовался в течение тысяч лет в качестве гемостатического средства для регулирования внутримозговых кровоизлияний в Корее и Китае (20). В настоящее время PNR широко используется для лечения сердечно-сосудистых заболеваний из-за его сосудорасширяющего и антигипертензивного действия (20). Согласно недавним исследованиям, PNR проявляет антитромбоцитарные (21), антикоагулянтные (21), антигипертензивные, противомикробные (22), противоопухолевые (23–26), антиоксидантные (23), противовоспалительные (27), антикоагулянтные (27), антиатеросклеротические ( 27) и нейропротекторной активности (28).Однако не было установлено, проявляет ли PNR активность против вируса гриппа.
Врожденная иммунная система состоит из ряда компонентов, включая интерферон типа I (IFN) и провоспалительные цитокины, и является первой линией защиты от вирусной инфекции (29). Сообщается, что другой компонент врожденной иммунной системы, естественные клетки-киллеры (NK), а также макрофаги клеток адаптивной иммунной системы, ингибируют репликацию вируса и защищают от рака (15, 18).Известно, что NK-клетки обеспечивают первую линию ранней защиты от вирусных инфекций (30–32). Исследования показали, что подавление функции NK-клеток и истощение NK-клеток у мышей может приводить к заболеваемости и смертности, а также к замедлению выведения инфекции вируса гриппа (33–36). Роль NK-клеток в этом контексте включает секрецию цитокинов и цитотоксичность по отношению к инфицированным клеткам-мишеням (31). Различные типы IFN и провоспалительных цитокинов по-разному активируют NK-клетки и избирательно убивают инфицированные вирусом клетки (37–39).Таким образом, генерация IFN типа I и провоспалительных цитокинов играет важную роль в регуляции иммунной системы для активации NK-клеток и цитотоксичности (39–41). На этом фоне иммуномодуляторы могут играть важную роль, поскольку, как известно, они повышают иммунитет хозяина (повышают активность NK-клеток) и устойчивость к вирусной инфекции или раку (42). С помощью пищевых добавок можно усилить противовирусный защитный ответ хозяина, что может быть эффективным в борьбе с сопротивлением организма гриппу.Соответственно, многие исследователи искали лекарственные травы или натуральные продукты с иммуномодулирующим действием для преодоления вирусной инфекции гриппа (15, 18, 43, 44). Мы исследовали сигнальные молекулы, индуцирующие PNR, которые активируют противовирусные медиаторы, такие как IFN типа I, провоспалительные цитокины и активность NK-клеток.
В этом исследовании мы исследовали, обладает ли PNR способностью подавлять инфицирование вирусом гриппа in vitro и in vivo . Сначала мы исследовали его способность подавлять репликацию вируса гриппа и механизмы действия этого in vitro , а затем определили, может ли PNR защитить мышей от летального заражения вирусом гриппа.Наши результаты показали, что PNR значительно предотвращает инфицирование вирусом гриппа мышиных макрофагов. Кроме того, предварительная обработка PNR подавляла экспрессию вирусного белка и вирусной мРНК. Предварительная обработка PNR также увеличивала секрецию провоспалительных цитокинов и фосфорилирование IFN-родственных белков типа I in vitro . Более того, у мышей, подвергшихся воздействию вируса гриппа A h2N1, лечение PNR снижало смертность и предотвращало потерю веса по сравнению с результатами, полученными на нелеченных животных.Кроме того, спленоциты мышей, которым вводили PNR, проявляли значительно повышенную активность NK-клеток против клеток YAC-1.
Материалы и методы
Подготовка PNR
Корень Panax notoginseng был приобретен на восточном травяном рынке Йончхон (Ёнчхон, Южная Корея) и хранился в гербарии KM-Application Center (регистрационный номер # 76) KIOM, после того как его личность была подтверждена профессором Ки Хван Бэ ( Национальный университет Чунгнам, Тэджон, Южная Корея).Для приготовления высушенный PNR (50 г) погружали в дистиллированную воду (1 л) и затем экстрагировали нагреванием при 115 ° C в течение 3 часов. После фильтрации через сито (150 мкм) PNR сушили вымораживанием и хранили в эксикаторах при 4 ° C до дальнейшего использования.
Химические реактивы и хроматографические условия
Ацетонитрил для высокоэффективной жидкостной хроматографии был приобретен у Merck KGaA (Дармштадт, Германия). Сверхчистая вода (UW) была получена с использованием системы Puris-Evo UP Water с Evo-UP Dio VFT и Evo-ROP Dico20 (Mirae ST Co., Ltd., Аньян, Кенги-до, Южная Корея). UW был приготовлен с удельным сопротивлением 18,2 МОм · см -1 (Puris, Esse-UP Water system; Mirae St. Co., Аньян, Южная Корея). Нотогинсенозид R1 был приобретен в NIKOM (Национальный институт развития корейской медицины, Кёнсан, Кёнсан-Пукто, Южная Корея), а гинсенозиды Rg1, Rb1 и Rd были приобретены в ChemFaces (Хубэй, Китай). Чистота этих стандартов превышала 98,0%.
Хроматографический анализ выполняли с использованием системы Hitachi HPLC (Hitachi Co., Токио, Япония), состоящий из насоса (L-2130), автосэмплера (L-2200), термостата колонок (L-2350), диодно-матричного УФ / видимого детектора (L-2455) и детектора Alltech ELSD 3300 (Alltech , Дирфилд, Иллинойс, США). Колонку Thermo Acclaim C18 (Thermo Fisher Scientific Inc., Уолтем, Массачусетс, США) поддерживали при 40 ° C для анализа образцов. Сбор данных производился с использованием программного обеспечения EZChrom Elite (Hitachi). Подвижная фаза состояла из воды (A) и воды плюс ацетонитрил (B) при скорости потока 1,5 мл / мин со следующим градиентным потоком: 18–19% B при 0–30 мин; 19–31% B через 30–40 мин; и 31–56% B через 40–60 мин.Объем вводимого автосэмплера составлял 10 мкл, а общее время анализа составляло 60 мин.
Приготовление стандартных растворов и образцов
Образцы корней Panax notoginseng точно взвешивали (12,5 мг), погружали в 1 мл 100% метанола и экстрагировали с помощью ультразвуковой обработки в течение 30 мин. Стандартные исходные растворы готовили растворением в 100% метаноле (1 мг / мл). Все рабочие растворы фильтровали через шприцевой мембранный фильтр диаметром 0,2 мм (Whatman Ltd., Мейдстон, Великобритания) перед введением в систему ВЭЖХ.
Клетки и вирусы
RAW 264.7, YAC-1 и клетки собачьей почки Мадина-Дарби (MDCK) были получены из Американской коллекции типовых культур. Клетки MDCK поддерживали в среде DMEM, содержащей 10% (об. / Об.) Инактивированной нагреванием фетальной бычьей сыворотки (FBS) и антибиотики (пенициллин и стрептомицин) при 37 ° C и 5% CO 2 (18). RAW 264.7 и YAC-1 поддерживали в среде RPMI 1640, содержащей 10% (об. / Об.) Инактивированной нагреванием FBS и антибиотики (пенициллин и стрептомицин) при 37 ° C и 5% CO 2 .
Было полученоштаммов гриппа A [зеленый флуоресцентный белок (GFP) с меткой A / PR / 8/34 (A / PR / 8/34-GFP) и Puerto Rico / 8/34 (A / PR / 8/34)] от профессора Чон Су Ли (Национальный университет Чунгнам, Тэджон, Южная Корея). KBPV-VR-32 (h4N2) был приобретен в Корейском банке патогенных вирусов. Все три штамма размножали в аллантоидной жидкости из 10-дневных куриных эмбрионов (18, 45), и титры вирусов определяли, как описано ранее (18, 45).
Реактивы и антитела
Липополисахарид, IFN-β (рекомбинантная мышь) и фосфат осельтамивира были получены от Sigma-Aldrich (St.Луис, Миссури, США). Антитела анти-IRF3, анти-STAT1, анти-TBK1, анти-фосфо-IRF3, анти-фосфо-STAT1 и анти-фосфо-TBK1 были приобретены в компании Cell Signaling Technology (Бостон, Массачусетс, США), а антитела, направленные на белки гриппа (NP, PA, HA, PB1, PB2, M1, M2 и NA) были получены от GeneTex (Сан-Антонио, Техас, США). Анти-β-актин был приобретен в Santa Cruz Biotechnology (Санта-Крус, Калифорния, США).
Жизнеспособность клеток
Для анализа исключения трипанового синего, MDCK, YAC-1 и RAW 264.7 клеток высевали в 24-луночные планшеты с плотностью 1 × 10 5 клеток / лунку и культивировали в течение ночи перед обработкой PNR. PNR добавляли в лунки в различных концентрациях (0, 6,25, 12,5, 25, 50, 100, 200 или 400 мкг / мл). После 24 ч инкубации клетки собирали и окрашивали красителем трипановый синий в течение 5 мин при комнатной температуре. Затем суспензию клеток наносили на автоматический счетчик клеток Invitrogen Countess II FL, и клетки, окрашенные трипановым синим, считали мертвыми клетками.
Исследования на животных
Это исследование было проведено в соответствии с рекомендациями Институционального комитета по уходу и использованию животных (IACUC) Центра лабораторных животных Фонда медицинских инноваций Тэгу-Кёнбук (DGMIF). Исследования на животных были одобрены IACUC Центра лабораторных животных DGMIF под номером утверждения DGMIF-17031401-01.
Мышей BALB / c (самки в возрасте 5 недель) от Orient Bio Inc. (Соннам, Южная Корея) акклиматизировали в течение не менее 1 недели в стандартных условиях содержания в DGMIF и получали стандартный корм для грызунов и воду ad libitum .
Для пероральной инокуляции PNR и заражения вирусом гриппа A мышей разделили на три экспериментальные группы, содержащие три группы по 10 мышей в каждой [фосфатно-солевой буфер (PBS), PNR (100 мг / кг) с вирусной инфекцией и PBS с вирусная инфекция]. Мышам в последних двух группах перорально вводили 100 мг / кг PNR в общем объеме 200 мкл один раз в день в течение 7 дней до заражения.
Мышей интраназально инфицировали пятикратной летальной дозой для мышей 50% (LD 50 ) A / PR / 8/34 в 20 мкл PBS.Массу тела и выживаемость контролировали в течение 6 дней после заражения (dpi) в фиксированные моменты времени. При 5 dpi трех мышей из каждой группы случайным образом умерщвляли для измерения гистопатологии легких, а оставшихся мышей использовали для оценки выживаемости. Гистопатологически ткани легких немедленно фиксировали в парафиновом нейтральном буфере, содержащем 10% формалина, делали срезы толщиной от 4 до 6 мкм с помощью микротома, помещали на предметное стекло, окрашивали эозином и исследовали под оптическим микроскопом, как описано ранее. (46).
АктивностьNK измеряли с использованием слегка модифицированных версий ранее описанного анализа проточной цитометрии и анализа лактатдегидрогеназы (ЛДГ) (15, 47). Мышам BALB / c (возраст 6 недель, самки) перорально вводили 200 мкл 100 мг / кг PNR или PBS один раз в день в течение 7 дней, после чего выделяли спленоциты. Клетки YAC-1 окрашивали CFSE (eBioscience, Сан-Диего, Калифорния, США) в соответствии с протоколом производителя.
спленоцитов использовали в качестве эффекторных клеток, а клетки YAC-1 использовали в качестве клеток-мишеней.Спленоциты добавляли к 200 мкл культуральной среды в лунках 96-луночного культурального планшета, содержащего 1 × 10 4 CFSE-меченных клеток YAC-1 в соотношениях 5: 1, 10: 1 и 50: 1. После инкубации в течение 4 часов количество ЛДГ, высвобожденного из клеток-мишеней посредством активности NK-клеток селезенки , измеряли с использованием набора для анализа цитотоксичности ЛДГ II (Abcam, Кембридж, Великобритания) в соответствии с инструкциями производителя. После инкубации в течение 24 ч процент спонтанно лизированных клеток YAC-1, меченных CFSE, определяли с помощью проточной цитометрии.
Иммуноферментный анализ (ELISA)
Уровниинтерлейкина (IL) -6, IL-1β и фактора некроза опухоли (TNF) -α (мыши) в супернатантах культур определяли с использованием наборов антител ELISA (eBioscience) в соответствии с инструкциями поставщика (18).
Анализ ингибирования репликации вирусов
Ингибирование репликации вируса оценивали, как описано ранее (18). Вкратце, клетки RAW 264.7 культивировали в шестилуночных планшетах (1 × 10 6 клеток / лунку) в течение 12 часов.Затем клетки подвергали воздействию среды (RPMI, отрицательный контроль), 1000 ед. Рекомбинантного мышиного IFN-β (положительный контроль) или 10 или 100 мкг / мл PNR. Через 12 часов клетки инфицировали PR8 / 34-GFP [множественность инфекции (MOI) = 1]. Экспрессию GFP наблюдали под микроскопом через 24 часа вирусной инфекции, а гибель клеток измеряли с помощью анализа MTS (18). Анализ снижения вирусного выхода выполняли, как описано ранее (18).
Анализ ингибирования нейраминидазы (NI)
Анализ NI выполняли с использованием набора для анализа нейраминидазы гриппа NA-Fluor ™ (Applied Biosystems, Foster City, CA, USA) в соответствии с инструкциями производителя (45).
Количественная полимеразная цепная реакция в реальном времени (qRT-PCR)
Суммарную РНКэкстрагировали из клеточных лизатов с помощью мини-набора RNeasy (Qiagen, Hilden, Германия) в соответствии с инструкциями поставщика (18, 45). qRT-PCR выполняли с использованием AccuPower ® 2 × Greenstar qPCR Master Mix (Bioneer, Daejeon, Южная Корея) и системы ПЦР в реальном времени CFX96 Touch (Bio-Rad, Hercules, CA, USA), по словам поставщиков. инструкции (18, 45). Последовательности смыслового и антисмыслового праймеров перечислены в таблице 1.
Таблица 1 . Последовательности праймеров для количественной полимеразной цепной реакции в реальном времени.
Иммунофлуоресцентное окрашивание
Иммунофлуоресцентное окрашивание проводили, как описано ранее (18). Клетки RAW 264.7 (1 × 10 5 ), выращенные на четырехлуночных предметных стеклах с тканевыми культурами, инкубировали при 37 ° C в течение 12 часов. К клеткам добавляли PNR (100 мкг / мл) и IFN-β (1000 ЕД), которые культивировали в инкубаторе CO 2 при 37 ° C в течение 12 часов. Затем среду удаляли, а клетки промывали PBS и инфицировали h2N1 (MOI = 1) в течение 2 часов (18).Затем клетки культивировали в инкубаторе CO 2 при 37 ° C в течение 24 часов. Затем клетки промывали (трижды PBS) и фиксировали параформальдегидом (4%) и 1% Triton X-100 в течение 30 мин при комнатной температуре (18). После блокирования фиксированные клетки инкубировали в течение ночи с M2-специфическим антителом, трижды промывали TBS и инкубировали с козьим антителом против кроличьего IgG Alexa Fluor 568 (1: 1000; Life Technologies, Юджин, Орегон, США). Затем клетки инкубировали с DAPI в течение 10 мин и наблюдали под флуоресцентным микроскопом (18).
Вестерн-блоттинг
клеток RAW 264,7 (1 × 10 6 клеток / лунку) собирали в указанные моменты времени. Равные количества белкового лизата в буфере RIPA разделяли с помощью 12% SDS-PAGE (18, 45). После переноса PVDF-мембраны инкубировали при комнатной температуре в течение 1 часа с первичными антителами (1: 1000), а затем с вторичными антителами, конъюгированными с HRP (1: 2000), при комнатной температуре в течение 1 часа. Белковые полосы детектировали с помощью реагента с усиленной хемилюминесценцией и системы визуализации ChemiDoc (45).Представленные данные являются репрезентативными как минимум для трех независимых экспериментов. Денситометрический анализ выполняли с использованием программного обеспечения ImageJ.
Статистический анализ
Данные выражены как среднее ± SEM. Статистическая значимость различий средних значений между экспериментальной и контрольной группами определялась с использованием критерия хи-квадрат и поправки Бонферрони. Для анализа трех или более групп выполняли ANOVA с пост-тестом Бонферрони. Анализ выживаемости проводился методом Каплана-Мейера, а статистическая значимость различий определялась с помощью лог-рангового критерия.Анализы выполняли с использованием программного обеспечения GraphPad PRISM ® , версия 5.02 (GraphPad, La Jolla, CA, USA). P <0,05 считалось статистически значимым.
Результаты
Анализ ВЭЖХ PNR
Типичные хроматограммы ВЭЖХ стандартной смеси и экстрактов образцов PNR представлены на рисунке 1. Пики наблюдались для четырех соединений, а именно нотогинсенозида R1 (36,17 мин), гинсенозида Rg1 (40,45 мин), гинсенозида Rb1 (50.16 мин) и гинсенозид Rd (53,633 мин). Были распознаны ингредиенты PNR; их пики были идентифицированы путем сравнения их времен удерживания с таковыми нотогинсенозида R1, гинсенозида Rg1, гинсенозида Rb1 и гинсенозида Rd с последующим добавлением стандартного раствора к PNR в тех же условиях и элюированием (48, 49).
Рисунок 1 . Измерение типичных компонентов корня Panax notoginseng (PNR) с помощью высокоэффективной жидкостной хроматографии.Стандартная структура соединения (A) , стандартная длина волны УФ-излучения (B) , нотогинсенозид R1 (1), гинсенозид Rg1 (2), гинсенозид Rb1 (3) и гинсенозид Rd (4) в стандартной смеси (B) и PNR (C) на длине волны 245 нм.
Влияние PNR на цитотоксичность клеток
Чтобы определить оптимальную концентрацию PNR, которая вызывает противовирусную активность с минимальной цитотоксичностью, мы исследовали цитотоксичность PNR с помощью анализа трипанового синего после обработки MDCK, RAW 264.7, и ячейки YAC-1 с PNR на 24 часа. Результаты показали, что PNR не цитотоксичен ни для одной из линий клеток при концентрациях ≤200 мкг / мл; однако при концентрации 400 мкг / мл PNR показала цитотоксичность в отношении клеток MDCK и RAW 264.7 (рисунки 2A – C). Поэтому последующие эксперименты проводились с использованием концентрации PNR <100 мкг / мл.
Рисунок 2 . Определение цитотоксичности водного экстракта Panax notoginseng (PNR) в MDCK (A) , RAW 264.7 (B) и YAC-1 (C) ячейки. Жизнеспособность клеток RAW 264.7, YAC-1 и MDCK оценивали с помощью анализа исключения трипанового синего после 24 ч обработки PNR в указанных концентрациях. Данные представляют собой среднее значение ± SEM трех независимых экспериментов. Статистическая значимость между значениями, полученными для клеток, обработанных PNR, и клеток, не обработанных PNR, определяли с использованием критерия хи-квадрат, *** P <0,001; n.s., не имеет значения.
PNR индуцировал секрецию провоспалительных цитокинов и IFN-β и активацию пути передачи сигналов IFN типа I в макрофагах мыши
IFN типа I и провоспалительные цитокины играют важную роль в индукции противовирусных реакций и иммунорегуляторной активности (50).Таким образом, мы исследовали влияние PNR на секрецию провоспалительных цитокинов, а именно IL-6, TNF-α и IFN-β. Эксперименты проводили путем обработки PNR, IFN-β или одной средой (CON) в культурах клеток RAW 264.7. Через 24 часа инкубации были измерены уровни продукции IL-6, и результаты (рис. 3A) показывают, что 100 мкг / мл PNR индуцирует продукцию IL-6 (7,45 ± 1,392 нг / мл). Однако клетки, обработанные только средой, не продуцировали значительных уровней цитокинов (0,023 ± 0,0017 нг / мл).Кроме того, фигура 3B показывает, что PNR вызывал значительное увеличение продукции TNF-α при использовании 100 мкг / мл PNR (11,984 ± 4,245 нг / мл), а клетки, обработанные только средой, высвобождали очень низкие уровни TNF- а (0,019 ± 0,0017 нг / мл). Точно так же фигура 3C показывает, что уровни секреции IFN-β значительно увеличиваются при PNR (100 мкг / мл, 0,451 ± 0,907 нг / мл). Эти результаты показывают, что провоспалительные цитокины (IL-6 и TNF-α) и IFN-β могут быть индуцированы PNR, которая может опосредовать антивирусный статус в клетках микрофага мыши.Кроме того, противовирусный ответ PNR может быть связан с врожденными иммунными ответами за счет экспрессии IFN типа I и провоспалительных цитокинов.
Рисунок 3 . Индукция провоспалительных цитокинов и активация интерферона I типа (IFN) корнем Panax notoginseng (PNR) in vitro . (A – C) Клетки RAW 264.7 обрабатывали DMEM, содержащей только 10% фетальной бычьей сыворотки (FBS), 1000 Ед / мл рекомбинантного мышиного IFN-β или 100 мкг / мл PNR, и инкубировали при 37 ° C и 5%. СО 2 .Супернатант из каждой группы собирали через 0 и 24 часа и осветляли центрифугированием при 2500 g в течение 10 минут при 4 ° C. Осветленные супернатанты распределяли в планшеты для иммуноферментного иммуносорбентного анализа, покрытые мышиным интерлейкином (IL) -6, фактором некроза опухоли (TNF) -α и IFN-β, покрытые иммуноферментным антителом для измерения секреции цитокинов. Тест проводился в двух экземплярах. (D) Вестерн-блоттинг выполняли с использованием лизатов цельных клеток макрофагального типа, обработанных или без PNR (1, 10 и 100 мкг / мл), для оценки экспрессии нефосфорилированных и фосфорилированных форм IRF3, TANK -связывающая киназа 1 (TBK1), STAT1 и β-актин с течением времени.Были получены аналогичные результаты, и эксперимент был проведен трижды независимо. Статистические данные гистограммы (среднее ± SEM) определяли с использованием двустороннего дисперсионного анализа с поправкой Бонферрони (посттест), *** P <0,001; ** P <0,01; * P <0,05. n.s., не имеет значения.
Чтобы сопоставить вышеприведенные наблюдения с сигнальным путем IFN, мы исследовали влияние PNR на фосфорилирование белков, связанных с IFN I типа. Обработанные PNR клетки использовали для вестерн-блоттинга для анализа экспрессии нефосфорилированных и фосфорилированных форм IRF3, STAT1 и TANK-связывающей киназы 1 (TBK1).Фосфорилирование IRF3, STAT1 и TBK1 увеличивалось после обработки PNR (100 мкг / мл) в клетках RAW 264.7 (рис. 3D) по сравнению с результатами для необработанных клеток. Фосфорилирование IRF3 представляет собой перемещение молекул IRF3 в ядро и инициацию транскрипции IFN типа I (51). Это побуждает IFN типа I связываться с компонентом пути JAK / STAT, что приводит к фосфорилированию STAT1 и активации транскрипции стимулированных IFN генов (51). Взяв все эти данные вместе, предполагается, что PNR может вызывать антивирусный статус RAW264.7 путем модуляции сигнального пути IFN, который может ингибировать репликацию вируса.
PNR ингибирует инфекцию вирусом гриппа A в клетках RAW 264.7
Чтобы оценить действие PNR против вируса гриппа A, мы использовали GFP-экспрессирующие вирусы, как описано ранее (18, 45). Предварительная обработка клеток RAW 264.7, инфицированных A / PR8 / 34-GFP (MOI = 1), PNR приводила к заметному снижению экспрессии GFP в зависимости от концентрации (рис. 4A), а гибель, вызванная вирусом, также зависела от концентрации. подавляется в предварительно обработанных клетках (рис. 4B).Мы также подтвердили, что по сравнению с титром супернатанта необработанных клеток, инфицированных A / PR8 / 34-GFP [16 единиц гемагглютинации (HAU)], титры A / PR8 / 34-GFP- и PNR / A / PR8 / 34-GFP-инфицированные клетки, обработанные 1 (4 HAU), 10 или 100 мкг / мл PNR (1 HAU) или IFN-β (0 HAU), значительно снизились (Фигуры 4C, D). Эти результаты свидетельствуют о том, что PNR ингибирует индуцированную A / PR8 / 34 экспрессию GFP и гибель клеток в клетках RAW 264.7.
Рисунок 4 . Противовирусная активность корня Panax notoginseng (PNR) в отношении вируса гриппа A / PR / 8/34-GFP в RAW 264.7 сот. (A) Клетки RAW 264.7 обрабатывали PNR (10 и 100 мкг / мл) перед заражением A / PR / 8/34-GFP, и клетки инкубировали только с средой, PNR 10 или 100 мкг / мл, или 1000 Ед / мл интерферона (IFN) -β за 12 ч до инфицирования A / PR / 8/34-GFP (множественность инфекции = 1). Изображения экспрессии GFP были получены через 24 часа после заражения вирусом. (B) Подсчет и жизнеспособность клеток определяли через 24 часа после заражения вирусом с использованием анализа исключения трипанового синего. Статистическая значимость между значениями, полученными для вирусной инфекции и отсутствия вирусной инфекции клеток, была определена с использованием критерия хи-квадрат и поправки Бонферрони (пост-тест), *** P <0.001; * P <0,05; n.s., не имеет значения. (C, D) Вирусы титровали из супернатанта с помощью анализа гемагглютинации . (E, F) Клетки RAW 264.7 обрабатывали PNR (1, 10 или 100 мкг / мл), IFN-β (1000 Ед / мл) или только средой (отрицательный контроль). Уровни белка вируса гриппа A / PR / 8/34 A (NP, PA, M1, M2, PB1, PB2, HA и NA) в клеточных лизатах анализировали с помощью вестерн-блоттинга, а экспрессию β-актина анализировали в качестве внутреннего контроля. . Были получены аналогичные результаты, и эксперимент был проведен трижды независимо.Статистические данные в виде гистограммы (среднее значение ± стандартная ошибка среднего) определяли с использованием двухфакторного дисперсионного анализа с поправкой Бонферрони (пост-тест), *** P <0,001; ** P <0,01; * P <0,05. n.s., не имеет значения.
Мы исследовали, ингибирует ли PNR экспрессию вирусного белка A / PR8 / 34 (NP, PA, M1, M2, PB1, PB2, HA и NA), используя вестерн-блоттинг в клетках RAW 264.7, предварительно обработанных PNR (1, 10 или 100 мкг). / мл). Результаты показали, что PNR значительно ингибирует экспрессию всех изученных вирусных белков A / PR8 / 34, за исключением PA, в зависимости от концентрации (рисунки 4E, F).
Мы также исследовали, снижает ли PNR синтез вирусной мРНК A / PR8 / 34 (NS1, HA, PB2, PA, NP, M1 и M2) с помощью qRT-PCR. Уровни мРНК NS1 и PA (рис. 4A, E) были значительно снижены при предварительной обработке PNR (100 мкг / мл) в клетках RAW 264.7 по сравнению с результатами в группах IFN-β и только вирусов. Кроме того, синтез мРНК NS1, HA, PB2, NP, M1 и M2 значительно ингибировался предварительной обработкой PNR (100 мкг / мл) по сравнению с результатами в группах, содержащих только вирусы (рис. 5).
Рисунок 5 .Влияние компонентов из корня Panax notoginseng (PNR) на синтез мРНК гриппа A / PR / 8/34. Предварительная обработка PNR (100 мкг / мл) и интерферона (IFN) -β (1000 Ед / мл) инфицированных вирусом гриппа A / PR / 8/34 (множественность инфекции = 1) клеток RAW 264.7 и относительные уровни мРНК вируса гриппа A / PR / 8/34 NS1 (A) , NS2 (B) , HA (C) , PB2 (D) , PA (E) , NP (F) , M1 (G) и M2 (H) анализировали с помощью количественной полимеразной цепной реакции в реальном времени и нормализовали до уровней β-актина.Данные представлены как среднее значение ± стандартное отклонение трех независимых экспериментов. Статистические данные в виде гистограммы (среднее значение ± стандартная ошибка среднего) определяли с использованием двухфакторного дисперсионного анализа с поправкой Бонферрони (пост-тест), *** P <0,001; ** P <0,01; * P <0,05. n.s., не имеет значения.
Далее мы исследовали влияние 100 мкг / мл PNR на экспрессию белка M2 с помощью иммунофлуоресцентного анализа после 24 часов воздействия A / PR / 8/34. Экспрессия белка M2 была значительно подавлена в RAW 264.7 клеток, обработанных PNR или IFN-β (рис. 6).
Рисунок 6 . Panax notoginseng root (PNR) снижал экспрессию белка M2 вируса гриппа A / PR / 8/34 (h2N1) в инфицированных клетках RAW 264.7. Иммунофлуоресцентный анализ проиллюстрировал уровень белка M2 гриппа A в клетках RAW 264.7. Клетки обрабатывали PNR (100 мкг / мл) или интерфероном (IFN) -β (1000 Ед / мл) после инфицирования вирусом гриппа А. M2-специфические антитела к вирусу гриппа А использовали для наблюдения за белком в RAW 264.7 клеток с помощью флуоресцентной микроскопии . Клетки также окрашивали DAPI, и объединенное изображение показывает цитоплазматическое расположение M2 (красный).
Влияние PNR на активность NA
Мы исследовали, влияет ли PNR на активность NA вирусов гриппа А. Активность NA из A / PR / 8/34, A / PR / 8/34-GFP и h4N2 ингибировалась лечением PNR в зависимости от концентрации (Рисунок 7), однако только высокая концентрация PNR ( 1000 мкг / мл) оказывал подавляющее действие на A / PR / 8/34 (12.743%), A / PR / 8/34-GFP (28,346%) и h4N2 (19,808%) NA.
Рисунок 7 . Измерение противовирусной активности корня Panax notoginseng (PNR) с использованием анализов ингибирования нейраминидазы. Вирусы гриппа A (A / PR / 8/34-GFP h2N1 и h4N2) добавляли в количестве 32 единиц гемагглютинации (HAU) к указанным концентрациям PNR, осельтамивир фосфата (положительный контроль) или фосфатно-солевого буфера (PBS) ( отрицательный контроль), смешивали с субстратом NA-Fluor ™ и инкубировали при 37 ° C в течение 1 ч в темноте (A – C) .Флуоресценцию контролировали с помощью флуоресцентной спектрометрии (возбуждение, 365 нм; испускание, 445 нм). Данные представлены как среднее значение ± стандартная ошибка среднего из трех независимых экспериментов. Статистические данные гистограммы (среднее ± SEM) определяли с использованием двустороннего дисперсионного анализа с поправкой Бонферрони (посттест), *** P <0,001; ** P <0,01; * P <0,05. n.s., не имеет значения.
PNR ингибирует инфекцию вирусом гриппа A у мышей BALB / c
Мы сначала исследовали защитные эффекты PNR против инфицирования вирусом гриппа A у мышей.Мыши, получавшие PNR (100 мг / кг) один раз в день, сохраняли относительно стабильную массу тела и не проявляли каких-либо значительных клинических симптомов на протяжении всего исследования (данные не показаны). Необработанные мыши, инфицированные A / PR / 8/34, показали значительную потерю массы тела на 3-5 точек на дюйм перед смертью в пределах 6 точек на дюйм (рис. 8). Напротив, мыши, получавшие PNR, демонстрировали значительно сниженную смертность и повышенную выживаемость после инфекции A / PR / 8/34 (фиг. 8A). Однако лечение PNR (100 мг / кг) не защищало от потери веса тела после вирусной инфекции (фиг. 8B).В легких нелеченных мышей обнаружены некротический бронхиальный и бронхиолярный эпителий, кровоизлияние, утолщение альвеол и заметная инфильтрация воспалительных клеток (рис. 8С). Напротив, у мышей, получавших PNR, наблюдалось значительно меньшее воспаление легких по сравнению с необработанными мышами.
Рисунок 8 . Влияние экстракта корня Panax notoginseng (PNR) на вирусную инфекцию гриппа А у мышей. Мышам BALB / c предварительно вводили перорально водный экстракт 100 мг / кг PNR (200 мкл / мышь) за 1, 2, 3, 4, 5, 6 и 7 дней до заражения вирусом. (A) процент выживаемости и (B) масса тела контролировались ежедневно до 6 дней после заражения. (C) Репрезентативное изображение H&E гистопатологического повреждения срезов легочной ткани от необработанных мышей или мышей, получавших PNR. Для оценки значимости наблюдаемых различий использовали лог-ранговый тест (A) и двухфакторный дисперсионный анализ с поправкой Бонферрони (посттест) (B) . *** P <0,001, н.у., несущественно. Представлены среднее значение и SEM.
Влияние PNR на активность NK-клеток изолированных спленоцитов
Мы исследовали влияние перорального PNR (100 мг / кг) на активность NK-клеток, используя YAC-1 (клетки-мишени) и анализ LDH. При соотношении эффекторных клеток: клеток-мишеней 50: 1 активность NK-клеток спленоцитов мышей, обработанных PNR, была значительно увеличена по сравнению с активностью спленоцитов мышей, обработанных PBS (фиг. 9A). Кроме того, мы исследовали активность NK-клеток и цитотоксические эффекты PNR на клетки-мишени посредством совместного культивирования с клетками YAC-1, меченными CFSE (рис. 9В).Через 24 часа, как показано на Фигуре 9, спленоциты мышей, которым вводили PNR, проявляли значительно повышенную активность NK-клеток против клеток YAC-1 при соотношении эффекторных клеток: клеток-мишеней 50: 1.
Рисунок 9 . Активность естественных киллеров (NK) в спленоцитах мышей, которым вводили водный экстракт корня Panax notoginseng (PNR, 100 мг / кг). Спленоциты мышей, которым вводили PNR или фосфатно-солевой буфер (PBS) (CON), инкубировали с клетками YAC-1, и определяли содержание высвобожденной лактатдегидрогеназы (LDH) с помощью анализа цитотоксичности LDH или проточного цитометрического анализа и флуоресцентной микроскопии. . (A) Активность NK-клеток в спленоцитах мышей при соотношении эффекторных клеток: клеток-мишеней 5: 1, 10: 1 или 50: 1. (B) Спонтанный лизис CFSE-меченных клеток YAC-1 во время инкубации со спленоцитами мышей, которым вводили PNR или PBS, сравнивали с лизисом в отсутствие эффекторных клеток. Статистические данные в виде гистограммы (среднее ± стандартная ошибка среднего) определяли с использованием двустороннего дисперсионного анализа с поправкой Бонферрони (пост-тест). *** P <0,001, н.у., несущественно.
Обсуждение
У людей и других организмов иммунная система участвует в поддержании гомеостаза, несмотря на постоянный шквал атак инфекционных агентов из окружающей среды (52).Существенные исследования были сосредоточены на усилении иммунных ответов с использованием активных ингредиентов, присутствующих в пищевых продуктах и лекарственных травах (53, 54).
Врожденная иммунная система, включая такие компоненты, как IFN типа I, является первой важной линией противовирусной защиты хозяина (55). Кроме того, IFN типа I играет центральную роль в противовирусных ответах, индуцируя экспрессию противовирусных генов, которые ингибируют репликацию вируса и вызывают апоптотическую гибель клеток в инфицированных вирусом клетках (56). Механизм врожденных противовирусных иммунных ответов, опосредованных рецепторами распознавания образов (PRR), был предметом интенсивных исследований (57).PRR, включая toll-подобные рецепторы, NOD-подобные рецепторы, ДНК-рецепторы и RIG-I-подобные рецепторы, распознают микробные компоненты, известные как патоген-ассоциированные молекулярные паттерны, которые приводят к продукции IFN-типа I и провоспалительных цитокинов (55 , 58). PRR требуют ключевой молекулы TANK-связывающей киназы 1 (TBK1) для активации фактора транскрипции IRF3, что приводит к индукции IFN типа I и экспрессии антивирусных генов через путь JAK / STAT (59, 60).
Известно, что макрофаги и NK-клетки, классифицируемые как члены иммунной системы, играют важную роль в ранней защите от вирусных инфекций (30–32).Результаты показали, что подавление NK-клеток или их удаление из мышей может привести к заболеваемости и смертности, а также к задержке удаления вирусов после заражения (33–36). Известно, что NK-клетки играют решающую роль в врожденных иммунных ответах на вирусы, такие как грипп, особенно за счет цитотоксичности и высвобождения цитокинов в инфицированные клетки-мишени (31). Провоспалительные цитокины и IFN, которые активируют NK-клетки, активируются IFN или цитокинами, происходящими из макрофагов, и распознают изменения в экспрессии MHC класса I, таким образом подавляя активацию неинфицированных клеток и селективно индуцируя апоптоз инфицированных клеток.
Недавние исследования показали, что IFN типа I и STAT1 необходимы для ответа NK-клеток после вирусной инфекции (37). Кроме того, IFN типа I напрямую влияют на экспрессию ключевых молекул-активаторов NK-клеток посредством фосфорилирования STAT1 (9). Таким образом, генерация IFN типа I и провоспалительных цитокинов играет важную роль в обеспечении того, чтобы иммунная система могла предотвращать активацию NK-клеток и цитотоксичность (39–41). Исследования показали, что иммуномодуляторы повышают иммунитет хозяина, например повышают активность NK-клеток и устойчивость к вирусным инфекциям (42).Кроме того, IFN, такие как IFN-β, ингибируют репликацию различных вирусов и действуют как ключевые эффекторные молекулы в иммунном ответе против вирусов (61, 62). Таким образом, цитокины являются многообещающими мишенями для противовирусных агентов для усиления иммунного ответа хозяина на инфекцию вируса гриппа. Кроме того, для быстрого ответа на вирусную инвазию IFN могут активировать определенные элементы иммунного ответа, которые могут препятствовать репликации вируса.
На этом фоне многие исследователи изучали травы или натуральные продукты с иммуномодулирующей активностью с целью преодоления вирусной инфекции гриппа (15, 18, 43, 44).Таким образом, в этом исследовании мы провели исследование фосфорилирования белков IRF3, TBK1 и STAT1 в обработанных PNR клетках RAW264.7, чтобы определить влияние PNR на активацию сигнальных молекул IFN типа I. Мы подтвердили, что PNR значительно ингибирует инфицирование вирусом гриппа в зависимости от дозы в макрофагах мышей. Результаты также показали, что предварительная обработка PNR ингибировала экспрессию вирусных белков и мРНК. При анализе механизмов действия PNR было обнаружено, что предварительная обработка PNR увеличивает продукцию IFN-β и провоспалительных цитокинов (TNF-α и IL-6) и индуцирует фосфорилирование IFN-связанных белков I типа. , такие как TBK1, STAT1 и IRF3, in vitro (Рисунок 3).Результаты показали, что IFN типа I связывается с компонентом пути JAK / STAT, что приводит к фосфорилированию STAT1 и активации транскрипции стимулированных IFN генов (51). В целом результаты показывают, что PNR может индуцировать антивирусный статус клеток RAW264.7 путем модуляции пути передачи сигнала IFN, который может ингибировать репликацию вируса (рис. 10).
Рисунок 10 . Схема механизма действия корня Panax notoginseng (PNR) в его усилении антивирусных интерферон-опосредованных иммунных ответов и активности естественных киллеров (NK).PNR стимулирует антивирусное состояние в клетках макрофагов мышей, модулируя путь передачи сигнала интерферона (IFN). PNR приводит к активации IRF3 посредством TANK-связывающей киназы 1 (TBK1) и продукции IFN типа I. Этот секретируемый IFN может индуцировать ингибирование инфекции вирусом гриппа A путем стимуляции экспрессии стимулированных генов-мишеней посредством активации сигнального преобразователя и активатора транскрипции 1, и эти эффекты могут быть связаны со способностью PNR индуцировать активность NK-клеток.
В соответствии с этим, мыши, получавшие PNR, продемонстрировали снижение смертности и защиту от потери веса после заражения h2N1 на 90% по сравнению с данными, полученными на необработанных мышах (рис. 8). Это показывает, что предварительная обработка мышей PNR защищает от летальных эффектов вируса гриппа A по сравнению с результатами в группе вирусной инфекции без PNR. Однако PNR показал слабый защитный эффект против потери веса мышей через 9 дней после инфицирования вирусом гриппа А.В модели инфицированных гриппом мышей масса тела снижается на ранней стадии инфекции, но у мышей, которые выживают после инфицирования вирусом гриппа, наблюдается восстановление массы тела и уменьшение симптомов, связанных с инфекцией. Таким образом, в случае мышей, предварительно обработанных PNR, которые пережили вирусную инфекцию, они также могут набирать вес. Кроме того, необходимо увеличить продолжительность анализа в исследованиях против гриппа, чтобы найти фактор, лежащий в основе PNR.
Крупный коммерческий женьшень известен как P.ginseng Meyer, P. notoginseng и P. quinquifolium (63). Сообщается, что женьшень является наиболее часто используемым показанием для лечения показаний, повышения физической работоспособности и наличия иммуномодулирующей активности (63). Химические компоненты женьшеня включают фармакологические свойства, такие как гинзенозиды, полисахариды и эфирные масла (64). Женьшень и его очищенные компоненты обладают защитным действием против широкого спектра вирусных инфекций (64–67).Нотогинсенозид ST-4, выделенный из P. notoginseng , подавляет проникновение вируса простого герпеса (68). Недавние исследования показали, что олигопептид, компонент P. ginseng , модулирует врожденный адаптивный иммунный ответ у мышей, увеличивая фагоцитарную способность и секрецию активности NK-клеток в макрофагах (69). Кроме того, гинсенозид Rb1 обладает повышенной естественной активностью по уничтожению спленоцитов (70), а гинсенозид Re также значительно усиливает сывороточно-специфический IgG в ответ на вирус гриппа A (71).Кроме того, сапонины P. notoginseng (72) и гинсенозид Rg3 (73) улучшали иммунные ответы на OVA у мышей. В этом исследовании мы также подтвердили, что мыши, которым вводили PNR, демонстрировали значительно повышенную активность NK-клеток против клеток YAC-1 (рис. 9). Если вместе взятые вышеупомянутые данные, PNR вызывает антивирусное состояние в макрофагах мышей и мышей, что приводит к ингибированию вирусной инфекции; эти эффекты могут быть связаны со способностью PNR индуцировать активность NK-клеток.Следовательно, можно видеть, что эти составляющие соединения, такие как гинзенозиды или полисахариды, в PNR синергетически усиливают иммунный ответ. Таким образом, PNR оказывает иммуномодулирующее действие на врожденные иммунные ответы, предоставляя потенциально полезную информацию для применения профилактических и терапевтических методов лечения инфекции, вызванной вирусом гриппа А. Однако необходимы углубленные исследования инфекции вирусом гриппа А (рис. 10). Молекулярный механизм иммуномодулирующего действия PNR и его компонентов.
Быстрое появление новых инфекционных вирусов и лекарственно-устойчивых вариантов ограничило доступность эффективных противовирусных агентов и вакцин. Таким образом, существует острая необходимость в разработке противовирусных и иммуномодулирующих средств широкого спектра действия, которые стимулируют иммунитет хозяина и повышают его сопротивляемость. Противовирусная активность PNR объясняется усилением иммунитета хозяина. В будущих исследованиях следует определить компоненты, ответственные за усиленный иммунитет против любых вирусных атак.Чтобы определить основные молекулярные механизмы, связанные с инфекцией гриппа, противовирусная активность компонентов PNR требует дальнейшего изучения.
Таким образом, мы продемонстрировали, что лечение PNR снижает вызванную вирусом гриппа A смертность у мышей на 90% и защищает от потери веса (примерно на 10%) по сравнению с результатами, полученными на необработанных мышах. Кроме того, введение PNR увеличивало активность NK-клеток в спленоцитах мыши. Следует изучить защитные эффекты компонентов PNR против инфекции гриппа, чтобы получить более глубокое понимание основных молекулярных механизмов.Кроме того, на основании полученных результатов можно сделать рациональные выводы относительно противовирусного действия PNR на мышиных моделях инфекции. Взятые вместе, эти результаты предполагают, что PNR может быть эффективным против инфекционных заболеваний, таких как грипп. На основе результатов мы выдвигаем гипотезу, что PNR является эффективным противовирусным агентом или адъювантом вакцины для лечения инфекции вируса гриппа.
Заявление об этике
Все эксперименты на животных проводились в соответствии с инструкциями по уходу и использованию лабораторных животных IACUC Центра лабораторных животных DGMIF.Протокол был одобрен IACUC DGMIF.
Авторские взносы
Разработал дизайн исследования и отредактировал документ: JM, WC и JC. Проведенные эксперименты: HL, YJ, NY, TO и JC. Проанализированы данные: JC и Y-HJ. Написал статью: JC.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Рецензент IM и редактор отдела обработки заявили о своей общей принадлежности.
Благодарности
Это исследование было поддержано грантом № K17281, выданным Корейскому институту восточной медицины. Авторы высоко оценивают расположение животных уровня биобезопасности 2 (ABSL2) и техническую поддержку со стороны сотрудников Центра лабораторных животных Фонда медицинских инноваций Тэгу-Кёнбук.
Сокращения
DGMIF, Фонд медицинских инноваций Тэгу-Кёнбук; ELISA, иммуноферментный анализ; FBS, фетальная бычья сыворотка; GFP, зеленый флуоресцентный белок; IACUC, Комитет по институциональному уходу за животными и их использованию; KBPV, Корейский банк патогенных вирусов; KIOM, Корейский институт восточной медицины; КМ, корейская медицина; NI, ингибирование нейраминидазы; Н.К., естественный убийца; PAMP, патоген-ассоциированные молекулярные структуры; PBS, фосфатно-солевой буфер; PNR, Panax notoginseng root; PRR, рецепторы распознавания образов; RLR, RIG-I-подобные рецепторы; UW, сверхчистая вода.
Список литературы
2. Гарсия-Гарсия Дж., Рамос К. [Грипп, существующая проблема общественного здравоохранения]. Salud Publica Mex (2006) 48: 244–67.
PubMed Аннотация | Google Scholar
4. Нойзил К.М., Меллен Б.Г., Райт П.Ф., Митчел Э.Ф. мл., Гриффин М.Р. Влияние гриппа на госпитализации, амбулаторные посещения и курсы антибиотиков у детей. N Engl J Med (2000) 342: 225–31. DOI: 10.1056 / NEJM200001273420401
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5.Изуриета Х.С., Томпсон В.В., Крамарц П., Шей Д.К., Дэвис Р.Л., ДеСтефано Ф. и др. Грипп и частота госпитализаций по поводу респираторных заболеваний среди детей грудного и раннего возраста. N Engl J Med (2000) 342: 232–9. DOI: 10.1056 / NEJM200001273420402
PubMed Аннотация | CrossRef Полный текст | Google Scholar
6. Комеда Т., Исии С., Ито Ю., Санеката М., Йошикава Т., Шимада Дж. Постмаркетинговая оценка безопасности внутривенного антигриппозного ингибитора нейраминидазы перамивир: исследование использования лекарств у пациентов с высокими факторами риска. J Infect Chemother (2016) 22: 677–84. DOI: 10.1016 / j.jiac.2016.07.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Томпсон В.В., Шей Д.К., Вайнтрауб Э., Браммер Л., Бриджес С.Б., Кокс, штат Нью-Джерси, и др. Госпитализации, связанные с гриппом, в США. JAMA (2004) 292: 1333–40. DOI: 10.1001 / jama.292.11.1333
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Остерхольм М. Т., Келли Н. С., Соммер А., Белонгиа Е. А..Эффективность и действенность вакцин против гриппа: систематический обзор и метаанализ. Lancet Infect Dis (2012) 12: 36–44. DOI: 10.1016 / S1473-3099 (11) 70295-X
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Soema PC, Kompier R, Amorij JP, Kersten GF. Противогриппозные вакцины нынешнего и следующего поколений: разработка и стратегии производства. Eur J Pharm Biopharm (2015) 94: 251–63. DOI: 10.1016 / j.ejpb.2015.05.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11.Де Клерк Э. Противовирусные средства, активные против вирусов гриппа А. Nat Rev Drug Discov (2006) 5: 1015–25. DOI: 10.1038 / nrd2175
CrossRef Полный текст | Google Scholar
15. Ромеро-Перес Г.А., Эгашира М., Харада Й., Цурута Т., Ода Й., Уэда Ф. и др. Перорально вводимый экстракт Salacia reticulata снижает клинические симптомы гриппа h2N1 в тканях легких мышей, предположительно из-за повышенной активности естественных клеток-киллеров. Фронт Иммунол (2016) 7: 115.DOI: 10.3389 / fimmu.2016.00115
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Хаасбах Э., Хартмайер С., Хеттлер А., Сарнецка А., Вулле Ю., Эрхард С. и др. Противовирусная активность Ladania067, экстракта из листьев дикой черной смородины, против вируса гриппа A in vitro и in vivo. Front Microbiol (2014) 5: 171. DOI: 10.3389 / fmicb.2014.00171
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Гао Л., Сунь Й., Си Дж., Лю Дж., Сунь Дж., Сунь X и др. Экстракт Cryptoporus volvatus подавляет репликацию вируса гриппа in vitro и in vivo. PLoS One (2014) 9: e113604. DOI: 10.1371 / journal.pone.0113604
CrossRef Полный текст | Google Scholar
18. Choi JG, Jin YH, Kim JH, Oh TW, Yim NH, Cho WK и др. Противовирусная активность водного экстракта Psoraleae semen против вирусов гриппа А in vitro. Front Pharmacol (2016) 7: 460. DOI: 10.3389 / fphar.2016.00460
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19.Лян М.Т., Подолка ТД, Чуанг В.Дж. Добавка Panax notoginseng улучшает физическую работоспособность во время упражнений на выносливость. J Strength Cond Res (2005) 19: 108–14. DOI: 10.1519 / 00124278-200502000-00019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Ян Х, Сюн Х, Ван Х, Ван Дж. Защитные эффекты сапонинов Panax notoginseng при сердечно-сосудистых заболеваниях: всесторонний обзор экспериментальных исследований. Evid Based Complement Alternat Med (2014) 2014: 204840.DOI: 10.1155 / 2014/204840
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Лау А.Дж., То Д.Ф., Чуа Т.К., Панг Ю.К., Ву СО, Ко Х.Л. Антиагрегантные и антикоагулянтные эффекты Panax notoginseng : сравнение сырого и приготовленного на пару Panax notoginseng с Panax ginseng и Panax quinquefolium . Дж. Этнофармакол (2009) 125: 380–6. DOI: 10.1016 / j.jep.2009.07.038
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22.Jin Z, Gao L, Zhang L, Liu T, Yu F, Zhang Z и др. Антимикробная активность сапонинов, продуцируемых двумя новыми эндофитными грибами из Panax notoginseng . Nat Prod Res (2017) 31: 2700–3. DOI: 10.1080 / 14786419.2017.12
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. He NW, Zhao Y, Guo L, Shang J, Yang XB. Антиоксидантная, антипролиферативная и проапоптотическая активность экстракта сапонина, полученного из корней Panax notoginseng (Burk.) F.H. Chen. J Med Food (2012) 15: 350–9. DOI: 10.1089 / jmf.2011.1801
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Ван Ч.З., Ло Х, Чжан Б., Сонг В.X., Ни М., Мехендейл С. и др. Нотогинсенг усиливает противораковое действие 5-фторурацила на клетки колоректального рака человека. Cancer Chemother Pharmacol (2007) 60: 69–79. DOI: 10.1007 / s00280-006-0350-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Ян Цюй, Ван П, Цуй Дж., Ван В., Чен И, Чжан Т. Panax notoginseng сапонины ослабляют рост рака легких частично за счет модуляции уровня оси Met / miR-222. Дж. Этнофармакол (2016) 193: 255–65. DOI: 10.1016 / j.jep.2016.08.040
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Ши X, Ю В, Ян Т., Лю В., Чжао И, Сунь И и др. Panax notoginseng сапонины обеспечивают нейрозащиту, регулируя экспрессию пути NgR1 / RhoA / ROCK2 in vitro и in vivo. Дж. Этнофармакол (2016) 190: 301–12.DOI: 10.1016 / j.jep.2016.06.017
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Ван Т., Го Р., Чжоу Г., Чжоу Х, Коу З., Суй Ф. и др. Традиционное использование, ботаника, фитохимия, фармакология и токсикология Panax notoginseng (Burk.) F.H. Chen: обзор. Дж. Этнофармакол (2016) 188: 234–58. DOI: 10.1016 / j.jep.2016.05.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Хуан Дж. Л., Цзин Х, Тиан Х, Цинь М.К., Сюй Чж, Ву Д.П. и др.Нейропротекторные свойства сапонинов Panax notoginseng за счет предотвращения повреждения от окислительного стресса у мышей SAMP8. Evid Based Complement Alternat Med (2017) 2017: 8713561. DOI: 10.1155 / 2017/8713561
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Андерсон К.В. Пути передачи сигналов Toll при врожденном иммунном ответе. Curr Opin Immunol (2000) 12: 13–9. DOI: 10.1016 / S0952-7915 (99) 00045-X
CrossRef Полный текст | Google Scholar
30.Fuchs A, Colonna M. Естественные киллеры (NK) и NK-подобные клетки в эпителии слизистой оболочки: медиаторы антимикробной защиты и поддержания целостности ткани. Eur J Microbiol Immunol (2011) 1: 257–66. DOI: 10.1556 / EuJMI.1.2011.4.1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32. Bukowski JF, Warner JF, Dennert G, Welsh RM. Исследования адоптивного переноса, демонстрирующие противовирусный эффект естественных клеток-киллеров in vivo. J Exp Med (1985) 161: 40–52.DOI: 10.1084 / jem.161.1.40
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Газит Р., Груда Р., Эльбойм М., Арнон Т.И., Кац Г., Ахдаут Х. и др. Смертельная инфекция гриппа в отсутствие гена рецептора естественных клеток-киллеров Ncr1. Nat Immunol (2006) 7: 517–23. DOI: 10.1038 / ni1322
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Ногуса С., Ритц Б.В., Кассим С.Х., Дженнингс С.Р., Гарднер Э.М. Характеристика возрастных изменений естественных клеток-киллеров при первичном гриппе у мышей. Mech Aging Dev (2008) 129: 223–30. DOI: 10.1016 / j.mad.2008.01.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35. O’Brien KB, Schultz-Cherry S, Knoll LJ. Опосредованная паразитами активация гамма-интерферона, полученного из NK-клеток, защищает от тяжелой высокопатогенной инфекции вируса гриппа H5N1. J Virol (2011) 85: 8680–8. DOI: 10.1128 / JVI.05142-11
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Ли М., Го К., Адачи Ю., Икехара С.Иммунная дисфункция, связанная с аномальными мезенхимальными стромальными клетками костного мозга у мышей с ускоренным старением. Int J Mol Sci (2016) 17: E183. DOI: 10.3390 / ijms17020183
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Мадера С., Рапп М., Ферт М.А., Бейлке Дж. Н., Ланье Л.Л., Сан Дж. С.. IFN типа I способствует размножению NK-клеток во время вирусной инфекции, защищая NK-клетки от братоубийства. J Exp Med (2016) 213: 225–33. DOI: 10.1084 / jem.20150712
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38.Чейс Дж. Х., Хукер Н. А., Мильденштейн К. Л., Криг А. М., Каудери Дж. С.. Бактериальная ДНК-индуцированная продукция IFN-гамма NK-клетками зависит от секреции IL-12 макрофагами. Clin Immunol Immunopathol (1997) 84: 185–93. DOI: 10.1006 / Clin.1997.4380
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Sun JC, Madera S, Bezman NA, Beilke JN, Kaplan MH, Lanier LL. Передача сигналов провоспалительных цитокинов необходима для генерации памяти естественных клеток-киллеров. J Exp Med (2012) 209: 947–54.DOI: 10.1084 / jem.20111760
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Ли С.К., Рао Д.Т., Гертнер Р., Гимено Р., Фрей А.Б., Леви, Делавэр. Четкие требования к IFN и STAT1 в функции NK-клеток. J Immunol (2000) 165: 3571–7. DOI: 10.4049 / jimmunol.165.7.3571
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Ван Р., Джоу Дж. Дж., Штутцман, Северная Каролина, Цзоу З., Сан П.П. IFN-гамма и TNF-альфа, продуцируемые естественными клетками-киллерами, индуцируют цитолиз клеток-мишеней за счет активации ICAM-1. J Leukoc Biol (2012) 91: 299–309. DOI: 10.1189 / jlb.0611308
CrossRef Полный текст | Google Scholar
43. Фиалью Л.Г., да Силва В.П., Рейс С.Р., Азередо Е.Л., Каплан М.А., Фигейредо М.Р. и др. Противовирусное и иммуномодулирующее действие Norantea brasiliensis на вирус денге-2. Intervirology (2016) 59: 217–27. DOI: 10.1159 / 000455855
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Gqaleni N, Ngcobo M, Parboosing R, Naidoo A.Тестирование in vitro традиционных африканских лекарств на цитотоксическую, иммуномодулирующую и анти-ВИЧ активность. Afr J Tradit Complement Altern Med (2012) 9: 2–11.
PubMed Аннотация | Google Scholar
45. Джин Й.Х., Чой Дж. Г., Чо В. К., Ма Дж. Й. Этанольный экстракт мелии фруктус обладает активностью против вируса гриппа А, влияя на проникновение вируса и вирусную РНК-полимеразу. Front Microbiol (2017) 8: 476. DOI: 10.3389 / fmicb.2017.00476
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46.Talactac MR, Chowdhury MY, Park ME, Weeratunga P, Kim TH, Cho WK, et al. Противовирусное действие нового лекарственного средства на травах КИОМ-С на различные вирусы. PLoS One (2015) 10: e0125357. DOI: 10.1371 / journal.pone.0125357
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47. Чан И, Сон ХК, Йом М., Чжон, округ Колумбия. Иммуномодулирующий эффект прегабалина на клетки селезенки мышей с невропатией. Анест Аналг (2012) 115: 830–6. DOI: 10.1213 / ANE.0b013e31825d2ad1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48.Ван Дж.Б., Ян Ф.К., Ли С.П., Ван Ю.Т., Цуй ХМ. Химические характеристики различных частей Panax notoginseng с использованием жидкостной экстракции под давлением и HPLC-ELSD. J Pharm Biomed Anal (2006) 41: 1596–601. DOI: 10.1016 / j.jpba.2005.10.023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49. Гуань Дж., Лай К.М., Ли С.П. Экспресс-метод одновременного определения 11 сапонинов в Panax notoginseng с использованием ультраэффективной жидкостной хроматографии. J Pharm Biomed Anal (2007) 44: 996–1000. DOI: 10.1016 / j.jpba.2007.03.032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Теофилопулос А.Н., Баккала Р., Бейтлер Б., Коно Д.Х. Интерфероны типа I (альфа / бета) для иммунитета и аутоиммунитета. Annu Rev Immunol (2005) 23: 307–36. DOI: 10.1146 / annurev.immunol.23.021704.115843
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Рафтери Н., Стивенсон, штат Нью-Джерси. Достижения в области противовирусной иммунной защиты: раскрытие важности пути IFN JAK / STAT. Cell Mol Life Sci (2017) 74: 2525–35. DOI: 10.1007 / s00018-017-2520-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Атанасов А.Г., Вальтенбергер Б., Пферши-Венциг Е.М., Линдер Т., Ваврош С., Угрин П. и др. Открытие и пополнение запасов фармакологически активных натуральных продуктов растительного происхождения: обзор. Biotechnol Adv (2015) 33: 1582–614. DOI: 10.1016 / j.biotechadv.2015.08.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
55.Акира С., Уэмацу С., Такеучи О. Распознавание патогенов и врожденный иммунитет. Cell (2006) 124: 783–801. DOI: 10.1016 / j.cell.2006.02.015
CrossRef Полный текст | Google Scholar
56. Такеучи О., Акира С. Рецепторы распознавания образов и воспаление. Cell (2010) 140: 805–20. DOI: 10.1016 / j.cell.2010.01.022
CrossRef Полный текст | Google Scholar
61. Фиппс-Йонас Х., Сето Дж., Силфон С.К., Моран TM, Фернандес-Сесма А. Предварительная обработка обычных и плазмоцитоидных дендритных клеток человека интерфероном-бета усиливает их активацию вирусом гриппа. PLoS Pathog (2008) 4: e1000193. DOI: 10.1371 / journal.ppat.1000193
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62. Дурбин Дж. Э., Фернандес-Сесма А., Ли С. К., Рао Т. Д., Фрей А. Б., Моран Т. М. и др. IFN типа I модулирует врожденный и специфический противовирусный иммунитет. Дж. Иммунол (2000) 164: 4220–8. DOI: 10.4049 / jimmunol.164.8.4220
PubMed Аннотация | CrossRef Полный текст | Google Scholar
64. Им К., Ким Дж., Мин Х. Женьшень, природный эффективный противовирусный препарат: защитные эффекты корейского красного женьшеня против вирусной инфекции. J Ginseng Res (2016) 40: 309–14. DOI: 10.1016 / j.jgr.2015.09.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
65. Чан Л.Я., Квок Х.Х., Чан Р.В., Пейрис М.Дж., Мак Н.К., Вонг Р.Н. и др. Двойные функции гинсенозидов в защите эндотелиальных клеток человека от воспаления и апоптоза, вызванного гриппом H9N2. Дж. Этнофармакол (2011) 137: 1542–6. DOI: 10.1016 / j.jep.2011.08.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
66.Инь С.Ю., Ким HJ, Ким HJ. Сравнительное исследование эффектов цельного экстракта красного женьшеня и полисахаридных и сапониновых фракций на инфекцию вирусом гриппа A (h2N1). Biol Pharm Bull (2013) 36: 1002–7. DOI: 10.1248 / bpb.b13-00123
PubMed Аннотация | CrossRef Полный текст | Google Scholar
67. Чо А., Ро Ю.С., Уянгаа Е., Пак С., Ким Дж. У., Лим К. Х. и др. Защитные эффекты экстракта красного женьшеня против инфекции вируса простого герпеса влагалища. J Ginseng Res (2013) 37: 210–8.DOI: 10.5142 / jgr.2013.37.210
PubMed Аннотация | CrossRef Полный текст | Google Scholar
68. Пэй И, Ду Цюй, Ляо ПЙ, Чен З.П., Ван Д., Ян Ч.Р. и др. Нотогинсенозид ST-4 подавляет проникновение вируса простого герпеса in vitro. J Asian Nat Prod Res (2011) 13: 498–504. DOI: 10.1080 / 10286020.2011.571645
PubMed Аннотация | CrossRef Полный текст | Google Scholar
69. He LX, Ren JW, Liu R, Chen QH, Zhao J, Wu X и др. Олигопептиды женьшеня ( Panax ginseng Meyer) регулируют врожденные и адаптивные иммунные ответы у мышей за счет увеличения фагоцитозной способности макрофагов, активности NK-клеток и секреции Th-клеток. Food Funct (2017) 8: 3523–32. DOI: 10.1039 / c7fo00957g
PubMed Аннотация | CrossRef Полный текст | Google Scholar
71. Song X, Chen J, Sakwiwatkul K, Li R, Hu S. Повышение иммунного ответа на вакцину против гриппа (h4N2) гинсенозидом Re. Int Immunopharmacol (2010) 10: 351–6. DOI: 10.1016 / j.intimp.2009.12.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
72. Сан Х.Х., Йе Й.П., Пан Х.Дж., Пан Й. Адъювантный эффект сапонинов Panax notoginseng на иммунные ответы на овальбумин у мышей. Vaccine (2004) 22: 3882–9. DOI: 10.1016 / j.vaccine.2004.04.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
73. Wei X, Chen J, Su F, Su X, Hu T, Hu S. Стереоспецифичность гинсенозида Rg3 в стимулировании иммунного ответа на овальбумин у мышей. Int Immunol (2012) 24: 465–71. DOI: 10.1093 / intimm / dxs043
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ингибирование IFN-γ-зависимой противовирусной эпителиальной защиты дыхательных путей сигаретным дымом | Респираторные исследования
Gürkan F, Kiral A, Dagli E, Karakoç F: Влияние пассивного курения на развитие респираторно-синцитиального вирусного бронхиолита. Eur J Epidemiol 2000, 16: 465–468.
Артикул PubMed Google Scholar
Bradley JP, Bacharier LB, Bonfiglio J, Schechtman KB, Strunk R, Storch G, Castro M: Тяжесть респираторно-синцитиального вирусного бронхиолита зависит от воздействия сигаретного дыма и атопии. Педиатрия 2005, 115: e7-e14.
PubMed Google Scholar
Министерство здравоохранения и социальных служб США: Последствия для здоровья непроизвольного воздействия табачного дыма: отчет Главного хирурга. Департамент здравоохранения и социальных служб, Центры по контролю и профилактике заболеваний, Координационный центр по укреплению здоровья, Национальный центр профилактики хронических заболеваний и укрепления здоровья, Управление по курению и здоровью, Атланта, Джорджия; 2006 г.
Benseñor IM, Cook NR, Lee IM, Chown MJ, Hennekens CH, Buring JE, Manson JE: Активное и пассивное курение и риск простуды у женщин. Ann Epidemiol 2001, 11: 225–231.
Артикул PubMed Google Scholar
Блейк Г.Х., Абелл Т.Д., Стэнли РГ: Курение сигарет и инфекции верхних дыхательных путей среди новобранцев, проходящих базовую боевую подготовку. Ann Intern Med 1988, 109: 198–202.
CAS Статья PubMed Google Scholar
Коэн С., Тиррелл Д.А., Рассел М.А., Джарвис М.Дж., Смит А.П.: Курение, употребление алкоголя и предрасположенность к простуде. Am J Public Health 1993, 83: 1277–1283.
CAS Статья PubMed PubMed Central Google Scholar
Карк Д.Д., Лебиуш М., Раннон L: Курение сигарет как фактор риска эпидемического гриппа A (h2N1) у молодых мужчин. N Engl J Med 1982, 307: 1042–1046.
CAS Статья PubMed Google Scholar
Бах Э.А., Агует М., Шрайбер RD: Рецептор IFN-g: парадигма передачи сигналов рецептора цитокина. Annu Rev Immunol 1997, 15: 563–591.
CAS Статья PubMed Google Scholar
Танигучи Т., Такаока A: Слабый сигнал для сильных ответов: снова интерферон-α / β. Nature Reviews 2001, 2: 378–386.
CAS Статья PubMed Google Scholar
Bach EA, Tanner JW, Marsters S, Ashkenazi A, Aguet M, Shaw AS, Schreiber RD: Лиганд-индуцированная сборка и активация рецептора гамма-интерферона в интактных клетках. Mol Cell Biol 1996, 16: 3214–3221.
CAS Статья PubMed PubMed Central Google Scholar
Greenlund AC, Morales MO, Viviano BL, Yan H, Krolewski J, Schreiber RD: Рекрутмент Stat тирозин-фосфорилированными цитокиновыми рецепторами: упорядоченный обратимый процесс, управляемый аффинностью. Иммунитет 1995, 2: 677–687.
CAS Статья PubMed Google Scholar
Look DC, Pelletier MR, Tidwell RM, Roswit WT, Holtzman MJ: Stat1 зависит от транскрипционной синергии с Sp1. J Biol Chem 1995, 270: 30264–30267.
CAS Статья PubMed Google Scholar
Zhang JJ, Vinkemeier E, Gu W, Chakravarti D, Horvath CM, Darnell JE: Две контактные области между Stat1 и CBP / p300 в передаче сигналов интерферона g. Proc Natl Acad Sci USA 1996, 93: 15092–15096.
CAS Статья PubMed PubMed Central Google Scholar
Joseph TD, Look DC: Специфическое ингибирование путей передачи сигнала интерферона аденовирусной инфекцией. J Biol Chem 2001, 276: 47136–47142.
CAS Статья PubMed Google Scholar
Aldallal N, McNaughton EE, Manzel LJ, Richards AM, Zabner J, Ferkol TW, Look DC: Воспалительная реакция в эпителиальных клетках дыхательных путей, выделенных от пациентов с муковисцидозом. Am J Respir Crit Care Med 2002, 166: 1248–1256.
Артикул PubMed Google Scholar
Look DC, Keller BT, Rapp SR, Holtzman MJ: Избирательная индукция молекулы межклеточной адгезии-1 интерфероном-g в эпителиальных клетках дыхательных путей человека. Am J Physiol 1992, 263: L79-L87.
CAS PubMed Google Scholar
Frick AG, Joseph TD, Pang L, Rabe AM, St. Geme JW III, Look DC: Haemophilus influenzae стимулирует экспрессию ICAM-1 на клетках респираторного эпителия. J Immunol 2000, 164: 4185–4196.
CAS Статья PubMed Google Scholar
Chin CL, Manzel LJ, Lehman EE, Humlicek AL, Shi L, Starner TD, Denning GM, Murphy TF, Sethi S, Look DC: Haemophilus influenzae от пациентов с обострением хронической обструктивной болезни легких вызывают еще большее воспаление чем колонизаторы. Am J Respir Crit Care Med 2005, 172: 85–91.
Артикул PubMed PubMed Central Google Scholar
Ramaswamy M, Shi L, Monick MM, Hunninghake GW, Look DC: Специфическое ингибирование передачи сигнала интерферона типа I респираторно-синцитиальным вирусом. Am J Respir Cell Mol Biol 2004, 30: 893–900.
CAS Статья PubMed Google Scholar
Ramaswamy M, Shi L, Varga SM, Barik S, Behlke MA, Look DC: Неструктурный белок 2 респираторно-синцитиального вируса специфически ингибирует передачу сигнала интерферона I типа. Virology 2006, 344: 328–339.
CAS Статья PubMed Google Scholar
Humlicek AL, Manzel LJ, Chin CL, Shi L, Excoffon KJ, Winter MC, Shasby DM, Look DC: Параклеточная проницаемость ограничивает эпителиальные реакции дыхательных путей, что позволяет избирательно активировать медиаторы на базолатеральной поверхности. J Immunol 2007, 178: 6395–6403.
CAS Статья PubMed Google Scholar
Manzel LJ, Chin CL, Behlke MA, Look DC: Регуляция индуцированной бактериями молекулы-1 межклеточной адгезии с помощью CCAAT / связывающих белков энхансера. Am J Respir Cell Mol Biol 2009, 40: 200–210.
CAS Статья PubMed Google Scholar
Расбанд WS: ImageJ. [http://rsb.info.nih.gov/ij/] Национальные институты здравоохранения, Бетесда, Мэриленд; 1997.
Хассард TH: Понимание биостатистики. Сент-Луис, Миссури: Мосби-Год Бук, Инк; 1991.
Google Scholar
Veals SA, Schindler C, Leonard DB, Fu XY, Aebersold RH, Darnell JE, Levy DE: Субъединица альфа-интерферон-чувствительного фактора транскрипции связана с регуляторным фактором интерферона и семействами ДНК Myb. связывающие белки. Mol Cell Biol 1992, 12: 3315–3324.
CAS Статья PubMed PubMed Central Google Scholar
Wong LH, Hatzinisiriou I, Devenish RJ, Ralph SJ: Примирование IFN-g активирует компоненты фактора 3 гена, стимулированного IFN (ISGF3), повышая чувствительность IFN-устойчивых клеток меланомы к IFN типа I. J Immunol 1998, 160: 5475–5484.
CAS PubMed Google Scholar
Look DC, Pelletier MR, Holtzman MJ: Селективное взаимодействие подмножества белков, связывающих элемент ответа интерферона-g, с промотором гена молекулы межклеточной адгезии-1 (ICAM-1) контролирует характер экспрессии на эпителиальных клетках. J Biol Chem 1994, 269: 8952–8958.
CAS PubMed Google Scholar
Horvath CM, Darnell JE: Противовирусное состояние, индуцированное альфа- и гамма-интерфероном, требует транскрипционно активного белка Stat1. J Virol 1996, 70: 647–650.
CAS PubMed PubMed Central Google Scholar
Walter MJ, Look DC, Tidwell RM, Roswit WT, Holtzman MJ: Целевое ингибирование интерферон-γ-зависимой экспрессии ICAM-1 с использованием доминантно-отрицательного Stat1. J Biol Chem 1997, 272: 28582–28589.
CAS Статья PubMed Google Scholar
Бухвалова М.С., Принц Г.А., Бланко JCG: Респираторно-синцитиальный вирус инфицирует и преждевременно реплицируется в легких, несмотря на ранее существовавший иммунитет. J Virol 2007, 81: 9443–9450.
CAS Статья PubMed PubMed Central Google Scholar
Pryor WA, Prier DG, Church DF: Исследование электронно-спинового резонанса основного и побочного сигаретного дыма: природа свободных радикалов в газовой фазе дыма и в сигаретной смоле. Environ Health Perspect 1983, 47: 345–355.
CAS Статья PubMed PubMed Central Google Scholar
Прайор В.А., Стоун К: Окислители в сигаретном дыме. Радикалы, перекись водорода, пероксинитрат и пероксинитрит. Ann N Y Acad Sci 1993, 686: 12–28.
CAS Статья PubMed Google Scholar
Eiserich JP, Vliet A, Handelman GJ, Halliwell B, Cross CE: Диетические антиоксиданты и биомолекулярное повреждение, вызванное сигаретным дымом: сложное взаимодействие. Am J Clin Nutr 1995, 62: 1490S-1500S.
CAS PubMed Google Scholar
Rahman I, Biswas SK, Kode A: Окислительный и антиоксидантный баланс в дыхательных путях и заболеваниях дыхательных путей. Eur J Pharmacol 2006, 533: 222–239.
CAS Статья PubMed Google Scholar
Zang LY, Stone K, Pryor WA: Обнаружение свободных радикалов в водных экстрактах сигаретной смолы с помощью электронно-спинового резонанса. Free Radic Biol Med 1995, 19: 161–167.
CAS Статья PubMed Google Scholar
MacNee W: Окислители / антиоксиданты и ХОБЛ. Комод 2000, 117: 303S-317S.
CAS Статья PubMed Google Scholar
Джоши-Барве С., Аманчерла К., Патил М., Бхатнагар А., Мэтьюз С., Гобеджишвили Л., Кейв М., Макклейн С., Барве С. Акролеин, повсеместно распространенный загрязнитель и продукт гидропероксида липидов, ингибирует противовирусную активность. интерферон-альфа: отношение к гепатиту С. Free Radic Biol Med 2009, 47: 47–54.
CAS Статья PubMed PubMed Central Google Scholar
Groskreutz DJ, Monick MM, Babor EC, Nyunoya T, Varga SM, Look DC, Hunninghake GW: Сигаретный дым изменяет индуцированный респираторно-синцитиальным вирусом апоптоз и репликацию. Am J Respir Cell Mol Biol 2009, 41: 189–198.
CAS Статья PubMed PubMed Central Google Scholar
Hellermann GR, Nagy SB, Kong X, Lockey RF, Mohapatra SS: Механизм острой воспалительной реакции, вызванной конденсатом сигаретного дыма, в эпителиальных клетках бронхов человека. Respir Res 2002, 3: 22.
Статья PubMed PubMed Central Google Scholar
Лю Х, Того С., Аль-Муготир М., Ким Х, Фанг Q, Кобаяши Т., Ван Х, Мао Л., Биттерман П., Реннард С.: NF-kappaB обеспечивает выживание эпителиальных клеток бронхов человека подвергается воздействию экстракта сигаретного дыма. Respir Res 2008, 9: 66.
Статья PubMed PubMed Central Google Scholar
Petecchia L, Sabatini F, Varesio L, Camoirano A, Usai C, Pezzolo A, Rossi GA: Повреждение эпителиальных клеток бронхиальных дыхательных путей после воздействия сигаретного дыма включает разборку компонентов плотного соединения, опосредованную внеклеточным сигналом. регулируемый путь киназы 1/2. Сундук 2009, 135: 1502–1512.
CAS Статья PubMed Google Scholar
Shapiro SD: Дым попадает в ваши камеры. Am J Respir Cell Mol Biol 2004, 31: 481–482.
CAS Статья PubMed Google Scholar
Моррисон Д., Рахман И., Ланнан С., Макни В.: Проницаемость эпителия, воспаление и окислительный стресс в воздушном пространстве курильщиков. Am J Respir Crit Care Med 1999, 159: 473–479.
CAS Статья PubMed Google Scholar
Rahman I, MacNee W: Регулирование уровней окислительно-восстановительного глутатиона и транскрипции генов при воспалении легких: терапевтические подходы. Free Radic Biol Med 2000, 28: 1405–1420.
CAS Статья PubMed Google Scholar
Rahman I, Smith CAD, Lawson MF, Harrison DJ, MacNee W: Индукция γ-глутамилцистеинсинтетазы сигаретным дымом связана с AP-1 в альвеолярных эпителиальных клетках человека. FEBS Lett 1996, 396: 21–25.
CAS Статья PubMed Google Scholar
Knörr-Wittmann C, Hengstermann A, Gebel S, Alam J, Müller T: Характеристика активации Nrf2 и экспрессии гемоксигеназы-1 в клетках NIh4T3, подвергнутых воздействию водных экстрактов сигаретного дыма. Free Radic Biol Med 2005, 39: 1438–1448.
Артикул PubMed Google Scholar
HuangFu WC, Liu J, Harty RN, Fuchs SY: Продукты для курения сигарет подавляют противовирусные эффекты интерферона I типа посредством зависимой от фосфорилирования регуляции его рецептора. FEBS Lett 2008, 582: 3206–3210.
CAS Статья PubMed PubMed Central Google Scholar
Goh KC, Haque SJ, Williams BRG: p38 MAP-киназа необходима для фосфорилирования серина STAT1 и активации транскрипции, индуцированной интерферонами. EMBO J 1999, 18: 5601–5608.
CAS Статья PubMed PubMed Central Google Scholar
Нгуен Х., Рамана С.В., Байес Дж., Старк GR: Роль фосфатидилинозитол-3-киназы в интерферон-γ-зависимом фосфорилировании STAT1 по серину 727 и активации экспрессии гена. J Biol Chem 2001, 276: 33361–33368.
CAS Статья PubMed Google Scholar
Deb DK, Sassano A, Lekmine F, Majchrzak B, Verma A, Kambhampati S, Uddin S, Rahman A, Fish EN, Platanias LC: Активация протеинкиназы Cδ IFN-γ. J Immunol 2003, 171: 267–273.
CAS Статья PubMed Google Scholar
Chang Y, Holtzman MJ, Chen C: Дифференциальная роль киназ семейства janus (JAKs) в индуцированной интерфероном-γ экспрессии легочного эпителия ICAM-1: включая белковые взаимодействия между JAK, фосфолипазой cγ, c-Src и STAT1. Mol Pharmacol 2004, 65: 589–598.
CAS Статья PubMed Google Scholar
Bauer CM, Dewitte-Orr SJ, Hornby KR, Zavitz CC, Lichty BD, Stämpfli MR, Mossman KL: Сигаретный дым подавляет опосредованный интерфероном противовирусный иммунитет I типа в фибробластах легких и эпителиальных клетках. J Interferon Cytokine Res 2008, 28: 167–179.
CAS Статья PubMed Google Scholar
Mian MF, Stämpfli MR, Mossman KL, Ashkar AA: Ослабление в сигаретном дыме индуцированных поли I: C врожденных противовирусных реакций в PBMC человека в основном связано с ингибированием продукции IFN-beta. Мол Иммунол 2009, 46: 821–829.
CAS Статья PubMed Google Scholar
Браун К.М., Корниш Т., Валм А., Кундифф Дж., Поли Дж. Л., Фан С: Иммунотоксикология конденсатов сигаретного дыма: подавление реакции макрофагов на гамма-интерферон. Toxicol Appl Pharmacol 1998, 149: 136–143.
CAS Статья PubMed Google Scholar
Эдвардс К., Браун К.М., Эванс Дж., Сурека А.О., Вентилятор S: Конденсаты сигаретного дыма в основном и побочном потоке подавляют реакцию макрофагов на гамма-интерферон. Hum Exp Toxicol 1999, 18: 233–240.
CAS Статья PubMed Google Scholar
Диллон Н.К., Мерфи В.Дж., Филла МБ, Креспо А.Дж., Латам Х.А., О’Брайен-Ладнер А: Понижающая модуляция передачи сигналов IFN-гамма в альвеолярных макрофагах, выделенных от курильщиков. Toxicol Appl Pharmacol 2009, 237: 22–28.
CAS Статья PubMed PubMed Central Google Scholar
Ван Г., Забнер Дж., Диринг С., Лаунспач Дж., Шао Дж., Боднер М., Веселый Д. Д., Дэвидсон Б. Л., МакКрей PBJ: Повышение проницаемости эпителиальных соединений увеличивает перенос генов в эпителий дыхательных путей In vivo. Am J Respir Cell Mol Biol 2000, 22: 129–138.
Артикул PubMed Google Scholar
Дранник А.Г., Пулади М.А., Роббинс С.С., Гончарова С.И., Кианпур С., Штемпфли М.Р.: Влияние сигаретного дыма на клиренс и воспаление после инфекции Pseudomonas aeruginosa. Am J Respir Crit Care Med 2004, 170: 1164–1171.
Артикул PubMed Google Scholar
Sopori M: Влияние сигаретного дыма на иммунную систему. Nat Rev Immunol 2002, 2: 372–377.
CAS Статья PubMed Google Scholar
Роббинс К.С., Бауэр С.М., Вуйчич Н., Гашлер Г.Дж., Личти Б.Д., Браун Е.Г., Штемпфли М.Р.: Сигаретный дым влияет на иммунные воспалительные реакции на грипп у мышей. Am J Respir Crit Care Med 2006, 174: 1342–1351.
CAS Статья PubMed Google Scholar
Vlahos R, Bozinovski S, Jones JE, Powell J, Gras J, Lilja A, Hansen MJ, Gualano RC, Irving L, Anderson GP: Профили дифференцированной протеазы, врожденного иммунитета и индукции NF-κB во время воспаление легких, вызванное субхроническим воздействием сигаретного дыма у мышей. Am J Physiol Lung Cell Mol Physiol 2006, 290: L931-L945.
CAS Статья PubMed Google Scholar
Биррелл М.А., Вонг С., Кэтли М.К., Белвиси М.Г.: Влияние табачного дыма на ключевые сигнальные пути врожденного иммунного ответа в макрофагах легких. J Cell Physiol 2007, 214: 27–37.
Артикул Google Scholar
Devalia JL, Campbell AM, Sapsford RJ, Rusznak C, Quint D, Godard P, Bousquet J, Davies RJ: Влияние диоксида азота на синтез воспалительных цитокинов, экспрессируемых эпителиальными клетками бронхов человека in vitro. Am J Respir Cell Mol Biol 1993, 9: 271–278.
CAS Статья PubMed Google Scholar
Rusznak C, Devalia JL, Sapsford RJ, Davies RJ: Озон-индуцированное высвобождение медиатора из эпителиальных клеток бронхов человека in vitro и влияние недокромила натрия. Eur Respir J 1996, 9: 2298–2305.
CAS Статья PubMed Google Scholar
Роббинс С.С., Доу Д.Е., Гончарова С.И., Пулади М.А., Дранник А.Г., Свирски Ф.К., Кокс Г., Штемпфли MR: Сигаретный дым уменьшает количество дендритных клеток легких и влияет на противовирусный иммунный ответ. Am J Respir Cell Mol Biol 2004, 30: 202–211.
CAS Статья PubMed Google Scholar
Castro SM, Kolli D, Guerrero-Plata A, Garofalo RP, Casola A: Конденсат сигаретного дыма усиливает индуцированное респираторно-синцитиальным вирусом высвобождение хемокинов, модулируя NF-каппа B и активацию регуляторного фактора интерферона. Toxicol Sci 2008, 106: 509–518.
CAS Статья PubMed PubMed Central Google Scholar
Phaybouth V, Wang SZ, Hutt JA, McDonald JD, Harrod KS, Barrett EG: Сигаретный дым подавляет выработку цитокинов Th2 и увеличивает экспрессию RSV в модели новорожденных. Am J Physiol Lung Cell Mol Physiol 2006, 290: L222-L231.
CAS Статья PubMed Google Scholar
IFN-γ и его субъединица рецептора IFNGR1 рекрутируются на IFN-γ-активированный элемент последовательности в промоторном сайте IFN-γ-активированных генов: доказательства трансактивационной активности в IFNGR1
Abstract
Ранее мы показали, что IFN-γ и одна из его рецепторных субъединиц, IFNGR1, перемещаются в ядро вместе со STAT1α в виде одного макромолекулярного комплекса посредством классического импортин-зависимого пути.В этом исследовании мы идентифицировали ядерные мишени IFN-γ и IFNGR1. Путем иммунопреципитации хроматина с последующей ПЦР было обнаружено, что IFN-γ, его субъединица рецептора IFNGR1 и STAT1α связаны с IFN-γ-активированной последовательностью (GAS) в промоторе двух генов, стимулированных IFN-γ. Иммунопреципитированный хроматин также показал ассоциацию IFN-γ, IFNGR1 и STAT1α на одной и той же последовательности ДНК. Исследование ядерных экстрактов из клеток WISH, обработанных IFN-γ, выявило специфическое связывание IFN-γ, IFNGR1 и STAT1α с биотинилированной нуклеотидной последовательностью GAS.Ассоциация IFN-γ, IFNGR1 и STAT1α с промотором GAS также была продемонстрирована EMSA. Трансфекция геном GAS-люциферазы вместе с IFNGR1 и несекретированным IFN-γ приводила к усилению репортерной активности. Кроме того, IFNGR1, слитый с дрожжевым ДНК-связывающим доменом GAL4, приводил к усилению транскрипции из ответного элемента GAL4, что позволяет предположить наличие домена активации trans в IFNGR1. Наши наблюдения показывают, что IFN-γ и его субъединица рецептора IFNGR1 находятся в прямом контакте с промоторной областью IFN-γ-активированных генов с ассоциированной повышенной активностью, что позволяет предположить транскрипционную / котранскрипционную роль IFN-γ / IFNGR1, а также возможную роль в определении специфичности действия IFN-γ.
В течение некоторого времени было известно, что интерферон-γ перемещается в ядро экспрессирующих рецептор клеток с такой же быстрой кинетикой, как и при активации и ядерной транслокации фактора транскрипции STAT1α, который он активирует (1, 2). Совсем недавно было показано, что ядерная транслокация IFN-γ управляется последовательностью ядерной локализации (NLS) 3 на ее С-конце (3, 4). Мутации IFN-γ NLS разрушают его биологическую активность, которая может быть восстановлена путем восстановления NLS из T Ag вируса SV40 (4, 5).Известно, что T Ag NLS локализуется в ядре IMPα / β1 / Ran-зависимым образом. Избыток пептида T Ag NLS ингибирует IFN-γ NLS-зависимый ядерный импорт, предполагая, что IFN-γ NLS опосредует ядерный импорт через тот же путь (3). Результаты экспериментов по иммунопреципитации, которые выявили эндоцитозированный IFN-γ, связанный с IMPα5 (NPI-1) в клетках, активно транспортирующих IFN-γ в ядро, согласуются с этим выводом (4).
Последующие эксперименты показали, что α-субъединица рецептора IFNGR1 гетероолигомерного рецептора также перемещается в ядро в клетках, обработанных IFN-γ, в то время как β-субъединица (IFNGR2) не перемещается (4, 6, 7). ).Поглощение IFN-γ представляет собой рецептор-опосредованный эндоцитозный процесс; недавние исследования показали, что липидные микродомены плазматической мембраны являются основными участками эндоцитозных событий, ведущих к ядерной транслокации IFN-γ, IFNGR1, а также STAT1α (8).
Транспортировка IFN-γ, роль его NLS и то, как это связано с передачей / функцией сигнала, были предметом недавних исследований. IFN-γ NLS, как известно, вносит минимальный вклад во внеклеточное связывание рецептор-лиганд с высоким сродством, но он необходим для эндоцитоза рецептора.После эндоцитоза C-концевой домен IFN-γ (включая NLS), по-видимому, также способен взаимодействовать с внутриклеточным цитоплазматическим доменом IFNGR1 (остатки 253–287) рецепторного комплекса IFN-γ (9). Это связывание, для которого требуется NLS, также увеличивает сродство киназы семейства Janus JAK2 к IFNGR1 (10). Примечательно, что С-концевой пептид IFN-γ (а.о. 95–133), который содержит домен NLS, может действовать как агонист при внутриклеточной доставке и индуцировать классические активности IFN-γ по противовирусной защите и повышающей регуляции молекул MHC класса II ( 11).Этот внутриклеточный агонист / миметический пептид не активен в отношении клеток IFNGR1 — / — , что свидетельствует о необходимости цитоплазматического домена IFNGR1. Более того, внутриклеточный миметик индуцирует аутофосфорилирование JAK2 (9), а также ядерную транслокацию как IFNGR1, так и STAT1α (6), сравнимую с таковой при добавлении внеклеточного IFN-γ. Удаление NLS в миметике отменяет биологическую активность, а также способность индуцировать ядерную транслокацию IFNGR1 и STAT1α. В соответствии с этими наблюдениями, внутриклеточная экспрессия полноразмерной несекретированной формы IFN-γ может также влиять на ядерную транслокацию IFNGR1, активацию и ядерную транслокацию STAT1α, а также на индукцию биологической активности, обычно вызываемой добавлением внеклеточного IFN-γ. (4).Внутриклеточная экспрессия мутанта IFN-γ, в котором основные остатки NLS были заменены аланинами, не вызывала ядерную транслокацию IFNGR1 или STAT1α и приводила к потере активности IFN-γ (4). Это предполагает, что NLS IFN-γ функционирует внутриклеточно, опосредуя взаимодействие со специфическими внутриклеточными компонентами, критическими для активности IFN-γ.
Внутриклеточный избыток пептида, представляющего цитоплазматический сайт связывания IFNGR1 с С-концом IFN-γ, предотвращал образование комплекса интернализованного IFN-γ с цитоплазматическим доменом IFNGR1 клеточной поверхности в клетках, которые активно интернализовали IFN-γ (6 ).Более того, такие клетки также были блокированы в отношении фосфорилирования тирозина STAT1α. Таким образом, интернализованный IFN-γ, по-видимому, способен взаимодействовать с цитоплазматическим доменом IFNGR1 в интактных клетках как часть событий передачи сигнала, ведущих к фосфорилированию тирозина STAT1α. Цитозольная инъекция Abs к IFN-γ aa 95–133 блокирует ядерную транслокацию STAT1α в ответ на внеклеточный IFN-γ (6), что дополнительно подтверждает идею о том, что C-конец эндоцитозированного IFN-γ получает доступ к цитозолю, хотя механизм такой пока не определено.
Требование IFN-γ NLS для интернализации, связывания с цитоплазматическим доменом IFNGR1, активации JAK2 и STAT1α и ядерной транслокации активированных STAT1α и IFNGR1 предполагает, что некоторые или все эти процессы могут быть связаны, предположительно через NLS. В соответствии с этим было замечено, что после интернализации внеклеточный IFN-γ может быть восстановлен, непосредственно связанный с IMPα5, в цитозольном комплексе IFN-γ / IFNGR1 / фосфорилированный STAT1α (4). Образование комплекса зависело от IFN-γ NLS.
Возникает вопрос, действуют ли IFN-γ и IFNGR1 исключительно как шапероны для ядерного транспорта STAT1α или они также действуют как факторы транскрипции / котранскрипции, вызывая активацию IFN-γ-специфического гена. В этом исследовании мы сообщаем, что как IFN-γ, так и IFNGR1 связываются с элементом ответа на активированную IFN-γ последовательность (GAS) в промоторной области генов, активируемых IFN-γ. Кроме того, мы показываем, что это связывание приводит к усиленной активации генов, индуцированных IFN-γ.
Материалы и методы
Культура клеток и Abs
клеток WISH были приобретены из Американской коллекции типовых культур (ATCC) и выращены в DMEM с 10% FBS и антибиотиками.Были приобретены следующие Ат: поликлональные антисыворотки к человеческому IFN-γ и IFNGR1 (PBL Biomedical) и поликлональные Ат к человеческому IFNGR2 и STAT1α (Santa Cruz Biotechnology). Ab к ацетилгистону от Active Motif. Цитоплазматические и ядерные фракции получали, как описано ранее (12).
Ядерная транслокация IFN-γ (95–134), слитого с GFP
Плазмида, содержащая полную кодирующую последовательность человеческого IFN-γ, была приобретена в АТСС. Последовательность аминокислот 95–134 амплифицировали с помощью ПЦР и сливали в рамке считывания с С-концом гуманизированного rGFP в плазмиде phrGFPII-C (Stratagene).NLS-мутант пептида IFN-γ (95–134), в котором 128 KTGKRKR был мутирован в 128 ATGAAAA, был описан ранее (4). Продукт ПЦР, соответствующий IFN-γ (95–134) из мутантной последовательности NLS, был аналогичным образом слит с С-концом phrGFP. Клетки WISH, которые выращивали на покровных стеклах до почти 30% конфлюэнтности в чашке диаметром 35 мм, трансфицировали с использованием липофектамина (Invitrogen Life Technologies) с 3 мкг каждого из одного только phrGFP, IFN-γ (95–134), слитого с GFP, или NLS-мутированная последовательность, слитая с GFP.На следующий день клетки фиксировали 2% параформальдегидом в PBS, помещали на предметное стекло и просматривали в микроскопе Zeiss Axiovert Zoom с использованием программного обеспечения LSM5 Pascal.
Анализ иммунопреципитации хроматина (ChIP)
клеток WISH, засеянных накануне и выросших до 90% конфлюэнтности, обрабатывали человеческим IFN-γ (1000 Ед / мл) в течение 1 часа. Клетки промывали холодным PBS и обрабатывали 1% формальдегидом в течение 5 мин при 37 ° C. Остальная часть процедуры была проведена с использованием набора ChIP от Upstate Biotechnology в соответствии с протоколом производителя.Обработка ультразвуком проводилась для получения фрагментов ДНК размером ~ 500 п.н. Контрольный IgG или различные антитела, как указано, использовали для каждой иммунопреципитации. Элюированные фрагменты ДНК использовали для ПЦР со следующими праймерами, которые охватывали элемент GAS в их промоторах. Промоторная область человеческого IFN-регуляторного фактора-1 (IRF-1) была амплифицирована с праймерами 5′-CTTCGCCGCTAGCTCTAC-3 ‘(от -388 до -371) и 5′-GCCGCGCGGGCGCCCATT-3′ (от -283 до -312), в то время как человеческий IFN-γ-индуцибельный промотор индоламин-2,3-диоксигеназы амплифицировали с праймерами TAACACAGGTTGTGTTTCCG (от -497 до -476) и AAGGCTGCAGTCCTAAACTC (от -378 до -399).В качестве контроля проводили ПЦР с праймерами из промотора человеческого β-актина 5’-TGCACTGTGCGGCGAAGC-3 ‘(от -980 до -963) и 5′-TCGAGCCATAAAAGGCAA-3’ (от -915 до -932). Условиями ПЦР были: 94 ° C в течение 5 минут, затем 20 циклов при 94 ° C в течение 30 секунд, 52 ° C в течение 30 секунд и 72 ° C в течение 30 секунд. Затем последовал отжиг при 72 ° C в течение 7 мин.
После ChIP с разными указанными Abs комплекс ДНК с белками использовали для элюирования связанных белков путем кипячения с буфером для электрофореза и анализировали вестерн-блоттингом, как указано ниже.
Анализ белков, связанных с ДНК биотинилированного промотора GAS
Для идентификации белков, связанных с промотором GAS, была выбрана нуклеотидная последовательность из промотора IRF-1 человека, которая содержит мотив GAS 5′-AGCCTGATTTCCCCGAAATGACGGC-3 ‘. Были синтезированы олигонуклеотид, содержащий три копии этой последовательности, и другой олигонуклеотид с комплементарной последовательностью. Две нити биотинилировали индивидуально реагентами от Pierce с последующим отжигом.Ядерные экстракты получали из клеток WISH, которые обрабатывали IFN-γ человека (1000 Ед / мл) в течение различного указанного времени. Всего 150 мкг этого ядерного экстракта инкубировали в течение 15 мин на льду в 200 мкл реакционной смеси, содержащей 10 мМ HEPES (pH 7,9), 20 мМ KCl, 0,5 мМ EDTA, 0,5 мМ DTT, 10% глицерин, 5 мкг поли (dI: dC) и смесь ингибиторов протеаз (Roche Biochemicals). К этой смеси добавляли 50 нг биотинилированных двухцепочечных олигонуклеотидов и проводили инкубацию при комнатной температуре в течение 15 минут.Магнитные гранулы стрептавидина (Magnsephere Paramagnagnet; частицы; Promega) трижды промывали промывочным буфером, содержащим 10 мМ HEPES (pH 7,9), 100 мМ KCl, 1 мМ EDTA, 0,5 мМ DTT, 12% глицерина, 0,05% Nonidet P-40, 100 мг / мл BSA и смесь ингибиторов протеаз (Roche Biochemicals). К шарикам добавляли инкубационную смесь, указанную выше, и инкубацию продолжали в течение 30 мин на льду. Затем шарики трижды промывали промывочным буфером, содержащим 30 мкг / мл поли (dI: dC). Связанные белки элюировали 0.5% SDS и 1 M NaCl, электрофорез и анализ вестерн-блоттингом.
EMSA
Ядерные экстракты получали из клеток WISH, обработанных IFN-γ человека (1000 Ед / мл) в течение 1 часа. Всего 5 мкг ядерного экстракта инкубировали с 5 нг биотинилированного двухцепочечного олигонуклеотида, как указано выше, в 20 мкл реакционной смеси, содержащей 10 мМ Трис (pH 7,5), 50 мМ KCl, 5 мМ MgCl 2 , 1 мМ DTT, 2,5% глицерина, 0,05% Nonidet P-40 и 50 мкг / мл поли (dI: dC) в течение 20 мин при комнатной температуре.В конкурентных экспериментах ядерные экстракты предварительно инкубировали с 200-кратным избытком холодного олигонуклеотида перед добавлением биотинилированного зонда. Чтобы проверить участие IFN-γ или IFNGR1, 1 мкг Ab добавляли к ядерным экстрактам в реакционной смеси на льду в течение 15 минут перед добавлением биотинилированной ДНК. Реакцию останавливали добавлением 2 мкл 10-кратного буфера для загрузки геля (250 мМ Трис-HCl (pH 7,5), 0,2% бромфенолового синего и 40% глицерина). Смесь прогоняли на неденатурирующем 6% акриламидном геле.ДНК переносили на мембрану с последующим детектированием с использованием конъюгата стрептавидин-HRP и хемилюминесцентного субстрата от Pierce.
Вестерн-блоттинг и иммунопреципитация
Клетки промывали PBS и собирали в буфере для лизиса (50 мМ Трис-HCl (pH 7,5), 250 мМ NaCl, 0,1% Nonidet P-40, 50 мМ NaF, 5 мМ EDTA и смесь ингибиторов протеаз) (Roche Biochemicals) . Концентрацию белка измеряли с использованием набора бицинхониновой кислоты от Pierce.Белок (10 мкг каждого) подвергали электрофорезу на акриламидном геле, переносили на нейлоновую мембрану и исследовали указанными Ат. Использовали вторичные антитела, конъюгированные с HRP, и детектирование проводили с помощью хемилюминесценции (Pierce). Иммунопреципитацию проводили путем инкубации специфических антител с клеточными экстрактами с последующей инкубацией с IgG-сефарозой (Sigma-Aldrich), осаждением и промывками.
Конструкции и анализы репортерного гена
Промотор плазмиды pGL3, который экспрессирует люциферазу светлячка, был получен от Promega.Последовательность, содержащая три копии промоторного элемента GAS из гена IRF-1 человека, 5′-AGCCTGATTTCCCCGAAATGACGGC-3 ‘, была вставлена в сайт множественного клонирования pGL3. Клонирование несекретированного IFN-γ и его мутанта NLS в эукариотическом векторе экспрессии pShuttleCMV было описано ранее (4). Клон, содержащий кодирующую последовательность IFNGR1 человека, был приобретен в АТСС. Этот клон использовали для амплификации всей кодирующей последовательности или цитоплазматического домена (а.о. 250–472) IFNGR1. Полученный фрагмент клонировали в плазмиде pShuttleCMV с целью экспрессии.Конститутивно экспрессируемый управляемый промотором тимидинкиназы ген люциферазы Renilla (pRL-TK) от Promega использовали в качестве внутреннего контроля во всех трансфекциях репортерной плазмиды. Клетки WISH или NIH 3T3 (10 5 клеток / лунку) высевали в 12-луночный планшет. На следующий день по 3 мкг каждой плазмиды, экспрессирующей люциферазу светлячка, и любой котрансфицированной ДНК и 10 нг pRL-TK использовали для трансфекции с использованием Fugene 6 (Roche). Два дня спустя лизаты клеток использовали для анализа люциферазы светлячков, а затем люциферазы Renilla , используя набор для двойного анализа люциферазы от Promega, в соответствии с инструкциями производителя.Активность люциферазы в относительных единицах люциферазы рассчитывали путем деления активности люциферазы светлячка на активность люциферазы Renilla в каждом образце. Планки погрешностей представляют SD.
Слияние полноразмерного или цитоплазматического домена IFNGR1 и дрожжевого ДНК-связывающего домена GAL4 проводили следующим образом. Плазмида pFA-CMV, которая содержит дрожжевой ДНК-связывающий домен GAL4, управляемый промотором CMV, была получена от Stratagene. Продукт ПЦР полноразмерного или цитоплазматического домена IFNGR1 был слит в рамке считывания с С-концом ДНК-связывающего домена GAL4.Плазмида pFR-люцифераза (Stratagene), которая содержит ответный элемент GAL4, слитый с люциферазой светлячка, была использована для котрансфекции клеток NIH 3T3 с использованием Fugene 6. Одновременно использовали конститутивно экспрессируемую генную конструкцию люциферазы Renilla и определяли относительные единицы люциферазы. как описано выше.
Результаты
Необходимость NLS на С-конце IFN-γ для ядерной транслокации IFN-γ
Мы показали с помощью ядерного анализа дигитонина, что IFN-γ обладает классическим поликатионным NLS (3).Напротив, все сообщения о том, что STAT1α обладает нетрадиционным NLS, использовали подход сверхэкспрессии STAT1α, слитого с GFP (13). Поэтому мы сначала определили свойства ядерной локализации IFN-γ поликатионного NLS-содержащего пептида, слитого экспрессионного белка IFN-γ (95–134) -GFP. Клетки WISH трансфицировали вектором, экспрессирующим только GFP, GFP, слитый с IFN-γ (95–134), или GFP, слитый с NLS-мутантом IFN-γ (95–134). Как показано на рис. 1, только GFP равномерно распределяется по клеткам WISH, тогда как IFN-γ (95–134) -GFP накапливается в ядре клеток.Несколько полей были проанализированы для измерения флуоресценции в ядре по сравнению с флуоресценцией в цитозоле, и наблюдалось значительное накопление IFN-γ (95–134) -GFP в ядре (данные не показаны). Мутации лизинов и аргининов в аланины в последовательности IFN-γ (95–134) NLS, 128 KTGRKRKR, приводили к потере способности GFP накапливаться в ядре. Таким образом, классическая последовательность NLS IFN-γ является функциональной как в системе сверхэкспрессии, так и в процедуре ядерного анализа дигитонина.
ФИГУРА 1.Ядерная транслокация IFN-γ (95–134). Клетки WISH трансфицировали вектором, экспрессирующим GFP (, левая панель, ), IFN-γ (95–134), слитым с вектором, экспрессирующим GFP (, средняя панель, ), или NLS-мутантом IFN-γ (95–134). слит с вектором, экспрессирующим GFP ( правая панель ). На следующий день клетки фиксировали и просматривали в конфокальном микроскопе. Показанные ячейки представляют несколько полей, в каждом из которых содержится не менее 20 ячеек.
IFN-γ и IFNGR1 рекрутируются в элемент GAS в промоторе, индуцированном IFN-γ
Для идентификации мишени IFN-γ и IFNGR1, которые транслоцируются в ядро, клетки WISH, обработанные IFN-γ в течение 1 часа, анализировали с помощью ChIP обработанного ультразвуком хроматина, содержащего фрагменты ДНК размером ~ 500 п.н., с последующей ПЦР ( Рис. 2⇓). Были выбраны два из генов, индуцируемых IFN-γ, а именно IRF-1 и индоламиндиоксигеназа (IDO), которые содержат GAS в своих промоторах.Продукт ПЦР, выбранный для амплификации, простирается от нуклеотидов -388 до -283 в промоторе гена IRF-1 и от -497 до -378 в промоторе гена IDO. В качестве контроля продукт ПЦР, выбранный для промотора гена β-актина, простирается от нуклеотидов -980 до -915. Иммунопреципитация обработанного ультразвуком хроматина с Abs к IFN-γ, IFNGR1 или STAT1α с последующей ПЦР с праймерами, фланкирующими элемент GAS от промотора IRF-1 или IDO, приводила к продуктам ПЦР ожидаемой длины. Это предполагает ассоциацию IFN-γ, IFNGR1 и STAT1α с одними и теми же последовательностями ДНК, содержащими элемент GAS.Сходные результаты были получены при проведении иммунопреципитации с антителами, индуцированными против различных эпитопов IFN-γ и IFNGR1 (данные не показаны). Это еще одно свидетельство того, что Ат осаждали одни и те же фрагменты ДНК. Нормальный IgG, использованный в качестве контроля, не давал продуктов ПЦР, наблюдаемых с Abs, специфичными для IFN-γ, IFNGR1 или STAT1α. В качестве положительного контроля использовали Ab к ацетилгистону h4 для глобальной иммунопреципитации транскрипционно активного хроматина. Он давал продукт, аналогичный продукту входящего актина с помощью ПЦР-анализа, что дополнительно указывает на то, что иммунопреципитация затрагивает сайт активной транскрипции.Иммунопреципитация с использованием IFNGR2 Ab не привела к образованию какого-либо продукта ПЦР, что согласуется с нашими предыдущими наблюдениями о том, что IFNGR2 не подвергается эндоцитозу и ядерному транспорту в клетках, обработанных IFN-γ (4). Праймеры к β-актину генерировали продукт ПЦР только во входной ДНК, взятой перед иммунопреципитацией, а также во фрагментах ДНК из иммунопреципитата ацетилгистона h4, что дает дополнительные доказательства специфичности IFN-γ, связанной с праймерами IRF-1 и IDO. Таким образом, ПЦР иммунопреципитатов хроматина IFN-γ, IFNGR1 и STAT1α позволяет предположить, что все эти факторы связываются с элементом GAS в промоторной области генов IRF-1 и IDO.
ФИГУРА 2.IFN-γ и IFNGR1 рекрутируются в элемент GAS в промоторах IRF-1 и IDO. Использовали клетки WISH, обработанные IFN-γ (1000 Ед / мл) в течение 1 ч. Хроматин из поперечно сшитых клеток обрабатывали ультразвуком и инкубировали в течение ночи с указанными специфическими антителами с последующей инкубацией с протеином G-сефарозой, насыщенным ДНК спермы лосося. Обнаружение иммунопреципитированного промотора IRF-1 ( первый ряд ), промотора IDO ( второй ряд ) и промотора β-актина ( третий ряд ) проводили с помощью ПЦР с промотор-специфическими праймерами.Продукты ПЦР обрабатывали на 2,2% агарозном геле и окрашивали бромидом этидия.
Эндоцитоз IFN-γ приводит к его ассоциации с цитоплазматическим доменом рецепторной цепи IFNGR1 вместе с активированным STAT1α. Комплекс IFN-γ / IFNGR1 / STAT1α, в свою очередь, связывается с импортином α через NLS IFN-γ. Этот комплекс, в свою очередь, связывается с импортином β и подвергается активному транспорту в ядро через комплекс ядерных пор (4). Приведенные выше данные ПЦР иммунопреципитатов со специфическими Ат позволяют предположить, что IFN-γ, IFNGR1 и STAT1α все связаны с промоторной областью GAS IFN-γ-индуцибельных генов.Таким образом, затем эксперименты были направлены на демонстрацию белков IFN-γ, IFNGR1 и STAT1α на одном и том же иммунопреципитированном хроматине. Как показано на фиг. 3⇓, иммунопреципитация с использованием антител к IFNGR1 или STAT1α показала присутствие STAT1α, IFNGR1 и IFN-γ на одних и тех же комплексах ДНК / белок с помощью Вестерн-анализа. Нормальный IgG, используемый в качестве контроля, не обнаруживал эти белки, связанные с ДНК. Таким образом, в соответствии с профилем ChIP PCR, белки STAT1α, IFNGR1 и IFN-γ связаны с одной и той же промоторной областью активированных IFN-γ генов в ядре.
РИСУНОК 3.Ассоциация IFN-γ и IFNGR1 с элементом GAS в хроматине. Использовали клетки WISH, обработанные IFN-γ в течение 60 мин. Хроматин из поперечно сшитых клеток обрабатывали ультразвуком и инкубировали в течение ночи с контрольным IgG ( дорожка 1), Abs к IFNGR1 ( дорожка 2 ) или Abs к STAT1α ( дорожка 3 ) с последующей инкубацией с белком. G-Сефароза насыщена ДНК спермы лосося. Белки, элюированные из этих иммунопреципитированных комплексов, анализировали с помощью Вестерн-блоттинга с использованием Ab для STAT1α ( верхний ряд ), IFNGR1 ( средний ряд ) или IFN-γ ( нижний ряд ).Соответствующее количество экстрактов целых клеток без какой-либо иммунопреципитации загружали в полосу , 4, .
Для дополнительной проверки того, что IFN-γ и IFNGR1 связываются с промоторным элементом GAS вместе с IFN-γ, был создан биотинилированный промотор GAS, который инкубировали с ядерными экстрактами из клеток WISH, обработанных IFN-γ (фиг. 4). Экстракты из клеток, обработанных IFN-γ в течение 0, 30 или 60 минут, инкубировали с промотором GAS в течение 15 минут, после чего промотор GAS инкубировали со стрептавидином, связанным с магнитными частицами.Связанные белки элюировали, подвергали электрофорезу и зондировали с помощью Abs на STAT1α, IFNGR1 и IFN-γ. Все три белка связаны с промотором GAS через 30 мин, что, вероятно, отражает обратимую диссоциацию от промотора GAS в ядерных экстрактах. Стоит отметить, что размер ядерного IFNGR1, связанного с элементом GAS, такой же, как и в экстракте цельной клетки, предполагая, что полноразмерный IFNGR1 связан с этим промотором. Интересно, что IFNGR2 не был связан с промоторным комплексом, но был обнаружен во всем экстракте клетки, что согласуется с отсутствием эндоцитоза и ядерной транслокации (4).Таким образом, IFNGR1 и IFN-γ, аналогично STAT1α, связываются с промотором GAS в клетках, обработанных IFN-γ.
РИСУНОК 4.IFN-γ и IFNGR1 связаны с промотором GAS. Биотинилированный двухцепочечный олигомер, содержащий три копии промоторного элемента GAS, инкубировали с ядерными экстрактами из клеток WISH, необработанными ( дорожка 1, ) или обработанными IFN-γ в течение 30 минут ( дорожка 2 ) или 60 минут ( дорожка). 3 ). Этот комплекс добавляли к магнитным частицам, связанным со стрептавидином.Связанные белки элюировали, подвергали электрофорезу и зондировали последовательно с помощью Abs на STAT1α ( первый ряд ), IFNGR1 ( второй ряд ; весь гель включен, чтобы показать отсутствие протеолиза этого рецептора), IFNGR2 ( третий ряд ), или IFN-γ (, четвертый ряд, ). Дорожка 4 показывает белки из экстракта цельных клеток в качестве контроля.
Сборка различных белков на промоторе GAS также была проанализирована с помощью EMSA. Инкубация биотинилированного зонда GAS с ядерными экстрактами из клеток, обработанных IFN-γ, привела к образованию белкового комплекса ДНК, который оказался специфичным для этого элемента ДНК (рис.5⇓). Инкубация ядерных экстрактов с Ab к IFN-γ, IFNGR1 или STAT1α приводила к сдвигу комплекса с зондом GAS, что свидетельствует об ассоциации этих белков в этом комплексе. Добавление нормального IgG или Ab к IFNGR2 не влияло на образование этого комплекса. Отсутствие IFNGR2 в комплексе согласуется с предыдущими наблюдениями. Немеченый GAS конкурировал с биотинилированным GAS-зондом в связывании с комплексом, в то время как неродственная последовательность ДНК от промотора Oct-1 не конкурировала с образованием этого комплекса, что указывает на то, что он специфичен для элемента ДНК GAS.Однако мы не можем исключить возможность того, что несколько полос могут возникать из этого комплекса из-за возможного изменения стехиометрии взаимодействий, которые могут отражаться в виде агрегатов на вершине геля EMSA.
РИСУНОК 5.Ядерный IFN-γ и IFNGR1 связаны с элементом GAS в промоторе. Зонд, содержащий биотинилированный элемент GAS, инкубировали с ядерными экстрактами из клеток WISH, обработанных IFN-γ ( дорожек 2–9 ). Lane 1 , показывает инкубацию в тех же условиях без клеточного экстракта.Перед добавлением были добавлены Abs к IFNGR1 ( дорожка 3 ), IFN-γ ( дорожка 4 ), STAT1α ( дорожка 5 ), IFNGR2 ( дорожка 6 ) или нормальный IgG ( дорожка 7 ). маркированного зонда. Показано добавление неспецифического праймера Oct-1 ( дорожка 8, ) и избытка холодного праймера ( дорожка 9, ). Белковый комплекс ДНК наносили на 6% акриламидный гель, переносили на нейлоновую мембрану и детектировали хемилюминесценцией путем добавления субстрата стрептавидин-HRP.ГАЗ-специфический комплекс и несвязанный ГАЗ-зонд показаны стрелками.
A
trans домен активации в IFNGR1Чтобы проверить, может ли ассоциация IFNGR1 с промотором GAS влиять на транскрипционную активность этого промотора, использовали промоторный элемент GAS, слитый с репортерным геном люциферазы (рис. 6⇓). Котрансфекция этой репортерной плазмиды в клетках WISH с несекретированным IFN-γ привела к повышенной транскрипционной активности, которая не наблюдалась с плазмидой контрольного вектора без последовательности IFN-γ или мутантом NLS IFN-γ, в котором положительно заряженная кислоты 128 КТГКРКР заменены на аланины (4).Котрансфекция репортерной плазмиды с плазмидой, экспрессирующей полноразмерный IFNGR1 и несекретированный IFN-γ или цитоплазматический домен IFNGR1 и несекретированный IFN-γ, приводила к почти 2-кратному увеличению активности промотора GAS по сравнению с активностью, наблюдаемой с IFN-γ. только γ. Эта активность зависела от присутствия NLS в несекретированном IFN-γ, поскольку трансфекция NLS-мутантом IFN-γ приводила к отмене повышенной транскрипции, наблюдаемой с полноразмерным или цитоплазматическим доменом IFNGR1.Таким образом, IFN-γ и IFNGR1, которые, как было установлено, связываются с элементом GAS, способны усиливать транскрипцию при связывании с этой последовательностью.
РИСУНОК 6.IFNGR1 может стимулировать транскрипцию на промоторе GAS. Клетки WISH трансфицировали вектором без промоторного элемента ( дорожка 1) или плазмидой, содержащей элемент GAS, связанный с геном люциферазы на всех других дорожках. Конститутивно экспрессируемый вектор люциферазы Renilla был включен во все дорожки.Котрансфекцию проводили с пустым вектором экспрессии ( дорожка 2 ) или различными кодирующими последовательностями в векторе экспрессии, такими как несекретированный IFN-γ ( дорожка 3, ), несекретированный IFN-γ и цитоплазматический домен IFNGR1 ( дорожка 4 ), а также несекретированный IFN-γ и полноразмерный IFNGR1 ( дорожка 5, ). NLS-мутант IFN-γ, в котором аланины были заменены на лизины и аргинины в NLS, использовали с репортерной плазмидой в полосе , 6 , и с репортерной плазмидой и цитоплазматическим доменом IFNGR1 ( дорожка 7 ). и с репортерной плазмидой и полноразмерным IFNGR1 ( дорожка 8, ).Двумя днями позже измеряли относительную активность люциферазы. Сокращения: ICD, цитоплазматический домен IFNGR1; R1, полнометражный IFNGR1.
Повышенная транскрипционная активность, наблюдаемая с IFNGR1, была дополнительно подтверждена путем слияния полноразмерного или цитоплазматического домена IFNGR1 с дрожжевым ДНК-связывающим доменом GAL4 в плазмиде pFA-CMV (Stratagene). В качестве репортера использовалась репортерная плазмида pFR-люцифераза (Stratagene), содержащая ответный элемент GAL4, слитый с геном люциферазы (рис.7⇓). Трансфекцию проводили в клетки NIH 3T3 с использованием люциферазы Renilla в качестве внутреннего контроля. Плазмиды pFA-CMV и pFR-люцифераза, трансфицированные одновременно, показали транскрипционную активность, которая не наблюдалась ни для одной из этих плазмид, трансфицированных по отдельности. Интересно, что конструкции с полноразмерным или цитоплазматическим доменом IFNGR1, слитым с ДНК-связывающим доменом GAL4, показали более высокий транскрипционный ответ, чем наблюдаемый с одним только ДНК-связывающим доменом GAL4, что позволяет предположить наличие транс- активационного домена в IFNGR1.Поскольку IFNGR1 сам по себе не несет ДНК-связывающего домена, его ассоциация со STAT1α в элементе GAS может обеспечить эту функцию. Присутствие IFN-γ в том же самом транскрипционном комплексе может иметь дополнительную роль в создании ответа, уникального для этого цитокина.
РИСУНОК 7.Активационный домен транс в IFNGR1. Клетки NIH 3T3 использовали для трансфекции плазмиды pFA-CMV, содержащей только ДНК-связывающий домен дрожжей GAL4 ( дорожка 1), или репортерной плазмиды pFR-люциферазы, содержащей ответный элемент GAL4, связанный только с геном люциферазы светлячка ( дорожка 2 ).Репортерная плазмида была котрансфицирована pFA-CMV ( дорожка 3 ), цитоплазматическим доменом IFNGR1, слитым с ДНК-связывающим доменом GAL4 ( дорожка 4 ), или полноразмерным IFNGR1, слитым с ДНК-связывающим доменом GAL4 ( дорожка 5 ). . Относительная активность люциферазы определялась через 2 дня. Сокращения: FA, плазмида pFA-CMV; FR, плазмида FR-CMV; FA.ICD, цитоплазматический домен IFNGR1, слитый с ДНК-связывающим доменом GAL4; FA.R1, полноразмерный IFNGR1, слитый с ДНК-связывающим доменом GAL4.
Обсуждение
Семейство факторов транскрипции STAT состоит из семи членов, которые считаются медиаторами уникальных функций, связанных с более чем 50 различными системами лиганд / рецептор (14).Белки STAT обычно образуют гомодимеры в ответ на стимуляцию лигандом, и исследования структуры показали, что STAT связываются с элементами ответа генов в виде димеров (15). Заметными исключениями являются опосредование STAT1 / STAT2 активности IFN типа I (см. Ссылку 9), опосредование STAT1 / STAT3 активности IL-6 и опосредование STAT5α / STAT5β активности гормона роста. Преобладающая точка зрения в передаче сигналов STAT состоит в том, что лиганд активирует клетку исключительно через взаимодействия с внеклеточным доменом рецепторного комплекса (14).Это, в свою очередь, приводит к активации ассоциированных с рецептором киназ JAK (14), что приводит к фосфорилированию и димеризации факторов транскрипции STAT, которые затем диссоциируют от цитоплазматического домена рецептора и перемещаются в ядро. Учитывая ограниченное количество членов семейства STAT наряду с их предпочтением образовывать гомодимеры, трудно объяснить уникальную специфичность данной системы лиганд / рецептор, если активированный STAT рассматривается как единственный, кто отвечает за результирующую биологическую функцию.Для объяснения этого очевидного парадокса были выдвинуты различные сценарии. Например, специфичность передачи сигналов может быть частично объяснена природой или предшествующей фиксацией клетки-мишени. Фактически, есть только один тип ответа, который может вызвать клетка, независимо от того, сколько разных лигандов используют конкретный STAT в передаче сигналов клетки. Однако есть клетки, которые могут специфично отвечать на несколько цитокинов, использующих одну и ту же передачу сигналов STAT. Например, IFN-γ и IL-10 активируют STAT1 в моноцитах человека с образованием гомодимеров, но клеточный ответ на эти два белка различается (см.9). IFN-γ индуцирует антивирусное состояние и активирует молекулы MHC класса II на моноцитах, в то время как IL-10 этого не делает.
Также было предположено, что передача сигналов JAK / STAT является модульной и очень гибкой, со значительным перекрытием между разными путями ответа (16). Это предположение частично основано на наблюдении, что IL-6 может вызывать антивирусное состояние в клетках, лишенных гена STAT3. IL-6 активирует как STAT1, так и STAT3 в клетках, и, таким образом, его способность индуцировать антивирусное состояние в клетках дикого типа блокируется сопутствующей активацией STAT3 в соответствии с этой моделью.Модульная модель не объясняет открытия, что некоторые IFN типа I могут активировать STAT3 вместе со STAT1 и STAT2 и по-прежнему вызывать антивирусное состояние (16). Он также не принимает во внимание тот факт, что IFN обычно анализируют на присутствие других цитокинов, которые могут активировать STAT3 в клетках, включая IL-6.
Как указано выше, мы установили, что комплекс IFN-γ / IFNGR1 / STAT1α участвует в активном транспорте фосфо-STAT1α в ядро, в том числе совсем недавно с помощью системы анализа транспорта дигитонина in vitro (6).PhosphoSTAT1α не подвергался активному ядерному транспорту в отсутствие IFN-γ и IFNGR1. Напротив, сообщения о том, что STAT1α обладает внутренним нетрадиционным NLS, все использовали сверхэкспрессию STAT1α, слитого с GFP (13). Нетрадиционный внутренний NLS не был продемонстрирован для STAT1α с помощью метода ядерного анализа дигитонина. Данные, представленные в этом исследовании, касаются природы постъядерных транспортных событий. ChIP ядерных экстрактов с Abs к IFN-γ, IFNGR1 и STAT1α из клеток WISH, обработанных IFN-γ, с последующей ПЦР, показал, что все белки были связаны с последовательностью ДНК, содержащей элемент IFNGγ GAS.ChIP с Abs к IFNGR1 и STAT1α также показал белки STAT1α, IFNGR1 и IFN-γ, связанные с одной и той же последовательностью ДНК, с помощью вестерн-блоттинга. IFN-γ, IFNGR1 и STAT1α из ядерных экстрактов клеток, обработанных IFN-γ, также связывались с биотинилированной нуклеотидной последовательностью GAS. IFNGR2, который не подвергался эндоцитозу, не присутствовал ни в одном анализе ChIP. Как и ожидалось, обработка IFN-γ клеток WISH, трансфицированных репортерным геном GAS-люциферазы, приводила к активации гена. Сверхэкспрессия цитоплазматического домена IFNGR1 приводила к усилению активности репортерного гена, предполагая, что IFNGR1 обладает активностью фактора транскрипции.
Результаты, представленные в этом исследовании, аналогичны тем, о которых сообщается в отношении активности транскрипции рецептора эпидермального фактора роста (EGF) (EGFR) (17). Было показано, что EGFR и его лиганд EGF передаются в ядро. Это привело к идентификации функции изоформы EGFR ErB-1 в ядре, в которой было показано, что EGFR связывается с промотором циклина D последовательностным образом и модулирует транскрипцию гена циклина D1 (17, 18). . Хотя EGFR обладает активационной функцией trans , он лишен ДНК-связывающего домена и, следовательно, скорее всего, требует ДНК-связывающего фактора котранскрипции.Было показано, что аналогично взаимодействию IFNGR1 со STAT1α, EGFR физически взаимодействует со STAT3 в ядре, что приводит к активации транскрипции индуцибельной NO-синтетазы (18).
Аналогичным образом было показано, что гормон пролактин перемещается в ядро обработанных клеток через шаперон циклофилина B (19). Интересно, что пролактин активировал STAT5, образовывал с ним комплекс в ядре и увеличивал экспрессию STAT5α-опосредованного гена. Таким образом, пролактин, по-видимому, действует как индуктор транскрипционной активности STAT5α.То, что STAT сами по себе не являются решающими детерминантами транскрипционного ответа, также подтверждается недавним наблюдением, что STAT3 может действовать как активатор транскрипции или репрессор промотора cdc25A, в зависимости от того, был ли он связан при этом с myc или белком ретинобластомы. промотор (20).
Ранее мы показали, что взаимодействие IFN-γ с его рецептором приводит к образованию комплекса STAT1α / IFNGR1 / IFN-γ как в цитоплазме, так и в ядре (6, 7).В частности, аналогичные комплексы были обнаружены в обоих компартментах с использованием иммунопреципитации с использованием Ат к белкам комплекса. Таким образом, IFNGR1 и IFN-γ содержатся в комплексах со STAT1α в ядре. Данные, представленные в этом исследовании, показывают, что все эти белки связаны с элементом GAS генов, активируемых IFN-γ, но возможно, что IFNGR1 и IFN-γ также могут взаимодействовать с элементом GAS самостоятельно, независимо от STAT1α. Дальнейшие исследования будут сосредоточены на роли комплекса STAT1α / IFNGR1 / IFN-γ в связывании IFNGR1 и IFN-γ с элементом GAS.
Прямая транскрипционная / котранскрипционная активность систем лиганд / рецептор, таких как IFN-γ, EGF и пролактин, имеет важное значение для специфичности биологических активностей этих факторов, а также множества других факторов, которые передают сигнал через путь JAK / STAT ( 21). Во всех исследованных системах, использующих передачу сигналов STAT, лиганд и / или рецептор содержат обычный поликатионный NLS в своей последовательности, и было показано, что лиганд и / или рецептор передаются в ядро в каждом случае, который был исследован (21).Это предполагает, что сохранение последовательности NLS в белковых системах, которые активируют транскрипционные факторы STAT, имеет важное значение для определения специфичности активации генов этими факторами.
Благодарности
Благодарим Донну Вильямс за помощь в конфокальной микроскопии.
Раскрытие информации
У авторов отсутствует финансовый конфликт интересов.
Сноски
Расходы на публикацию этой статьи были частично покрыты за счет оплаты страницы.Таким образом, данная статья должна быть помечена как реклама в соответствии с 18 U.S.C. Раздел 1734 исключительно для указания этого факта.
№1 Эта работа была поддержана грантом AI 56152 Национального института здравоохранения и грантом W911NF-05-1-0170 Министерства обороны США (HMJ).
№2 Направляйте запросы на переписку и перепечатку доктору Чулбулу М. И. Ахмеду, факультет микробиологии и клеточных исследований, Университет Флориды, П.О. Box 110700, Building 981, Room 1052, Gainesville, FL 32611-0700. Электронный адрес: ahmed1 {at} ufl.edu
↵3 В статье использованы сокращения: NLS — последовательность ядерной локализации; ChIP, иммунопреципитация хроматина; EGF, фактор роста эпидермиса; EGFR, рецептор EGF; ГАЗ, IFN-γ-активированная последовательность; IDO, индоламиндиоксигеназа; IRF, регуляторный фактор IFN.
- Поступила 7 декабря 2005 г.
- Принята 7 апреля 2006 г.
- Авторские права © 2006 Американской ассоциации иммунологов
Ссылки
- ↵
Макдональд, Х.С., В.М. Кушнарев, Дж. Дж. Седмак, С. Э. Гроссберг. 1986. Транспорт γ-интерферона в ядро клетки может опосредоваться рецепторами ядерной мембраны. Biochem. Биофиз. Res. Commun. 138: 254-260.
- ↵
Bader, T., J. Weitzerbin. 1994. Ядерное накопление интерферона γ.Proc. Natl. Акад. Sci. USA 91: 11831-11835.
- ↵
Субраманиам, П. С., М. Г. Муджтаба, М. Р. Падди, Х. М. Джонсон. 1999. Карбокси-конец интерферона γ. J. Biol. Chem. 274: 403-407.
- ↵
Ахмед, К. М., М. А. Буркхарт, М. Г. Муджтаба, П. С. Субраманиам, Х. М. Джонсон. 2003. Роль последовательности ядерной локализации IFNγ во внутриклеточной функции. J. Cell Sci. 116: 3089-3098.
- ↵
Субраманиам, П. С., М. М. Грин, Дж. Ларкин, III, Б. А. Торрес, Х. М. Джонсон. 2001. Ядерная транслокация IFNγ является внутренним требованием для его биологической активности и может управляться гетерологичной последовательностью ядерной локализации. J. Interferon Cytokine Res. 21: 951-959.
- ↵
Субраманиам, П. С., Дж. Ларкин, М. Г. Муджтаба, М. Р. Уолтер, Х. М. Джонсон. 2000 г.Последовательность COOH-терминальной ядерной локализации интерферона γ регулирует ядерную транслокацию STAT1α во внутриклеточном сайте. J. Cell Sci. 113: 2771-2781.
- ↵
Ларкин, Дж., Х. М. Джонсон, П. С. Субраманиам. 2000. Дифференциальная ядерная локализация субъединиц IFNGR-1 и IFNGR-2 рецепторного комплекса IFNγ после активации IFNγ. J. Interferon Cytokine Res. 20: 565-576.
- ↵
Субраманиам, П.С., Х. М. Джонсон. 2002. Липидные микродомены являются необходимыми участками для селективного эндоцитоза и ядерной транслокации IFNγ, его рецепторной цепи IFNγ рецептора-1, а также фосфорилирования и ядерной транслокации STAT1α. J. Immunol. 169: 1959-1969.
- ↵
Субраманиам, П. С., Б. А. Торрес, Х. М. Джонсон. 2001. Так много лигандов, так мало факторов транскрипции: новая парадигма передачи сигналов через факторы транскрипции STAT. Цитокин 15: 175-187.
- ↵
Сенте, Б. Э., П. С. Субраманиам, Х. М. Джонсон. 1995. Идентификация сайта связывания рецептора IFNγ для JAK2 и усиление связывания IFNγ и его C-концевым пептидом IFNγ (95–133). J. Immunol. 155: 5617-5622.
- ↵
Сенте, Б. Э., Х. М. Джонсон. 1994. Связывание IFNγ и его C-концевого пептида с цитоплазматическим доменом его рецептора, который необходим для его функции.Biochem. Биофиз. Res. Commun. 201: 215-221.
- ↵
Осубель, Ф. М., Р. Брент, Р. Э. Кингстон, Д. Д. Мур, Дж. Г. Сейдман, Дж. А. Смит, К. Струл. 2002. Краткие протоколы молекулярной биологии Wiley, Нью-Йорк.
- ↵
Макбрайд, К. М., Дж. Баннингерт, К. Макдональд, Н. К. Райх. 2002. Регулируемый ядерный импорт фактора транскрипции STAT1 путем прямого связывания импортина α.EMBO J. 21: 1754-1763.
- ↵
Brivanlou, A.H., J. E. Darnell, Jr. 2002. Сигнальная трансдукция и контроль экспрессии генов. Наука 295: 813-818.
- ↵
Чен, Х., У. Винкемайер, Я. Чжао, Д. Джерузалми, Дж. Э. Дарнелл, Дж. Куриян. 1998. Кристаллическая структура димера STAT-1, фосфорилированного тирозином, связанного с ДНК. Ячейка 93: 827-839.
- ↵
Керр, И.М., Коста-Переирс А.П., Лиллемайер Б.Ф., Штробл Б. 2003. О JAK, STAT, слепых часовщиков, джипов и поездов. FEBS Lett. 546: 1-5.
- ↵
Lin, S. Y., K. Makino, W. Xia, A. Matin, Y. Wen, K. Y. Kwong, L. Bourguignon, M. C. Hung. 2001. Ядерная локализация рецептора EGF. Nat. Cell Biol. 3: 802-808.
- ↵
Ло, Х., С. Сюй, М. Али-Сейед, М. Гундуз, В. Ся, Ю.Wei, G. Bartholomeusz, J. Shih, M. C. Hung. 2005. Ядерное взаимодействие EGFR и STAT3 в активации пути iNOS / NO. Cancer Cells 7: 575-588.
- ↵
Рыцызин М.А., Клевенджер К.В. 2002. Внутриклеточный комплекс пролактин / циклофилин B как индуктор транскрипции. Proc. Natl. Акад. Sci. США 99: 6790-6795.
- ↵
Барре, Б., А. Виньерон, О. Кокере. 2005. Фактор транскрипции STAT3 является мишенью для белков myc и ретинобластомы на промоторе cdc25A.J. Biol. Chem. 280: 15673-15681.
- ↵
Джонсон, Х. М., П. С. Субраманиам, С. Олснес, Д. А. Янс. 2004. Пути передачи и передачи сигналов ядерных локализующихся белковых лигандов и их рецепторов. BioEssays 26: 993-1004.
Клонирование стимулированного интерфероном гена 17: промотор и ядерные белки, регулирующие транскрипцию | Молекулярная эндокринология
Аннотация
Член семейства интерферон-стимулированных генов (ISG) кодирует 17-кДа гомолог убиквитина, называемый ISG17, который индуцируется в эндометрии матки крупного рогатого скота с помощью интерферона-τ (IFN-τ) на ранних сроках беременности.КДНК ISG17 крупного рогатого скота (b) имеет 30% идентичности с тандемным убиквитиновым повтором и 70% идентичности с ISG15 человека (h). Настоящие эксперименты были разработаны для секвенирования гена bISG17, сравнения общей структуры с геном hISG15 и для идентификации факторов транскрипции, которые были индуцированы IFN-τ в клетках эндометрия крупного рогатого скота (BEND). Промотор гена bISG17 был подобен гену hISG15 в размещении тандемного IFN-стимулирующего ответного элемента (ISRE) в положении -90, но уникален в присутствии трех дополнительных ISRE в положениях -123, -332 и -525. .IFN-τ (25 нм) индуцировал ядерные белки в клетках BEND, которые взаимодействовали с тандемным ISRE bISG17 в анализе сдвига электрофоретической подвижности (EMSA). IFN-регуляторный фактор-1 (IRF-1), связанный с этим ISRE, основан на сверхсдвигающем EMSA с использованием антисыворотки против IRF-1. IFN-τ активировал STAT-1 (преобразователь сигнала и активатор транскрипции-1) и -2 через 0,5 ч, а IRF-1 через 2 ч в клетках BEND. Сделан вывод, что ген bISG17 подобен гену hISG15, сохраняет ISRE, который взаимодействует с IRF-1, и, возможно, сначала индуцируется STAT, а затем IRF-1 в ответ на IFN-τ на ранних сроках беременности.
Введение
На ранних сроках беременности необходимо избегать литического действия простагландина F 2 α (PGF) (1). В противном случае желтое тело регрессирует в ответ на снижение PGF и прогестерона, что приводит к ранней эмбриональной смертности. У жвачных животных беременность наступает благодаря действию интерферона-τ (IFN-τ) на эндометрий (1–3). IFN-τ высвобождается расширяющейся бластоцистой, связывается с рецептором эндометрия и изменяет характер секреции PGF маткой.Это приводит к спасению желтого тела и продолжению выработки прогестерона. Поскольку IFN-τ косвенно блокирует литическое действие PGF на желтое тело, его назвали «антилютеолизином». Антилютеолитический механизм действия IFN-τ (1, 2) включает ингибирование рецепторов эстрадиола, снижение рецептора окситоцина, активацию ингибитора циклооксигеназы и сдвиг PG в пользу PGE 2 , лютеотропина, по сравнению с PGF, лютеолизин.
Помимо регуляции высвобождения PGF, IFN-τ индуцирует несколько белков матки (2, 4, 5).Функция этих белков на ранних сроках беременности остается неуловимой, за исключением гомолога бычьего убиквитина массой 17 кДа. Этот белок первоначально назывался перекрестно-реактивным белком убиквитина, или UCRP, потому что он имел общие эпитопы с убиквитином и перекрестно реагировал с антисывороткой против убиквитина при вестерн-блоттинге (6).
Конъюгация убиквитина с белками осуществляется за счет изопептидной связи между карбоксилглицином убиквитина и первичными аминами на целевых белках (7, 8).Белки, конъюгированные с убиквитином, процессируются посредством АТФ-зависимого мультикаталитического пути 26 S протеасомы, в котором целевые белки расщепляются, а убиквитин рециклируется (9). Гипотеза о том, что бычий (b) UCRP конъюгирован с белками эндометрия, была недавно проверена (10). Было продемонстрировано, что конъюгация UCRP отличается от конъюгации убиквитина с белками эндометрия (10). Кроме того, конъюгация bUCRP с белками эндометрия была вызвана беременностью и IFN-τ, тогда как конъюгация убиквитина с белками эндометрия — нет.
Клонирование кДНК bUCRP и анализ предполагаемой аминокислотной последовательности выявили 70% идентичности с человеческим членом семейства IFN-стимулированных генов (ISG), который кодирует белок массой 15 кДа (ISG15), и 30% идентичности с тандемом бычий убиквитиновый повтор (11). И IFN-α, и IFN-τ индуцировали мРНК и белок bUCRP в клетках эндометрия крупного рогатого скота (6, 12, 13). Поскольку ген bUCRP принадлежит к семейству ISG и кодирует белок массой 17 кДа, мы переименовали белок ISG17 в соответствии с номенклатурой, разработанной для человеческих ISG15 (14) и ISG54 (15).
IFN — это иммуномодулирующие белки, которые обладают различными клеточными эффектами в зависимости от происхождения клеток и стадии дифференцировки (16). IFNs связываются с трансмембранными рецепторами, активируют янус-киназу (Jak) или тирозинкиназу (Tyk) и стимулируют быструю активацию экспрессии генов (17). Сигнальные преобразователи и активаторы транскрипции (STAT) представляют собой цитоплазматические факторы транскрипции, которые фосфорилируются Jaks и взаимодействуют как гетеро- или гомодимеры, регулируя транскрипцию генов. Было высказано предположение, что STAT опосредуют ранние геномные ответы на IFN (17).IFN-регуляторный фактор-1 (IRF-1), фактор транскрипции, индуцируется STAT, фосфорилируется и может опосредовать дистальные ответы на IFN (18).
Ген bISG17 можно использовать для исследования передачи сигнала в эндометрии в ответ на IFN-τ (13). bISG17 значительно отличается по обработке и первичной структуре по сравнению с hISG15. Еще одно важное различие между hISG15 и bISG17 — очевидная широко распространенная экспрессия hISG15 в нескольких клеточных линиях и тканях (19). Нозерн-блоттинг показал, что экспрессия гена bISG17 ограничена эндометрием беременных коров или эндометрием небеременных коров, которых лечили in vitro рекомбинантным бычьим (rb) IFN-τ или rbIFN-α (12).Хотя роль hISG15 может быть общей для многих типов клеток, транскрипция гена bISG17, по-видимому, является специфическим ответом на IFN-τ в эндометрии матки на ранних сроках беременности у коровы (12). Таким образом, цели настоящих экспериментов состояли в том, чтобы выделить и секвенировать ген bISG17, сравнить структуру и организацию с геном hISG15 и определить, индуцируются ли факторы транскрипции STAT-1, STAT-2, IRF-1 и IRF-2 посредством IFN-τ и участвует в регуляции гена bISG17.
Результаты
Саузерн-блот-анализ
ДНК тимуса теленка расщепляли эндонуклеазами рестрикции и проводили блоттинг по Саузерну с использованием кДНК bISG17 (11) в качестве зонда.Расщепление геномной ДНК ферментами, которые не расщепляют кДНК, привело к образованию одной основной полосы гибридизации с другими второстепенными полосами гибридизации (рис. 1А). Основная гибридизирующая полоса в основном исчезла после переваривания геномной ДНК с Pst I, Sma I и Sac I, которые, как известно, расщепляют кДНК bISG17 (11). Поскольку после переваривания Sac I появились две более короткие полосы гибридизации, данные интерпретируются как означающие, что существует единственный главный ген, кодирующий bISG17.Фрагменты Sac I имели размер приблизительно 3,4 и 2,0 т.п.н. Даже в условиях нестрогой гибридизации (, т.е. , 37 ° C) зонд кДНК bISG17 не гибридизировался с геномной ДНК человека, которая была расщеплена и подвергнута Саузерн-блоттингу, как описано для геномной ДНК крупного рогатого скота (не показано).
Рис. 1.
Идентификация гена bISG17 в геномной ДНК крупного рогатого скота (A) и в очищенном фаге (B) с использованием саузерн-блоттинга и зонда кДНК bISG17 На панели A стрелки указывают продукты расщепления с использованием Sac I, который, как известно, расщепляет кДНК.На панели B полоса 1 представляет окрашивание бромистым этидием фага , расщепленного Sac I, который содержит ген bISG17. Дорожка 2 представляет собой Саузерн-блот фага , расщепленного Sac I, с использованием кДНК bISG17 в качестве зонда. Фрагменты гена bISG17, субклонированные в pBluescript SK, обозначены как pDP7 и pDP8.
Рис. 1.
Идентификация гена bISG17 в геномной ДНК крупного рогатого скота (A) и в очищенном фаге (B) с использованием саузерн-блоттинга и зонда кДНК bISG17 На панели A стрелки указывают продукты расщепления с использованием Sac I. , который, как известно, расщепляет кДНК.На панели B полоса 1 представляет окрашивание бромистым этидием фага , расщепленного Sac I, который содержит ген bISG17. Дорожка 2 представляет собой Саузерн-блот фага , расщепленного Sac I, с использованием кДНК bISG17 в качестве зонда. Фрагменты гена bISG17, субклонированные в pBluescript SK, обозначены как pDP7 и pDP8.
Выделение геномного клона bISG17
Отдельный фаг был выделен и очищен после скрининга 1 × 10 6 бляшек из геномной библиотеки крупного рогатого скота.Фаг, содержащий вставку размером 16 т.п.н., расщепляли с помощью Sac I и проводили блоттинг по Саузерну с использованием радиоактивно меченного зонда кДНК bISG17. Два фрагмента Sac I гибридизировались с зондом кДНК bISG17 (рис. 1В). Эти фрагменты имели длину 3,4 и 2 т.п.н. и идентичны по размеру с фрагментами, идентифицированными на геномных саузерн-блотах после переваривания Sac I. Фрагменты Sac I очищали в геле, субклонировали в pBluescript SK — и называли pDP7 (3,4 т.п.н. ) и pDP8 (2,0 кб).
Первоначальное секвенирование со стандартными праймерами показало, что промотор и большинство кодирующих последовательностей содержатся в pDP8.Следовательно, эту плазмиду использовали для создания вложенных делеций путем частичного переваривания экзонуклеазой III и полностью секвенировали. Все последовательности были подтверждены перекрывающимися клонами и, при необходимости, с использованием внутренних праймеров. 3′-конец кодирующей последовательности и нижележащие некодирующие последовательности секвенировали из плазмиды pDP7 с использованием стандартных праймеров.
Последовательность гена bISG17 и его промотора, включая 1180 п.н. перед сайтом старта транскрипции, показана на рис.2. Регистрационный номер GenBank — AF069133. Ген содержит предполагаемый элемент TATA-бокса (TATTAAA) в положении -29 относительно кэп-сайта мРНК и возможный перевернутый элемент CAAT-бокса в положении -130. За сайтом кэпа мРНК следуют 5′-некодирующие последовательности и инициирующий кодон. Сразу после инициирующего кодона находится интрон длиной 437 пар оснований, за которым следуют оставшиеся кодирующие последовательности и 3′-нетранслируемые последовательности, которые были идентичны таковым, описанным для кДНК bISG17 (11).
Рис.2.
Нуклеотидная последовательностьи выведенная аминокислотная последовательность гена bISG17 (A), сравнение с промотором hISG15 (B) и идентификация кэп-сайта мРНК (C). Фрагменты гена bISG17 (pDP7 и pDP8) были клонированы в pBluescript SK — и секвенированный. Кодирующие белки последовательности указаны в заглавными буквами . ISRE показаны полужирным шрифтом . Предполагаемый блок ТАТА, инвертированный элемент СААТ и сигнал полиаденилирования — подчеркнуты . Потенциальный мотив CREB — , выделенный жирным курсивом , а мотивы GAAANN — жирным шрифтом .Нумерация относится к сайту начала транскрипции РНК, указанному курсивом g в рамке . Панель B показывает гомологию нуклеотидных последовательностей между промоторами bISG17 и hISG15. Две нуклеотидные последовательности выровнены от -140 гена bISG17 до первых 17 нуклеотидов интрона. Идентичность нуклеотидов обозначена вертикальными линиями . Стрелки под последовательности ISG15 указывают вставки относительно последовательности ISG17. Тандемные ISRE и вышестоящие ISRE обозначены жирными подчеркнутыми символами .Предполагаемый элемент CREB выделен жирным шрифтом и курсивом . Сайт кэпа мРНК обозначен жирным курсивом g , а начало трансляции обозначено заглавными буквами . Панель C показывает анализ удлинения праймера кэп-сайта мРНК bISG17. Нуклеотидная последовательность гена bISG17 с использованием праймера показана с нуклеотидами, обозначенными как G, A, T и C. Показаны более длинный (L) и более короткий (S) способы гибридизации. РНК эндометрия небеременных (NP) или беременных (P) коров использовали в качестве матрицы.Нуклеотидная последовательность, кодирующая сайт кэпа, показана ниже геля. Возможные участки заглушки показаны более короткими стрелками . Сайт, обозначенный как положение +1 в последовательности, обозначен самой длинной стрелкой , потому что он всегда был самым темным сигналом с использованием L-метода и соответствовал одному из сайтов, идентифицированных с помощью S-метода.
Рис. 2.
Нуклеотидная и выведенная аминокислотная последовательность гена bISG17 (A), сравнение с промотором hISG15 (B) и идентификация участка кепки мРНК (C) Фрагменты гена bISG17 (pDP7 и pDP8) ) были клонированы в pBluescript SK — и секвенированы.Кодирующие белки последовательности указаны в заглавными буквами . ISRE показаны полужирным шрифтом . Предполагаемый блок ТАТА, инвертированный элемент СААТ и сигнал полиаденилирования — подчеркнуты . Потенциальный мотив CREB — , выделенный жирным курсивом , а мотивы GAAANN — жирным шрифтом . Нумерация относится к сайту начала транскрипции РНК, указанному курсивом g в рамке . Панель B показывает гомологию нуклеотидных последовательностей между промоторами bISG17 и hISG15.Две нуклеотидные последовательности выровнены от -140 гена bISG17 до первых 17 нуклеотидов интрона. Идентичность нуклеотидов обозначена вертикальными линиями . Стрелки под последовательности ISG15 указывают вставки относительно последовательности ISG17. Тандемные ISRE и вышестоящие ISRE обозначены жирными подчеркнутыми символами . Предполагаемый элемент CREB выделен жирным шрифтом и курсивом . Сайт кэпа мРНК обозначен жирным курсивом g , а начало трансляции обозначено заглавными буквами .Панель C показывает анализ удлинения праймера кэп-сайта мРНК bISG17. Нуклеотидная последовательность гена bISG17 с использованием праймера показана с нуклеотидами, обозначенными как G, A, T и C. Показаны более длинный (L) и более короткий (S) способы гибридизации. РНК эндометрия небеременных (NP) или беременных (P) коров использовали в качестве матрицы. Нуклеотидная последовательность, кодирующая сайт кэпа, показана ниже геля. Возможные участки заглушки показаны более короткими стрелками . Сайт, обозначенный как положение +1 в последовательности, обозначен самой длинной стрелкой , потому что он всегда был самым темным сигналом с использованием L-метода и соответствовал одному из сайтов, идентифицированных с помощью S-метода.
Промотор содержит пять предполагаемых IFN-стимулирующих ответных элементов (ISRE) в положениях от −525 до −513, от −332 до −320, от −123 до −111 и пару тандемных, перекрывающихся ISRE в положениях от −92 до −74. (Рис.2, А и Б). Мотив последовательности GAAANN, который обнаружен в промоторах генов IFN-α , и IFN-τ (20), обнаруживается не менее 17 раз в обеих ориентациях в области от -170 до -1060. , CREB-подобная последовательность находится в положениях от -48 до -41. Общая структура кодирующих областей аналогична генам bISG17 и hISG15 (14) с интроном сразу после кодона инициации.Кодирующие области имели 68% идентичность последовательностей, как сообщалось ранее (11). Оба гена сохраняли тандемный перекрывающийся ISRE примерно на 50 п.н. выше ТАТА-бокса (рис. 2В). Ген hISG15 был секвенирован в положение -125 (фиг. 2B), тогда как ген bISG17 был секвенирован в положение -1180 (фиг. 2A).
Определение сайта начала транскрипции
Сайт кэпа мРНК для гена bISG17 определяли с помощью анализа удлинения праймера общей РНК эндометрия, выделенной от коров на 18 день беременности (рис.2С). Суммарная РНК эндометрия коровы на 18 день эстрального цикла служила контролем. Был выбран олигонуклеотидный праймер для гибридизации с мРНК в положении, которое находилось на 15 п.н. выше кодона инициации ATG на основе последовательности кДНК bISG17 (11). Наращивание праймера было выполнено двумя способами. В условиях длительной гибридизации с высоким содержанием соли были получены два основных сайта старта транскрипции. Более короткие условия гибридизации с низким содержанием соли дали четыре основных стартовых сайта. Использование второго олигонуклеотидного праймера (GCCAGGCTCTCTGCAGACAC), заканчивающегося на 36 п.н. выше инициирующего кодона, подтвердило эти результаты (не показаны).Хотя эти результаты могут представлять несколько сайтов начала транскрипции, первый нуклеотид G в серии был обозначен как положение 1, потому что соответствующая полоса является самой темной в длинном эксперименте по гибридизации. Ни одним из методов не было обнаружено транскриптов в общей РНК из эндометрия, собранной на 18 день эстрального цикла.
Emsa
Тандемный ISRE в гене bISG17 практически идентичен тандемному ISRE гена hISG15 (14).Между двумя последовательностями различается только один нуклеотид: замена G на A в вариабельной части консенсусной последовательности hISRE (рис. 2B). Тандемный ISRE bISG17 был синтезирован, мечен радиоактивным изотопом и использован в качестве зонда в EMSA с использованием ядерных экстрактов из обработанных IFN клеток эндометрия крупного рогатого скота (BEND).
Радиоактивно меченый олигонуклеотид, инкубированный в отсутствие ядерных экстрактов, имел самую быструю электрофоретическую подвижность (фиг. 3A). Конститутивное взаимодействие ISRE с ядерными экстрактами было отмечено как в контрольных, так и в обработанных IFN клетках BEND.В течение 2-часового периода эта более быстро мигрирующая составляющая полоса активировалась после инкубации с IFN-α или IFN-τ. Ядерные экстракты из клеток, обработанных IFN-α или IFN-τ в течение 2 часов, также имели одну уникальную более медленную полосу миграции, которая не была обнаружена в контроле. На уровне чувствительности этого анализа не было различий в ядерных белках, которые были связаны с энхансером ISRE в ответ на два протестированных IFN.
Рис. 3.
EMSA ядерных экстрактов из контрольных и обработанных IFN клеток BEND (панель A) и конкуренция с немеченым ISRE (панель B). Ядерные экстракты выделяли из клеток BEND, обработанных 0 (C) или 25 нМ IFN- α (A) или IFN-τ (T), как указано.Пять микрограммов экстракта инкубировали с 20000 имп / мин меченого олигонуклеотида ISRE (GGGAAAAGGAAACCGAAACT), разделяли на неденатурирующем 6% акриламидном геле и подвергали авторадиографии. Жирная стрелка отмечает миграцию свободного олигонуклеотида. Более светлая стрелка указывает на смещенную полосу, появившуюся после обработки IFN. На панели B EMSA была завершена с использованием ядерных экстрактов, собранных после 1 или 2 ч культивирования с 25 нМ rbIFN-τ. Ядерные экстракты инкубировали с радиоактивно меченным ISRE в отсутствие или в присутствии 1-, 10- или 100-кратного молярного избытка немеченого ISRE.
Рис. 3.
EMSA ядерных экстрактов из контрольных и обработанных IFN клеток BEND (панель A) и конкуренция с немеченым ISRE (панель B) Ядерные экстракты были выделены из клеток BEND, обработанных 0 (C) или 25 нМ IFN. -α (A) или IFN-τ (T), как указано. Пять микрограммов экстракта инкубировали с 20000 имп / мин меченого олигонуклеотида ISRE (GGGAAAAGGAAACCGAAACT), разделяли на неденатурирующем 6% акриламидном геле и подвергали авторадиографии. Жирная стрелка отмечает миграцию свободного олигонуклеотида.Более светлая стрелка указывает на смещенную полосу, появившуюся после обработки IFN. На панели B EMSA была завершена с использованием ядерных экстрактов, собранных после 1 или 2 ч культивирования с 25 нМ rbIFN-τ. Ядерные экстракты инкубировали с радиоактивно меченным ISRE в отсутствие или в присутствии 1-, 10- или 100-кратного молярного избытка немеченого ISRE.
Взаимодействие радиоактивно меченного ISRE с ядерными экстрактами клеток BEND, индуцированное IFN-τ, было специфическим, как показано на фиг. 3B. Коинкубация с 10- и 100-кратным молярным избытком холодного ISRE эффективно блокировала связывание ядерных белков с радиоактивно меченным ISRE, о чем свидетельствует исчезновение как более быстро мигрирующей составляющей полосы, так и более медленной мигрирующей полосы, которая индуцировалась IFN.
Вестерн-блоттинг STAT и IRF-1
Ядерные экстракты собирали несколько раз после обработки клеток BEND 25 нм rbIFN-τ или rbIFN-α и вестерн-блоттинга с использованием антител против STAT-1, STAT-2 и IRF-1. В этих экспериментах предполагалось, что транслокация этих факторов транскрипции в ядро требует фосфорилирования и что обнаружение в ядре представляет активацию этих факторов транскрипции. Репрезентативные вестерн-блоты, показывающие обнаружение STAT-1, STAT-2 и IRF-1 в клетках BEND, можно найти на рис.4А. Количественное определение этих блотов выявило, что оба IFN активировали STAT-1 (фиг. 4B) и STAT-2 (фиг. 4C) в клетках BEND в течение 0,5 часа и IRF-1 в течение 2 часов (фиг. 4D). Для индукции IRF-1 требовалось более длительное время инкубации (2 часа) с IFN по сравнению с индукцией STAT. Более чем один ядерный белок иммунореагировал с антисывороткой против IRF-1.
Рис. 4.
Обнаружение STAT-1 (91 и 84 кДа), STAT-2 (113 кДа) и IRF-1 (37 кДа) в экстрактах ядер клеток BEND с использованием вестерн-блоттинга. соответствующий 37 кДа форме IRF-1 показан стрелкой .Клетки BEND инкубировали в течение 0, 0,5 или 2 ч в отсутствие (C) или в присутствии 25 нм rbIFN-α (A) или rbIFN-τ (T). Ядерные экстракты выделяли, разделяли (4 мкг) на SDS-полиакриламидных (7,5%) гелях, переносили на нитроцеллюлозу и детектировали с помощью антисывороток против STAT-1, STAT-2 или IRF-1. Вестерн-блоты количественно оценивали с помощью денситометрии. Оптическую плотность анализировали с помощью защищенного теста t . Панели B, C и D показывают количественное определение STAT-1, STAT-2 и IRF-1 соответственно. Все средства обработки представляют собой повторные или трехкратные определения.Средние, обозначенные звездочкой , отличаются от контрольных ( P <0,05).
Рис. 4.
Обнаружение STAT-1 (91 и 84 кДа), STAT-2 (113 кДа) и IRF-1 (37 кДа) в экстрактах ядер клеток BEND с использованием вестерн-блоттинга Иммунореагирование полоса, соответствующая 37 кДа форме IRF-1, показана стрелкой . Клетки BEND инкубировали в течение 0, 0,5 или 2 ч в отсутствие (C) или в присутствии 25 нм rbIFN-α (A) или rbIFN-τ (T). Ядерные экстракты выделяли, разделяли (4 мкг) на SDS-полиакриламиде (7.5%) гели, перенесенные на нитроцеллюлозу и обнаруженные с помощью антисывороток против STAT-1, STAT-2 или IRF-1. Вестерн-блоты количественно оценивали с помощью денситометрии. Оптическую плотность анализировали с помощью защищенного теста t . Панели B, C и D показывают количественное определение STAT-1, STAT-2 и IRF-1 соответственно. Все средства обработки представляют собой повторные или трехкратные определения. Средние, обозначенные звездочкой , отличаются от контрольных ( P <0,05).
Антитело против IRF-1 было предварительно адсорбировано пептидом IRF-1, чтобы определить, являются ли белки, иммунореагирующие с антителом против IRF-1, иммуноспецифичными (рис.5А). Предварительная абсорбция антитела против IRF-1 пептидом IRF-1 блокировала детекцию вестерн-блоттингом всех, кроме одной, иммунореагирующей полосы. Это интерпретируется как означающее, что все, кроме одной, иммунореагирующей полосы иммунореагируют специфически с антителом против IRF-1 и могут представлять изоформы IRF-1. Неспособность заблокировать детекцию одной полосы даже после предварительной адсорбции с использованием молярного избытка пептида 1:10 все еще интерпретируется как иммуноспецифическая реакция. Это связано с тем, что эта полоса не появляется, когда первичное антитело удаляется из реакции вестерн-блоттинга ( i.е. (контроль, чтобы определить, иммунореагирует ли вторичное антитело неспецифически).
Рис. 5.
Обнаружение IRF-1 является иммуноспецифическим (A), и для индукции IRF-1 требуется синтез белка (B) На панели A ядерные экстракты были собраны из клеток BEND через 2 часа культивирования с 25 нм rbIFN- τ. Белки загружали в одномерные гели PAGE и проводили вестерн-блоттинг, используя антисыворотку против IRF-1, которая была предварительно адсорбирована пептидом IRF-1 в молярных отношениях 1: 0, 1: 1 или 1:10.Показан контроль, в котором первичное антитело было удалено из реакции вестерн-блоттинга (-1 st ). На панели B ингибирование синтеза белка с использованием циклогексимида не влияло на индукцию STAT-1 и STAT-2, но подавляло индукцию IRF-1 с помощью rbIFN-τ. Ядерные экстракты собирали из клеток BEND, культивированных в отсутствие (C) или в присутствии (T) 25 нМ rbIFN-τ и в отсутствие (контроль) и в присутствии циклогексимида. STAT и IRF определяли с помощью вестерн-блоттинга, как описано на фиг.4.
Рис. 5.
Обнаружение IRF-1 является иммуноспецифическим (A), и для индукции IRF-1 требуется синтез белка (B) На панели A ядерные экстракты были собраны из клеток BEND через 2 часа культивирования с 25 нм rbIFN-τ. Белки загружали в одномерные гели PAGE и проводили вестерн-блоттинг, используя антисыворотку против IRF-1, которая была предварительно адсорбирована пептидом IRF-1 в молярных отношениях 1: 0, 1: 1 или 1:10. Показан контроль, в котором первичное антитело было удалено из реакции вестерн-блоттинга (-1 st ).На панели B ингибирование синтеза белка с использованием циклогексимида не влияло на индукцию STAT-1 и STAT-2, но подавляло индукцию IRF-1 с помощью rbIFN-τ. Ядерные экстракты собирали из клеток BEND, культивированных в отсутствие (C) или в присутствии (T) 25 нМ rbIFN-τ и в отсутствие (контроль) и в присутствии циклогексимида. STAT и IRF были обнаружены с помощью вестерн-блоттинга, как описано на рис. 4.
Из-за временной природы IFN-τ индукции STAT с последующей индукцией IRF-1, был проведен эксперимент, чтобы определить, требуется ли активация этих факторов транскрипции. перевод новых белков.В этом эксперименте смесь ингибиторов протеазы была включена во все реагенты, пока готовились экстракты клеток BEND. Обработка клеток BEND 25 нм rbIFN-τ эффективно индуцировала STAT-1 и STAT-2 в течение 30 мин (фиг. 5B). IRF-1 проявлял признаки индукции через 1 час, но наиболее сильно индуцировался через 2 часа после обработки IFN-τ. Опять же, даже в присутствии ингибиторов протеаз несколько полос белка иммунореагировали с антисывороткой против IRF-1, что согласуется с результатами, представленными на рис.4. Антитело против IRF-2 не иммунореагировало с ядерными белками, собранными в указанные сроки. Обработка клеток BEND циклогексимидом не влияла на индукцию STAT-1 или STAT-2 IFN-τ. Однако обработка циклогексимидом ингибировала индукцию IRF-1 в ответ на IFN-τ. Мы интерпретируем эти данные как означающие, что STAT постоянно присутствуют и индуцируются посредством фосфорилирования, чтобы проникнуть в ядро и взаимодействовать с элементами ответа в генах. Один из генов, индуцируемых STAT, — это ген IRF-1.
Анализ сверхсдвига электрофоретической подвижности
Инкубация ядерных экстрактов с антисывороткой против IRF-1 вызвала сверхсдвиг в структуре полос, который был наиболее выражен в ядерных белках клеток BEND, которые были собраны через 2 часа после обработки IFN-τ (рис. 6). Эти данные интерпретируются как означающие, что IRF-1 является одним из ядерных белков, который взаимодействует с ISRE гена bISG17 в ответ на IFN-τ. Поскольку обработка ядерных экстрактов неиммунной сывороткой не влияла на сдвиг полос, можно сделать вывод, что суперсмещенная полоса была специфичной для комплекса IRF-1 / ISRE при использовании антитела против IRF-1.Попытки вызвать сверхсдвиг полос при использовании антисыворотки против STAT-1 и STAT-2 потерпели неудачу (не показано).
Рис. 6.
Анализ сверхсдвига электрофоретической подвижности ядерных экстрактов из клеток BEND, обработанных 25 нм rbIFN-τ. После начальной реакции связывания экстрактов с меченым ISRE добавляли антитело против IRF-1 человека и продолжали инкубацию. на дополнительные 15 мин. Связанные комплексы разделяли с помощью PAGE, гели сушили и рентгенографировали, как описано на рис.3. Нижняя стрелка указывает положение предполагаемого комплекса IRF-1 / ISRE; верхняя стрелка отмечает суперсмещенный комплекс антитело / IRF-1 / ISRE. Время культивирования указано на верхней части геля. Обозначены инкубации с неиммунным IgG (N) или с антителом против IRF-1 (I, иммунный).
Рис. 6.
Анализ сверхсдвига электрофоретической подвижности ядерных экстрактов из клеток BEND, обработанных 25 нм rbIFN-τ. После начальной реакции связывания экстрактов с меченым ISRE добавляли антитело против IRF-1 человека и проводили инкубацию. продолжалось еще 15 мин.Связанные комплексы разделяли с помощью PAGE, гели сушили и рентгенографировали, как описано на фиг. 3. Нижняя стрелка указывает положение предполагаемого комплекса IRF-1 / ISRE; верхняя стрелка отмечает суперсмещенный комплекс антитело / IRF-1 / ISRE. Время культивирования указано на верхней части геля. Обозначены инкубации с неиммунным IgG (N) или с антителом против IRF-1 (I, иммунный).
Обсуждение
IFN-τ индуцирует транскрипцию гена ISG17 (12) и конъюгацию ISG17 с цитозольными белками матки (10).ISG17 матки напоминает hISG15 по структуре (11) и функции (10) в том, что оба являются гомологами убиквитина. На основании Саузерн-геномных блотов в настоящих экспериментах был идентифицирован один главный ген ISG17. Частота обнаружения гена ISG17 в геномной библиотеке крупного рогатого скота (, т.е. 1 на 1000000) подтверждает этот вывод. Другие второстепенные полосы гибридизации на Саузерн-геномных блотах могут представлять гены, которые связаны, но, вероятно, не являются генами убиквитина, поскольку зонд ISG17 не гибридизуется с мРНК убиквитина (12).Использование кДНК hISG15 в качестве зонда в саузерн-блотах бычьего генома и использование зонда кДНК bISG17 в геномных саузерн-блотах человека не удалось даже в условиях нестрогой гибридизации (не показаны).
Поскольку был идентифицирован только один главный ген bISG17, похоже, что bISG17 является аналогом hISG15. Общая организация генов hISG15 и bISG17 одинакова. Оба гена содержат один интрон после кодона инициации. Кодирующие последовательности гена bISG17 идентичны описанным в кДНК (11).Наиболее значительным сохранением первичной структуры между bISG17 (11), hISG15 (14, 21) и убиквитином (22) являются С-концевые аминокислоты Leu-Arg-Gly-Gly, которые, как было показано, участвуют в конъюгации с внутриклеточными белки.
Ген bISG17 кодирует уникальные аминокислоты по сравнению с hISG15. Во-первых, похоже, что он обрабатывается иначе, чем hISG15. Стоп-кодон (TAG) в bISG17 сразу следует за нуклеотидами, кодирующими Leu-Arg-Gly-Gly, давая зрелый белок размером 17 кДа.Напротив, hISG15 имеет стоп-кодон, расположенный ниже этой последовательности (14, 23). Пре-hISG15 (17 кДа) подвергается посттрансляционной модификации, которая удаляет С-концевые аминокислоты с образованием зрелого белка (15 кДа), заканчивающегося Leu-Arg-Gly-Gly (24, 25). Три цистеина существуют в bISG17 (11), по сравнению с одним цистеином в hISG15 (14). Если в bISG17 образуются дисульфидные мостики, они могут сильно влиять на функцию из-за совершенно другой третичной структуры по сравнению с hISG15.Присутствие свободной сульфгидрильной группы на нечетном Cys в bISG17 и на одиночном Cys в hISG15 также может взаимодействовать с белками-мишенями или образовывать гомологичные димеры.
Промотор hISG15 содержит функциональный тандемный ISRE от -113 до-94 относительно кэп-сайта мРНК, но мало что известно о последовательностях, которые расположены выше этого тандемного ISRE (14). В настоящих экспериментах сайт кэпа мРНК в гене bISG17 был идентифицирован с использованием двух методов. ТАТА-бокс (ТАТТААА) был расположен в гене bISG17 в положении -29 от предполагаемого кэп-сайта.Промотор гена bISG17 был подобен промотору гена hISG15 при размещении консервативного тандемного ISRE в положении -92. Однако три дополнительных предполагаемых ISRE присутствовали в гене bISG17 в положениях -123, -332 и -525.
IFN взаимодействуют с трансмембранными рецепторами, которые связаны с тирозинкиназами, такими как Jaks и Tyks. Помимо проявления предпочтения лиганда, рецепторы сортируют внутриклеточные ответы посредством активации Jaks и Tyks, которые затем фосфорилируют по крайней мере шесть факторов транскрипции STAT (17).Анализ сдвига подвижности в настоящих экспериментах показал, что ядерные белки, индуцированные rbIFN-τ, взаимодействуют с тандемным ISRE bISG17. Одна более медленно мигрирующая полоса была индуцирована rbIFN-τ.
IFN-τ индуцировал появление STAT-1, STAT-2 и IRF-1 в ядерных белках, экстрагированных из клеток BEND. Ингибирующий фактор транскрипции IRF-2 не был обнаружен в ядерных экстрактах, собранных после обработки IFN-τ, время от времени исследованных в настоящем эксперименте. Временные отношения между появлением STAT-1 и STAT-2 (0.5 ч) и IRF-1 (2 ч) в клетках BEND согласуется с индукцией этих ядерных белков в других клетках другими IFN типа 1 (26–28). STAT активируются в течение нескольких минут после лечения IFN. Фосфорилирование цитоплазматических STAT инициирует транслокацию в ядро, образование транскрипционных комплексов и индукцию вторичных факторов транскрипции, называемых IRF. В настоящих экспериментах индукция IRF-1 блокировалась обработкой циклогексимидом, тогда как индукция STAT не затрагивалась.Таким образом, можно сделать вывод, что основная роль STAT заключается в индукции гена IRF-1, который затем через IRF-1 активирует ген bISG17.
В настоящее время не существует доказательств, позволяющих предположить, что STATs взаимодействуют с bISG17 ISRE в клетках BEND. В настоящих экспериментах попытки суперсдвига комплексов STAT / ISRE с анти-STAT-антителами не увенчались успехом, даже когда использовались ядерные экстракты, собранные после культивирования в течение 0,5, 1 или 2 ч с IFN-τ (не показаны). Однако, поскольку STAT взаимодействуют с ДНК как гетеро- или гомодимеры, неизвестно, являются ли эпитопы, распознаваемые антителами, недоступными из-за образования димеров.Антитело против IRF-1 вызывало сверхсдвиг комплекса ядерного экстракта клеток BEND / ISRE, что позволяет предположить, что IRF-1 взаимодействует с bISG17 ISRE.
Каждый член семейства IRF выполняет различные роли в различных системах, таких как регуляция роста клеток, передача сигнала, индуцированная цитокинами, ответ на патогены и гематопоэтическое развитие (29). Семейство IRF теперь состоит из 10 членов, которые включают IRF 1–7, фактор ISG 3γ, белок, связывающий консенсусную последовательность IFN, и вирусный IRF (29). МРНК IRF-7 существует как минимум в трех вариантах сплайсинга (30, 31).Индукция нескольких иммунореагирующих полос IRF-1 на вестерн-блоттинге в ответ на IFN-τ была неожиданной и новой находкой. Поскольку STAT проявляются в виде отдельных полос с соответствующими молекулярными массами, протеолиз, по-видимому, не происходит при приготовлении ядерных экстрактов. Несмотря на это, белки, которые иммунореагировали с антителом против IRF-1, присутствовали даже тогда, когда ядерные экстракты были изолированы в присутствии смеси ингибиторов протеаз. Наименьший сигнал иммунореагирующего IRF-1 соответствует ожидаемой молекулярной массе мыши и hIRF-1.Одиночная мРНК IRF-1 мыши размером 2 т.п.н. кодирует белок IRF-1 (37 кДа), не имеющий сайтов N-гликозилирования (32). Однако IRF-1 человека имеет восемь сайтов фосфорилирования CKII (29). Неоднородность фосфорилирования может объяснять верхние полосы M r , которые иммунореагировали с антителом против IRF-1. Предварительная абсорбция антитела против IRF-1 с использованием пептида IRF-1 эффективно блокировала обнаружение всех, кроме одной, иммунореагирующей полосы на Вестерн-блоттинге. Белки, обнаружение которых было заблокировано, вероятно, представляют собой изоформы IRF-1 или родственные IRF-1 белки.Единственная полоса, которая не была заблокирована преадсорбцией антитела с пептидом IRF-1, также интересна тем, что она иммунореагирует с антителом против IRF-1, отсутствует, когда вторичное антитело удалено, и индуцируется IFN-τ способом, который идентичны другим иммунореагирующим полосам.
IRF-2 не обнаруживался в экстрактах клеток BEND через 0,5, 1 или 2 часа после обработки IFN-τ. IRF-2 считается антагонистом IRF-1, поскольку он является негативным регулятором генов, активируемых IRF-1 (29).Предположительно, IRF-2 действует как конкурентный антагонист, потому что он имеет ту же специфичность связывания ДНК, что и IRF-1, и конкурирует за тот же сайт связывания (33). Таким образом, было предложено, что ISG либо активируются, либо ингибируются в зависимости от отношения IRF-1 к IRF-2. В настоящих экспериментах соотношение этих двух факторов транскрипции способствует активации промотора bISG17 в течение исследованного времени.
Был выделен один главный ген, кодирующий bISG17. Этот ген, вероятно, является аналогом гена hISG15, но он кодирует белок, который больше, чем hISG15, и содержит несколько мутаций в функциональных аминокислотных остатках.Было показано, что оба белка функционируют как гомологи убиквитина путем конъюгирования с цитозольными белками. Судьба белков, которые конъюгированы с bISG17, еще предстоит определить, но, возможно, не связана с быстрой деградацией через протеасомы. Промоторы для этих генов похожи, но здесь сообщается о наличии трех дополнительных предполагаемых ISRE в гене bISG17. То, что это функциональные ISRE, еще предстоит определить с помощью сайт-направленного мутагенеза и анализа делеций. Используя новую клеточную линию BEND, Вестерн-блоттинг и EMSA, мы продемонстрировали, что IFN-τ индуцирует фосфорилирование STAT-1 и STAT-2, которые затем индуцируют IRF-1.IRF-1 был вовлечен во взаимодействие с bISG17 ISRE посредством анализа сверхсдвига EMSA. Поскольку не было показано, что STAT взаимодействуют с этим ISRE, мы подозреваем, что IRF-1 является прямым активатором транскрипции гена bISG17. Прекращение передачи сигнала будет в центре внимания будущих экспериментов и может включать убиквитинирование STATs (34) и последующую индукцию IRF-2.
Материалы и методы
Материалы
Эндонуклеазы рестрикции были получены от Promega Corp.(Мэдисон, Висконсин) или New England Biolabs, Inc. (Беверли, Массачусетс). Олигонуклеотиды для экспериментов по секвенированию и удлинению праймеров были синтезированы Life Technologies (Gaithersburg, MD). Радиоактивно меченые нуклеотиды были получены от New England Nuclear (Бостон, Массачусетс) или Amersham (Арлингтон-Хайтс, Иллинойс). Все остальные химические вещества были от Sigma Chemical Co. (Сент-Луис, Миссури) или Fisher Scientific (Питтсбург, Пенсильвания) и имели чистоту реагента или выше.
Саузерн-блоттинг
ДНК тимуса теленка (10 мкг) (Sigma Chemical Co.) был полностью обработан Bam HI, Eco RI, Hin dIII, Pst I, Sma I или Sac I. (40 мМ трис-ацетат, 1 мМ ЭДТА) и разделяли электрофоретически при 20 В в течение ночи. Фрагменты ДНК переносили на нейлоновые мембраны (0,2 мкм, Nytran +; Schleicher & Schuell, Inc., Keene, NH), сушили, фиксировали путем запекания при 80 ° C и гибридизовали с кДНК bISG17, меченной случайным праймером (11).Процедуры прегибридизации, гибридизации и промывки были идентичны описанным при скрининге геномной библиотеки крупного рогатого скота. Саузерн-блоты экспонировали на рентгеновской пленке (Fuji RX; Fisher Scientific) в течение 12 дней.
Просмотр библиотеки
Геномная библиотека крупного рогатого скота λGEM-11, сконструированная из ДНК сперматозоидов (Promega Corp.), была подвергнута скринингу (20) с использованием радиоактивно меченной кДНК bISG17 в качестве зонда (11). Приблизительно 10 6 бляшек помещали на планшеты с Escherichia coli Y1090 из расчета 25000 бляшкообразующих единиц (БОЕ) на 150-миллиметровый планшет.Бляшки переносили на нейлоновые мембраны Biotrans (размер пор 0,45 мкм) (ICN Biomedicals, Inc.; Ирвин, Калифорния), денатурировали 0,5 н. NaOH и 1,5 м NaCl, нейтрализовали 0,5 м Трис-HCl (pH 7,5) и 1,5 мл. NaCl и дважды промывали 2 × SSC (где 1 × SSC — 0,15 м NaCl, 15 мМ цитрат натрия). Мембраны запекали (2 часа, 80 ° C), прегибридизовали (3 часа; 50% формамид, 5 × SSC, 0,05 м фосфат натрия, 5 × раствор Денхардта, 0,1% SDS, 0,1 мг / мл ДНК спермы лосося), гибридизовали (18 ч), промывали трижды (15 мин: 2 × SSC / 0.1% SDS, 1 × SSC / 0,1% SDS, 0,1 × SSC / 0,1% SDS) (42 ° C) и помещены на пленку Fuji RX (Fisher Scientific) на 24 часа. Выявлена одна положительная бляшка.
После двух раундов очистки бляшек фаг очищали с использованием системы очистки ДНК Wizard Lambda (Promega Corp.), и вставку вырезали путем расщепления с помощью Sac I. Было обнаружено, что вставка фага содержит внутренний Sac I. сайтов и дали два рестрикционных фрагмента, 2,0 и 3,4 т.п.н., которые реагировали с зондом кДНК bISG17 на Саузерн-блоттинге.Эти фрагменты очищали в геле и субклонировали в pBluescript SK — (Stratagene; La Jolla, CA). Плазмиды, содержащие вставки размером 3,4 и 2,0 т.п.н., были обозначены как pDP7 и pDP8 соответственно.
Секвенирование ДНК
Дидезокси-секвенирование проводили со стандартными прямым и обратным праймерами M13 с использованием Sequenase (Amersham). Клон pDP7 содержал 3′-конец гена bISG17 из сайта Sac I, о котором известно, что он находится в положении 416 кДНК bISG17 (11).Этот клон секвенировали по сайту полиаденилирования. Клон pDP8 содержал нуклеотиды, расположенные выше положения 416 кДНК bISG17, и был полностью секвенирован с использованием вложенных делеций, созданных системой Erase-a-base (Promega Corp.), и четырех дополнительных праймеров в положениях -260, -160, 595 и 751 (относительно предполагаемого участка кэпа).
Идентификация сайта кэпа мРНК с использованием удлинения праймера
Эндометрий собирали у коровы на 18 день эстрального цикла (отрицательный контроль) и беременности.Этот день беременности был выбран для представления времени, в течение которого ген bISG17 транскрибируется на высоких уровнях (12). Тотальную РНК экстрагировали из ткани эндометрия с использованием реагента Tri (Molecular Research Center, Inc.; Цинциннати, Огайо), как описано ранее (12). РНК (20 мкг) объединяли с 10 5 имп / мин олигонуклеотидного праймера с концевой меткой (CACCATGGCCGTGGGTTCTGG), который был выбран так, чтобы концы на 15 оснований находились выше кодона инициации. Использовали два метода удлинения праймера. В первом, более продолжительном методе гибридизации (35), РНК и меченый на конце олигонуклеотид растворяли в 30 мкл гибридизационного буфера (3 м NaCl, 0.5 м HEPES, pH 7,5, 1 мМ EDTA), инкубировали при 85 ° C в течение 10 мин, а затем инкубировали в течение 8 ч при 30 ° C. После осаждения этанолом примированную РНК растворяли в 10 мМ Трис-HCl, pH 9,0, 50. мМ KCl, 1 мМ дезоксинуклеозидтрифосфаты, 10 мМ MgCl 2 и 40 ед. РНКзина (Promega Corp.). Добавляли обратную транскриптазу MMLV (вирус лейкемии Молони мыши) (200 ед., Gibco BRL; Bethesda, MD), и смесь инкубировали при 37 ° C в течение 1 часа. Добавляли рибонуклеазу (10 мкг; Promega Corp.) и ЭДТА (конечная концентрация 25 мМ) и инкубацию продолжали еще 30 мин.Продукт удлинения экстрагировали один раз фенол-хлороформ-изоамиловым спиртом (25: 24: 1), осаждали этанолом и растворяли в 10 мкл буфера для загрузки геля для секвенирования (10 мМ ЭДТА, 95% формамид, 0,1% бромфенолового синего, 0,1% ксилола. цианол). Образцы нагревали до 95 ° C в течение 5 мин.
Во втором методе более короткой гибридизации (36) осадок РНК / праймера растворяли в 10 мкл буфера, содержащего 50 мМ трис-HCl, pH 8,3, 50 мМ KCl, 1 мМ дезоксинуклеозидтрифосфаты, 10 мМ MgCl 2 , 10 мм дитиотреитол (ДТТ), 0.5 мМ спермидина, нагревают до 60 ° С в течение 20 мин, а затем охлаждают до комнатной температуры в течение 10 мин. Добавляли обратную транскриптазу MMLV (вирус лейкемии Молони мыши) (40,5 ед .; 6 мМ пирофосфат натрия) и смесь инкубировали при 37 ° C в течение 30 мин. Реакцию останавливали добавлением 20 мкл буфера для загрузки геля для секвенирования, как описано выше, и нагреванием до 90 ° C в течение 10 мин. Продукты удлинения праймера анализировали на 6% геле для секвенирования рядом с лестницей дидезокси-секвенирования для определения точной длины продуктов.
Культура клеток
Линия клеток эндометрия крупного рогатого скота, называемая клетками BEND (13), культивировалась в среде, состоящей из 40% MEM (Sigma Chemical Co.), 40% Ham’s F-12, 10% FCS (инактивированный нагреванием), 10% лошадиной сыворотки (инактивированный нагреванием). ), 1% ABAM (раствор антибиотика антимикотика, Sigma Chemical Co.) и инсулин (0,2 Ед / мл). Клетки (2 × 10 6 ) помещали в 75-см колбы 2 (Corning, Cambridge, MA) при 37 ° C и 5% CO 2 . После достижения приблизительно 90% слияния клетки культивировали с 0 или 25 нм rbIFN-τ или rbIFN-α в течение определенного времени в бессывороточной среде.При необходимости добавляли циклогексимид (50 мкг / мл) (37) и rbIFN-τ (25 нм).
Ядерные экстракты
Ядерные экстракты получали модификацией метода Saatcioglu et al. (38). По назначению коктейль ингибиторов протеаз (лейпептин, 0,6 Ед / мл; пепстатин, 1 Ед / мл; апротинин, 10 Ед / мл; фенилметилсульфонилфторид, 1 мМ; и ЭДТА, 1 мМ) добавляли во все буферы после первоначального сбора. ячеек BEND. Культивируемые клетки BEND дважды промывали, собирали (4 ° C) в 10 мМ HEPES (pH 7.5) и гранулированный (1700 × г ). Осадки клеток ресуспендировали в 5 объемах 10 мМ HEPES (pH 7,5), инкубировали на льду в течение 10 минут и снова осаждали. Клетки ресуспендировали в 2 об. 3 мМ MgCl 2 , 1 мМ DTT, 25 мМ HEPES (pH 7,5), 0,3% (об. / Об.) NP40 и разбивали 15 взмахами в гомогенизаторе Даунса (плотный пестик). Гомогенат немедленно центрифугировали в течение 20 секунд в микроцентрифуге Eppendorf (Brinkman Instruments, Inc., Westbury, NY) (12000 × г, ). Неочищенную ядерную таблетку суспендировали в 2 об.1 м KCl, 1 мМ DTT, 25 мМ HEPES, pH 7,5. Ядра лизировали добавлением 2 м KCl, достаточного для получения 0,4 м раствора, и осторожно перемешивали при 4 ° C в течение 15 мин. Лизат доводили до 20% в глицерине (об. / Об.) И центрифугировали (12000 × г ) в течение 15 мин при 4 ° С. Концентрацию белка в супернатанте анализировали с помощью анализа Coomassie Blue (Bio-Rad Laboratories, Inc., Hercules, CA), аликвоты и хранение при -80 ° C.
Emsa
Ядерные экстракты (5 мкг) инкубировали приблизительно с 20000 имп / мин (20 фмоль) меченного по концам двухцепочечного олигонуклеотида ISRE (GGGAAAAGGAAACCGAAACT; на основе последовательности промотора bISG17) в присутствии 1 мкг поли (dI-dC ) · Поли (dI-dC) (Sigma Chemical Co.) в конечном объеме 10 мкл, как описано ранее (38). Реакции связывания завершали в 25 мМ HEPES, pH 7,5, 1 мМ EDTA, 0,7 мМ DTT, 100 мМ KCl и 10% глицерине при комнатной температуре в течение 10 мин. Образцы наслаивали на 6% полиакриламидные гели (соотношение акриламид / бисакриламид 19: 1) в буфере из 20 мм Трис, 20 мм HEPES, 1 мм EDTA, pH 8,0 и подвергали электрофорезу при 100 В в течение 90 мин при комнатной температуре. Гели на короткое время фиксировали в 50% (об. / Об.) Этаноле, 7% (об. / Об.) Уксусной кислоте и переносили на бумагу 3MM (Whatman, Clifton, NJ), сушили и рентгенографировали.Для конкурентных экспериментов немеченый двухцепочечный ISRE добавляли к стандартной реакции связывания при приблизительно 1-, 10- и 100-кратном молярном избытке (0,03 пмоль, 0,3 пмоль и 3 пмоль) по сравнению с меченным 32 P ISRE.
Для анализа суперсдвига на основе антител (39) все стандартные компоненты образца были объединены и инкубированы при комнатной температуре в течение 5 минут. Добавляли антитела против IRF-1, STAT-1 или STAT-2 (1 мкг, Santa Cruz Biotechnology, Inc., Санта-Крус, Калифорния) или неиммунный кроличий IgG (1 мкг), и инкубацию продолжали еще в течение За 15 мин до того, как образцы были загружены в 4% неденатурирующие одномерные гели для ПААГ.
Радиомаркировка зондов
кДНК bISG17 для саузерн-блотов метили [α — 32 P] dCTP с использованием процедуры случайного праймера (Boehringer Mannheim, Indianapolis, IN). Олигонуклеотиды для анализов удлинения праймеров и сдвигов подвижности метили по концам [γ- 32 P] АТФ с помощью полинуклеотидкиназы с использованием стандартных процедур (35). Меченые по концам олигонуклеотиды для анализа сдвига подвижности отжигали с 10-кратным избытком комплементарной немеченой цепи, чтобы гарантировать, что вся метка содержится в двухцепочечной ДНК.
Вестерн-блоты
Вестерн-блоттинга проводили, как описано ранее (4, 7, 12). Ядерные экстракты (4 мкг на дорожку) разделяли на 7,5% SDS-полиакриламидных гелях, переносили на нитроцеллюлозу и детектировали первичным антителом против человеческого STAT-1 (E-23), человеческого STAT-2 (C-20), человеческого IRF. -1 (C-20) или IRF-2 человека (C-19) (Santa Cruz Biotechnology, Inc.). Первичные антитела разводили до 1,0 мкг / нл. Второе антитело представляло собой конъюгат против щелочной фосфатазы IgG кролика (1: 5000; Promega Corp.).
Предварительная абсорбция антител против IRF-1
Ядерные экстракты получали из клеток BEND, которые инкубировали с 25 нМ rbIFN-τ в течение 2 часов. Экстрагированные белки разделяли с использованием одномерного PAGE и вестерн-блоттинга, как описано выше, с антителом против IRF-1, которое было предварительно адсорбировано (1 час, 25 ° C с 1: 0, 1: 1 или 1:10 молярным избытком IRF- 1 (Santa Cruz Biotechnology, Inc.). Контроль, в котором первичное антитело было удалено из реакции вестерн-блоттинга, был включен, чтобы определить, иммунореагирует ли второе детектирующее антитело неспецифически.
Благодарности
Авторы благодарят доктора А. Л. Хааса (Медицинский колледж Висконсина, Милуоки, Висконсин) за кДНК hISG15 и доктора Р. М. Робертса (Университет Миссури, Колумбия, Миссури) за рекомбинантные интерфероны.
Это исследование было поддержано грантом NIH R29 HD-32475.
Список литературы
1Thatcher
WW
,Meyer
MD
,Danet-Desnoyers
G
1995
Признание беременности матерью.
J Reprod Fertil Suppl
49
:15
—28
2Bazer
FW
,Spencer
TE
,Новый Ott
TL
a
сигнал распознавания беременности.
Am J Reprod Immunol
37
:412
—420
3Roberts
RM
,Malathy
PV
,Hansen
TR
000800080008K
1990
Секреторные продукты крупного рогатого скота, участвующие в распознавании беременности.
J Anim Sci 68 [Suppl 2]:28
—38
4Godkin
JD
,Smith
SE
,Johnson
RD
,Dore
1997 JEРоль интерферонов трофобластов в поддержании беременности на ранних сроках у жвачных животных.
Am J Reprod Immunol
37
:137
—143
5Hansen
TR
,Austin
KJ
,Perry
DJ
000 J
,KMG
,Johnson
GA
1999
Механизм действия интерферона-τ в матке на ранних сроках беременности.
J Reprod Fertil [Suppl 54], в печати
6Austin
KJ
,Ward
SK
,Teixeira
MG
,Dean
VC
,Hansen
TR
1996
Перекрестно-реактивный белок убиквитин высвобождается маткой крупного рогатого скота в ответ на интерферон на ранних сроках беременности.
Biol Reprod
54
:600
—606
7Hershko
A
,Ciechanover
A
1992
Система деградации белка.
Annu Rev Biochem
61
:761
—807
8Finley
D
,Chau
V
1991
Убиквитинирование.
Annu Rev Cell Biol
7
:25
—69
9Driscoll
J
,Goldberg
AL
1990
Протеасома (мультикат) является протеасомным компонентом 1500 -kDa протеолитический комплекс, который расщепляет убиквитин-конъюгированные белки.
J Biol Chem
265
:4789
—4792
10Johnson
GA
,Austin
KJ
, VanКирк
EA
TRБеременность и интерферон-τ индуцируют конъюгацию бычьего белка, перекрестно реагирующего на убиквитин, с цитозольными белками матки.
Biol Reprod
58
:898
—904
11Austin
KJ
,Pru
JK
,Hansen
TR
кодирование бинарной кислоты перекрестно-реактивный белок: сравнение с убиквитином и 15 кДа гомологом убиквитина.Эндокринная
5
:191
—197
12Хансен
TR
,Остин
KJ
,Джонсон
GA
перекрестная экспрессия белка
1997 в эндометрии крупного рогатого скота.
Эндокринология
138
:5079
—5082
13Staggs
KL
,Austin
KJ
,MG Johnson
GA
,Dooley
VA
,Hansen
TR
1998
Комплексная индукция белков матки крупного рогатого скота интерфероном-τ.
Biol Reprod
59
:293
—297
14Рейх
N
,Evans
B
,Levy
D
KnE
, DarnellJr
JE
1987
Интерферон-индуцированная транскрипция гена, кодирующего белок 15 кДа, зависит от расположенного выше энхансерного элемента.
Proc Natl Acad Sci USA
84
:6394
—6398
15Леви
D
,Larner
A
,Chaudhuri
A
Jr
JE
1986
Транскрипция, моделируемая интерфероном: выделение индуцибельного гена и идентификация его регуляторной области.
Proc Natl Acad Sci USA
83
:8929
—8933
16Pestka
S
,Langer
JA
,Zoon
CE000
KC
1987Интерфероны и их действие.
Annu Rev Biochem
56
:727
—777
17Darnell
Jr
JE
1997
STAT и генное регулирование.
Наука
277
:1630
—1635
18Харада
H
,Takahashi
E
,Itoh
S
K,Taniguchi
T
1994
Структура и регуляция генов человеческого фактора регуляции интерферона 1 (IRF-1) и IRF-2: значение для генной сети в системе интерферона.
Mol Cell Biol
14
:1500
—1509
19Lowe
J
,Mcdermott
H
,Loeb
K
asasLandon
AL
,Mayer
RJ
1995
Иммуногистохимическая локализация перекрестно-реактивного белка убиквитина в тканях человека.
J Pathol
177
:163
—169
20Hansen
TR
,Leaman
DW
,Cross
JC
,Mathial
Mathial JA
Roberts
RM
1991
Гены интерферонов трофобласта и родственного интерферона αII обладают отдельными 5′-промоторными и 3′-фланкирующими последовательностями.
J Biol Chem
266
:3060
—3066
21Нарасимхан
J
,Potter
JL
,Haas
kon Гомолог убиквитина, индуцированный интерфероном, отличается от гомолога убиквитина.J Biol Chem
271
:324
—330
22Wilkinson
KD
,Audhya
TK
1981
-зависимый протеин Стимуляция АТ последовательность Arg-Gly-Gly.
J Biol Chem
256
:9235
—9241
23Blomstrom
DC
,Fahey
D
,Kutny
R
R
, Kohrant8,
R
E
1986
Молекулярная характеристика индуцированного интерфероном белка массой 15 кДа.
J Biol Chem
261
:8811
—8816
24Feltham
N
, HillmanJr
M
,Cordova
B
,B
,Blomstrom
D
, KnightJr
E
1989
Интерферон-индуцированный белок массой 15 кДа и его предшественник 17 кДа: экспрессия в Escherichia coli, и характеристика, очистка .
J Интерферон Res
9
:493
—507
25Knight
Jr
E
,Fahey
D
,Cordova
0003 B,,B
,Cordova
R
,Reich
N
,Blomstrom
D
1988
Интерферон-индуцированный белок массой 15 кДа получают с помощью COOH-концевого процессинга предшественника 17 кДа.
J Biol Chem
263
:4520
—4522
26Бинелли
M
,Subramaniam
PS
,Thatcher
Промоутеры WW фосфорилирование белка STAT-1 в эндометрии.Biol Reprod 54 [Suppl 1]: 450
(Аннотация) 27Бинелли
M
,Diaz
T
,Hansen
TR
,Thatcher
WW
интерферон-τ индуцирует фосфорилирование и ядерную транслокацию STAT-1, -2 и -3 в эпителиальных клетках эндометрия.Biol Reprod 58 [Suppl 1]: 214
(Abstract) 28Spencer
TE
,Ott
TL
,Bazer
FW
1998
Нормативные факторы экспрессии в эндометрии овцы: влияние беременности и интерферона овцы τ.
Biol Reprod
58
:1154
—1162
29Nguyen
H
,Hiscott
J
,Pitha
Intermediate .
Cytokine Growth Factor Rev
8
:293
—312
30Zhang
L
,Pagano
JS
1997
70003 новый регуляторный фактор IRF -Вирусная задержка Барра.Mol Cell Biol
17
:5748
—5757
31Au
WC
,Moore
PA
,LaFleur
DW
,ha
PM
1998
Характеристика фактора регуляции интерферона-7 и его потенциальная роль в активации транскрипции генов интерферона А.
J Biol Chem
273
:29210
—29217
32Miyamoto
M
,Fujita
T
,Kimura
MarH
,Sudo
Y
,Miyata
T
,Taniguchi
T
1988
Регулируемая экспрессия гена, кодирующего ядерный фактор IRF-1, который специфически связывается с IFN-β генные регуляторные элементы.
Cell
54
:903
—913
33Tanaka
N
,Kawakami
T
,Taniguchi
T
регуляторных последовательностей (IRF-1) и IRF-2, регуляторы роста клеток и интерфероновой системы.
Mol Cell Biol
13
:4531
—4538
34Kim
TK
,Maniatis
T
1996
Регулирование протеасома ST-γ интерфероном-γ-интерфероном путь.
Science
273
:1717
—1719
35Sambrook
J
,Fritsch
EF
,Maniatis
T
изд 2.Cold Spring Harbor Press
,Cold Spring Harbor, NY,
pp7.79
—7.83
36Doyle
K
1996
Протоколы и руководство по применению
, изд.3.Promega Corp, Madison, WI
, pp310
—312
37Waring
P
1990
Фрагментация ДНК, индуцированная в макрофагах под действием глиотоксина, не требует синтеза белка и предшествует повышенному инозитолу. уровни трифосфата.
J Biol Chem
265
:14476
—14480
38Saatcioglu
F
,Perry
DJ
,Pasco
ДНК-связывающая активность арилуглеводородного (Ah) рецептора: специфичность последовательности и требования Zn 2+ .
J Biol Chem
265
:9251
—9258
39Kristie
TM
,Roizman
B
1986
1 вирус герпеса, основной белок вируса герпеса стабильно и специфически связаны с промоторно-регуляторными доменами α-генов и некоторых других вирусных генов.
Proc Natl Acad Sci USA
83
:3218
—3222
Авторские права © 1999, Общество эндокринологов
Противовоспалительное действие экстракта этанола из листьев и побегов Cedrela odorata L.в цитокин-стимулированных кератиноцитах
Введение
Атопический дерматит (АД) вызывается нарушением иммунная система. Следовательно, для лечения БА необходимо: нормализовать иммунную систему в дополнение к лечению внешних кожные проявления (1–3). Характерные симптомы БА: кожный зуд, гной, эритема и хроническая бактериальная инфекция кожи. Кожа барьерные дефекты признаны одними из важнейших особенности AD (4–6). Аномальная дифференцировка кожи эпителиальные клетки вызывают дефекты кожного барьера.Эти дефекты позволяют проникновение аллергенов, вызывающих воспалительный реакция и системная иммунологическая реакция. Эти кожный барьер дефекты обычно вызваны генетическими и приобретенными факторами (7,8).
Кератиноциты — это клетки эпидермиса, продуцирующие кератин, которые составляют ~ 90% клеток эпидермиса (9,10). В Основная функция эпидермиса — создание барьера, который защищает организм человека от факторов окружающей среды, в том числе болезнетворные микроорганизмы, тепло, ультрафиолетовые лучи и потеря влаги.Тимус стромальный лимфопоэтин (TSLP), присутствующий в кератиноцитах, стимулирует дендритные клетки для увеличения производства тимуса и регулируются активацией хемокин [TARC; также известный как хемокин (мотив C-C) лиганд 17, CCL17] и хемокин, полученный из макрофагов (MDC; также известный как CCL22) (11,12). TARC и MDC — типичные помощники типа 2 Хемокины, секретируемые Т-клетками (Th3-клетками), которые индуцируют Th3-клетки рекрутмент в очагах воспаления (13). Высокие концентрации TARC, MDC и TSLP были обнаружены у пациентов с БА (14).Эти биомаркеры, как известно, очень тесно связан с атопическим заболеванием (15,16).
Cedrela odorata L. — растение из рода Cedrela. и распространен в тропических климатических регионах, таких как Амазонка (17,18). Его древесина в основном используется в сыром виде. материал для домашней мебели или музыкальных инструментов (19). Традиционно C. odorata L. используется в народных средствах от диареи, лихорадки, воспалений, рвота, кровотечение и несварение желудка (20,21). Однако, поскольку в литературе об этом растении нет отношение к воспалению или AD, оно исследовалось в настоящее время изучение.Целью исследования было изучить биохимическую активность этанольного экстракта C. odorata L. (COEE) с использованием клеток HaCaT, индуцированных со смесью фактора некроза опухоли (TNF) -α и интерферона (IFN) -γ.
Материалы и методы
Подготовка COEE
Листья и побеги C. odorata L. собраны в национальном парке Пало-Верде, Коста-Рика, в 2014 г. A Образец ваучера (KRIB 0056657) сдан на хранение в Международный центр исследования биологических материалов (IBMRC) в Корейский научно-исследовательский институт биологии и биотехнологии (Тэджон, Южная Корея).Сушеные и очищенные листья и побеги C. odorata (100 г) экстрагировали 700 мл 95% этанола в течение 2 ч, трех раз. Экстракт пропускали через фильтровальную бумагу (3 мм; Whatman PLC, Кент, Великобритания), конденсированный с помощью роторного испарителя (Büchi AG, Flawil, Швейцария) и лиофилизировали с помощью сублимационной сушилки. (Martin Christ Gefriertrocknungsanlagen, Osterode am Harz, Германия).
Культура клеток
Была приобретена линия клеток HaCaT кератиноцитов человека. из Американского центра культуры тканей (Манассас, Вирджиния, США).Клетки были культивированы в среде Игла, модифицированной Дульбекко (DMEM; Gibco; Thermo Fisher Scientific, Inc. Уолтем, Массачусетс, США), содержащий 10% фетальная бычья сыворотка (Gibco; Thermo Fisher Scientific, Inc.) и 1% пенициллин-стрептомицин и поддерживали в инкубаторе при температура 37 ° C с атмосферой 5% CO2 при сохранении конфлюентность 60–80%.
Анализ МТТ
Жизнеспособность клеток измеряли с помощью 3- (4,5-диметилтиазол-2-ил) -2,5-дифенилтетразолий бромид (МТТ) проба.Клетки HaCaT высевали в 96-луночные планшеты (SPL Life Sciences, Pocheon, Корея) при плотности 1 × 104 клеток / лунку. После 6 ч инкубации COEE (1,25, 2,5, 5, 10 и 20 мкг / мл) был вводили, и клетки инкубировали в течение 24 ч при 37 ° C. Необработанные клетки были определены как контрольная группа. Далее 5 мкл МТТ раствор (5 мг / мл; Amresco, LLC, Солон, Огайо, США) добавляли в супернатант клеток, и смесь инкубировали 4 ч при 37 ° C. После удаления среды добавляли ДМСО для растворения формазана.Считывающее устройство для микропланшетов использовали для измерения оптической плотности при 570 нм, и значение необработанного формазана было установлено на 100%.
Анализ цитокинов
клеток HaCaT культивировали в 96-луночных планшетах при плотность 5 × 104 клеток / лунка. После инкубации в течение 6 ч при 37 ° C, COEE (2,5, 5, 10 и 20 мкг / мл) и Bay11-7082 (5 мкМ) были управляемый. TNF-α / IFN-γ (по 10 нг / мл каждого; TNF-α, кат. 300-01А; IFN-γ кат. нет. 300-02; PeproTech, Inc., Роки-Хилл, Нью-Джерси, США) применяли через 1 час. На следующий день супернатант был собрано.Тормозящее действие COEE на секрецию интерлейкин (IL) -6, IL-8, TARC и MDC в супернатанты был оценивали с использованием следующих наборов ELISA: IL-6 (кат. № 555220; BD Биологические науки, Санта-Клара, Калифорния, США), IL-8 (каталожный номер DY208), TARC (№ по каталогу DY364) и MDC (№ по каталогу DY336; все R&D Systems, Inc., Миннеаполис, Миннесота, США). Образцы были проанализированы в соответствии с протокол производителя.
Анализ ОТ-ПЦР
Тотальную РНК экстрагировали из клеток с использованием Реагент TRIzol® (Invitrogen, Thermo Fisher Scientific, Inc.). После выделения РНК был проведен синтез кДНК. с использованием набора для обратной транскрипции QuantiTect (номер по каталогу 205310; Qiagen GmbH, Хильден, Германия). РНК, буфер гДНК Wipeout и Воду, свободную от РНКазы, смешивали и инкубировали при 42 ° C в течение 2 минут. Потом, Обратная транскриптаза Quantiscript, буфер Quantiscript RT и RT River Mix смешивали с вышеупомянутыми реагентами и инкубировали. при 42 ° C в течение 15 мин. Наконец, смесь инкубировали при 95 ° C в течение 3 мин для инактивации обратной транскриптазы Quantiscript.В синтезированная кДНК была амплифицирована с помощью ПЦР с использованием GoTaq® Green Master mix (Promega Corporation, Мэдисон, Висконсин, США) с 11 пмоль каждого праймера. Последовательности праймеров ОТ-ПЦР, используемых в Настоящее исследование представлено в Таблице I. β-актин был использован в качестве контрольного гена. Термоциклирование условия были следующими: предварительная денатурация при 94 ° C в течение 5 мин, затем 25 циклов денатурации при 94 ° С в течение 20 сек, отжиг при 56 ° C в течение 20 секунд и удлинение при 72 ° C в течение 45 секунд. Реакция продукты разделяли электрофорезом на 1.5% агарозный гель и окрашивали наборами RedSafe ™ (Intron Biotechnology, Inc., Соннам, Корея). Изображения были сняты с использованием зума Olympus C4000. система камеры (Olympus Corporation). Денситометрия полос были измерены с помощью программного обеспечения ImageJ 1.50i (Национальные институты Health, Бетесда, Мэриленд, США).
Таблица I.Последовательность обратного праймеры ПЦР для транскрипции, используемые в данном исследовании. |
Таблица I.
Последовательности обратного праймеры ПЦР для транскрипции, используемые в данном исследовании.
| Ген | Направление | Праймерные последовательности (человек; 5′-3 ‘) | Размер фрагмента (бп) |
|---|---|---|---|
| TARC | Нападающий | CAC GCA GCT CGA GGG ACC AAT GTG | 222 |
| Задний | TCA AGA CCT CTC AAG GCT TTG CAG G | ||
| MDC | Вперед | AGG ACA GAG CAT GGC TCG CCT ACA GA | 362 |
| Задний | TAA TGG CAG GGA GGT AGG GCT CCT GA | ||
| IL-6 | Вперед | GAC AGC CAC TCA CCT CTT CA | 124 |
| Задний | AGT GCC TCT TTGCTG CTT TC | ||
| IL-8 | Вперед | ATG ACT TCC AAG CTG GCC GTG GCT | 299 |
| Задний | TTA TGA ATT CTC AGC CCT CTT CAA AAA | ||
| β-актин | Вперед | CAT GTA CGT TGC TAT CCA GGC | 250 |
| Задний | CTC CTT AAT GTC ACG CAC GAT |
Иммуноблоттинг
Иммуноблоттинг клеток проводили как описано ранее (22).В Клетки HaCaT предварительно обрабатывали указанными концентрациями COEE (2,5, 5,10 и 20 мкг / мл) в течение 1 ч и стимулировали TNF-α / IFN-γ (по 10 нг / мл) в течение 20 мин при 37 ° C. Иммуноблоты были создан с использованием антиядерного фактора (NF) -κB p65 (каталожный номер sc-8242; Санта-Круз Биотехнология, Инк., Даллас, Техас, США), ингибитор α-фосфо-NF-κB (анти-p-IκBα; кат. № 2859), анти-IκB-α (каталожный номер 9242), анти-NF-κB p-p65 (каталожный номер 3033) и анти-β-актин (номер по каталогу 4967; все 1: 1000; все из Cell Signaling Technology, Inc., Данверс, Массачусетс, США). Вторичные антитела были Козьи анти-кроличьи IgG, конъюгированные с пероксидазой хрена (кат. sc-2030; 1: 5,000 в 5% обезжиренном молоке; Санта-Крус Биотехнология, Inc.). Денситометрию полос измеряли с помощью ImageJ Программное обеспечение 1.50i.
Анализ люциферазы
КлеткиHaCaT трансфицировали 0,1 мкг pGL4.32. (luc2P / NF-κB-RE / Hygro) плазмиды (Promega Corporation), используя Реагент для трансфекции липофектамина 2000 (Invitrogen; Thermo Fisher Scientific, Inc.) согласно протоколу производителя.В 24 часа после трансфекции клетки предварительно обрабатывали COEE (2,5, 5, 10 и 20 мкг / мл) и Bay11-7082 (5 мкМ) в течение 1 ч при 37 ° C, стимулировали с TNF-α / IFN-γ в течение 20 часов при 37 ° C, собирали и затем оценивали на активность люциферазы luc2P с использованием репортера люциферазы ONE-Glo ™ система анализа (Promega Corporation) по данным производителя инструкции. Нормализация проводилась путем сравнения с Люциферазная активность Renilla.
Статистический анализ
Данные представлены как среднее значение ± стандартная ошибка среднего.Статистическая различия между группами определяли с помощью однофакторного дисперсионного анализа с повторные измерения с последующим тестированием Ньюмана-Кеулса с использованием SPSS программное обеспечение версии 14.0 (IBM Corp., Армонк, Нью-Йорк, США). P <0,05 было считается, что это указывает на статистически значимое различие.
Результаты
Цитотоксические эффекты COEE в HaCaT ячейки
Влияет ли COEE на жизнеспособность клеток HaCaT анализировали с помощью теста МТТ. Как показано на рис. 1, COEE не проявлял цитотоксичности. и не влиял на жизнеспособность клеток даже при использовании с высокой концентрация 20 мкг / мл в течение 24 ч.Это подтверждено экспериментально что COEE не проявляет токсичности в клетках HaCaT при концентрации ≤20 мкг / мл.
COEE ингибирует TNF-α / IFN-γ индуцированный IL-6 и экспрессия IL-8 в клетках HaCaT
Далее, анализы ELISA и RT-PCR были использованы для изучения ингибирующее действие COEE на продукцию IL-6 и IL-8 в Клетки HaCaT, стимулированные TNF-α / IFN-γ. Результаты ОТ-ПЦР подтвердили, что уровни IL-6 и IL-8 были значительно увеличилось в группе, получавшей TNF-α / IFN-γ по сравнению с таковыми в необработанной группе.Аналогично, когда TNF-α / IFN-γ добавляли после введение COEE в клетки HaCaT, уровни экспрессии мРНК IL-6 и IL-8 снижается в зависимости от концентрации способом по сравнению с таковыми в группе, получавшей TNF-α / IFN-γ без COEE (рис. 2A). Более того, результаты ELISA показали, что COEE ингибирует экспрессию белков IL-6 и IL-8 в клетках HaCaT, стимулированных TNF-α / IFN-γ по сравнению с таковыми в клетках, обработанных TNF-α / IFN-γ без COEE (рис. 2B и C).
COEE ингибирует TNF-α / IFN-γ, индуцированные Экспрессия TARC / CCL17 и MDC / CCL22 в клетках HaCaT
Хемокины являются важными медиаторами воспалительная реакция и иммунный ответ. Контакт с кератиноцитов к TNF-α / IFN-γ индуцирует повышенную экспрессию хемокины, приводящие к проникновению лейкоцитов в воспалительные поражения кожи (23,24). В Настоящее исследование, ELISA и RT-PCR были использованы для изучения подавляющий эффект COEE на продукцию TARC и MDC в TNF-α / IFN-γ-стимулированные клетки HaCaT.Подтверждены результаты ОТ-ПЦР. что уровни мРНК TARC и MDC были значительно увеличены в клетки, обработанные TNF-α / IFN-γ по сравнению с таковыми в необработанных группа. Точно так же, когда TNF-α / IFN-γ был добавлен после нанесения COEE в клетки HaCaT, уровни экспрессии мРНК TARC и MDC снизился по сравнению с таковыми в группе, получавшей TNF-α / IFN-γ без COEE, и снижение оказалось зависит от концентрации (рис. 3А). Кроме того, результаты ELISA показали, что COEE ингибирует экспрессия белков TARC и MDC в клетках HaCaT, индуцированная TNF-α / IFN-γ (рис.3B и C).
COEE ингибирует фосфорилирование NF-κB p65 в клетках HaCaT
Сигнальный путь ядерного фактора NF-κB считается прототипическим провоспалительным путем, в основном из-за роль NF-κB в экспрессии провоспалительных генов, для например, молекулы адгезии, хемокины и цитокины (25). Следовательно, фосфорилирование NF-κB p65 в клетках HaCaT, обработанных TNF-α / IFN-γ, был проанализирован в настоящем изучение. Результаты вестерн-блоттинга показали, что фосфорилирование IκBα и NF-κB p65 было значительно увеличено обработкой TNF-α / IFN-γ, тогда как предварительная обработка COEE ослабляла индуцированное TNF-α / IFN-γ увеличение уровней p-IκBα и p-p65 (Рисунок.4).
Рисунок 4.Влияние COEE на TNF-α / IFN-γ, индуцированное Активация NF-κB в клетках HaCaT. (A) Фосфорилирование p65 и IκBα анализировали методом вестерн-блоттинга. (B) Клетки HaCaT были трансфицированный вектором экспрессии репортерной плазмидой люциферазы (0,1 мкг). Через 24 часа после трансфекции клетки HaCaT обрабатывали COEE в течение 1 ч, а затем активность люциферазы luc2P / Renilla измеряется. Все данные представляют собой три независимых эксперимента.Данные представлены как средние значения ± стандартная ошибка среднего для трех образцов. #P <0,01 по сравнению с необработанным контролем. * P <0,05, ** P <0,01 и *** P <0,001 по сравнению с группой TNF-α / IFN-γ. COEE, Cedrela odorata L. этанольный экстракт; TNF, фактор некроза опухоли; IFN, интерферон; NF-κB, ядерный фактор-κB; p65, субъединица NF-κB p65; р, фосфо; IFN, интерферон; IκBα, ингибитор NF-κB α. |
COEE и Bay11-7082 подавляют фосфорилирование NF-κB в клетках HaCaT
Bay11-7082 ингибирует фосфорилирование IκBα в клетках и использовался, чтобы указать на участие канонического IκB киназы и NF-κB в механистическом анализе (26).Был проведен сравнительный эксперимент. в настоящем исследовании, в котором эффективность COEE (20 мкг / мл) была по сравнению с Bay11-7082 (5 мкМ) в ингибировании NF-κB стр65. Фосфорилирование IκBα и NF-κB p65 было достоверно увеличено обработкой TNF-α / IFN-γ, в то время как предварительная обработка COEE и Bay11-7082 снижали уровни p-p65 и p-IκBα в Клетки HaCaT, обработанные TNF-α / IFN-γ, как показали результаты иммуноблоттинг и анализ люциферазы (рис. 5).
COEE и Bay11-7082 подавляют экспрессия хемокинов и цитокинов в клетках HaCaT
При использовании ELISA и RT-PCR подавляющие эффекты COEE и Bay11-7082 о производстве TARC, MDC, IL-6 и IL-8 в HaCaT клетки, стимулированные TNF-α / IFN-γ, были исследованы.Результаты подтвердили, что уровни TARC, MDC, IL-6 и IL-8 были значительно увеличился в группе, получавшей TNF-α / IFN-γ по сравнению с таковыми в необработанной группе. Однако когда TNF-α / IFN-γ был добавлен после введения COEE и Bay11-7082 к клеткам HaCaT, уровням экспрессии мРНК и белка TARC, MDC, IL-6 и IL-8 снизились, по-видимому, концентрационно-зависимым образом по сравнению с таковыми в группе обработанные TNF-α / IFN-γ без COEE (фиг. 6).
Рисунок 6.Влияние COEE и Bay11-7082 на TNF-α / IFN-γ индуцированные хемокины и активация цитокинов в HaCaT клетки. Клетки HaCaT предварительно обрабатывали COEE (20 мкг / мл), Bay11-7082 (5 мкМ), а затем индуцировали TNF-α (10 нг / мл) / IFN-γ (10 нг / мл) для 24 ч. При концентрациях белка (A) TARC, (B) MDC, (C) IL-6 и (D) Ил-8. (E) экспрессия мРНК TARC, MDC, IL-6 и IL-8. Данные представлены как средние значения ± стандартная ошибка среднего для трех образцов. #P <0,01 vs. необработанный контроль; * P <0,05, ** P <0,01 и *** P <0.001 по сравнению с группой TNF-α / IFN-γ. COEE, Cedrela odorata L. этанол извлекать; TNF, фактор некроза опухоли; IFN, интерферон; TARC, вилочковая железа и регулируемый активацией хемокин; MDC, полученный из макрофагов хемокин; ИЛ, интерлейкин. |
Обсуждение
год нашей эры, также известная как экзема, является распространенным хроническим заболеванием. воспалительное заболевание кожи и характеризуется инфильтрацией воспалительных клеток в кожу (27). Хотя AD обычно лечат иммунодепрессанты и противовоспалительные препараты, эти лечение часто оказывается неэффективным (28).Это может побудить пациентов использовать альтернативные стратегии лечения, в том числе традиционные на растительной основе Средства.
В настоящем исследовании эксперименты in vitro были проведены для определения влияния COEE на провоспалительное секреция хемокинов в кератиноцитах. Кератиноциты служат важнейшим роль в воспалительных заболеваниях кожи через производство провоспалительные цитокины и хемокины (29). Эти клетки участвуют в патогенез БА путем секреции различных хемокинов, среди которых TARC и MDC избирательно привлекают клетки Th3, которые преобладают в атопическое воспаление (30).Ил-8 усиливает воспалительную реакцию при БА за счет привлечения нейтрофилов в кожные поражения (31). Многочисленные исследователи сообщили, что лечение TNF-α / IFN-γ увеличивает выработку хемокинов в кератиноцитах (32,33). В Комбинация TNF-α / IFN-γ активирует несколько внутриклеточных путей, включая пути NF-κB (34,35). Было показано, что пути NF-κB участвуют в регуляции продукция хемокинов и цитокинов в клетках кератиноцитов; они служат играет важную роль в иммунном ответе и регулирует воспалительные процессы. сигнализация (36,37).Поэтому эксперименты по исследованию влияние COEE на экспрессию MDC, стимулированную TNF-α / IFN-γ и TARC в клетках HaCaT были проведены в настоящем исследовании.
Семейство NF-κB включает критическую транскрипцию факторы, которые активируются различными стимулами, включая TNF-α, IFN-γ, IL-1 и липополисахарид. При стимуляции NF-κB комплексы в цитоплазме перемещаются в ядро, где они участвуют в экспрессии множества провоспалительных генов (22). Сигнальные пути NF-κB имеют было показано, что участвует в регуляции TARC и MDC продукция в ячейках HaCaT (38).Кроме того, промоторы TARC и MDC содержат Сайты связывания NF-κB (39), что указывает на то, что эти факторы транскрипции могут участвовать в модуляция TARC и MDC (38). В В настоящем исследовании результаты показали, что COEE подавляет сигнальные пути, ведущие к активации TARC и MDC посредством NF-κB.
Лечение COEE или ингибитором IκBα Bay 11-7082 снижает TNF-α / IFN-γ экспрессию провоспалительных цитокины (IL-6 и IL-8) и хемокины (TARC и MDC) до исходного уровня значения.Эти результаты показывают, что COEE снижает производство провоспалительные цитокины ИЛ-6 и ИЛ-8 и экспрессия хемокины Th3 TARC и MDC в клетках HaCaT посредством ингибирования Пути NF-κB в клетках HaCaT. Предполагается, что эти эффекты тесно связан с подавлением активации NF-κB. Таким образом, предполагается, что COEE имеет потенциал для использования. как лечебный препарат для лечения БА.
В заключение, результаты настоящего исследования указывают на то, что COEE ингибирует экспрессию, стимулированную TNF-α / IFN-γ TARC и MDC в клетках HaCaT посредством ингибирования NF-κB пути.Способность COEE подавлять образование этих Хемокины Th3 предполагают, что они могут ингибировать проникновение клеток Th3 в кожные поражения и тем самым уменьшение кожных покровов воспаление. Дальнейшее исследование механизма, с помощью которого COEE ингибирует высвобождение этих хемокинов Th3 может дать понимание полезно при разработке целевых методов лечения AD. Тем не мение, дополнительные исследования с использованием моделей воспаления кожи in vivo необходимы для поддержки потенциала COEE в клинической лечение AD.
Благодарности
Не применимо.
Финансирование
Настоящее исследование было поддержано Bio & Программа развития медицинских технологий национального исследования Foundation (NRF) и финансируется правительством Кореи (MSIT; грант). нет. NRF-2016K1A1A8A01
5) и Корейский научно-исследовательский институт Инициативная программа исследований в области бионауки и биотехнологии Республика Корея (грант № KGM5521911). Авторы благодарят Национальный институт биоразнообразия и заповедник Темписк для подготовка растительного сырья.
Наличие данных и материалов
Проанализированные наборы данных, сгенерированные в ходе исследования: можно получить у соответствующего автора при разумном запрос.
Вклад авторов
HSL и JWP проанализировали данные и написали рукопись. OKK, YL, JHK, SYK, NZ и KR подготовили Cedrela odorata L., проанализировал и отредактировал рукопись. СК, СРО и KSA разработала исследование и отредактировала рукопись. Все авторы критически отредактировали статью и одобрили окончательную версию рукописи.
Одобрение этических норм и согласие на участвовать
Не применимо.
Согласие пациента на публикацию
Не применимо.
Конкурирующие интересы
Авторы заявляют, что у них нет конкурирующих интересы.
Список литературы
1 | Эльбадави Х.М., Бортвик Ф., Райт С., Мартин PE и Graham A: Цитозольный StAR-связанный домен переноса липидов 4 (STARD4) белок влияет на липидный фенотип кератиноцитов и статус дифференциации.Br J Dermatol. 164: 628–632. 2011.PubMed / NCBI |
2 | Хонг SW, Чой Э.Б., Мин Т.К., Ким Дж.Х., Ким М.Х., Jeon SG, Lee BJ, Gho YS, Jee YK, Pyun BY и Kim YK: важные роль α-гемолизина во внеклеточных пузырьках на развитие атопический дерматит, вызванный Staphylococcus aureus. PLoS One. 9: e10049 |
3 | Эльмария С.Б. и Лернер Э.А.: пропавшие без вести связь между зудом и воспалением при атопическом дерматите.Клетка. 155: 267–269. 2013. Просмотр статьи: Google Scholar: PubMed / NCBI |
4 | Fuhlbrigge RC, Kieffer JD, Armerding D и Куппер Т.С.: Кожный лимфоцитарный антиген представляет собой специализированную форму PSGL-1 экспрессируется на Т-клетках, возвращающихся к коже. Природа. 389: 978–981. 1997 г. Просмотр статьи: Google Scholar: PubMed / NCBI |
5 | Богуневич М. и Люн Д. Я.: атопический дерматит: заболевание, связанное с изменением кожного барьера и иммунитета. нарушение регуляции.Immunol Rev. 242: 233–246. 2011. Просмотр статьи: Google Scholar: PubMed / NCBI |
6 | Оёши МК, Хе Р, Кумар Л., Юн Дж и Геха RS: Клеточные и молекулярные механизмы при атопическом дерматите. Adv Иммунол. 102: 135–226. 2009. Просмотр статьи: Google Scholar: PubMed / NCBI |
7 | Ou LS и Huang JL: Сотовые аспекты атопический дерматит. Clin Rev Allergy Immunol. 33: 191–198.2007 г. Просмотр статьи: Google Scholar: PubMed / NCBI |
8 | Ли К., Лассе С., Ли П., Накасаки М., Чен С.В., Ямасаки К., Галло Р.Л. и Джамора К. Развитие атопического дерматитоподобное кожное заболевание, вызванное хронической потерей эпидермиса. каспаза-8. Proc Natl Acad Sci USA. 107: 22249–22254. 2010 г. Просмотр статьи: Google Scholar: PubMed / NCBI |
9 | Metral E, Bechetoille N, Demarne F, Damour O и Rachidi W: стволовые клетки кератиноцитов более устойчивы к УФА радиации, чем их прямое потомство.PLoS One. 13: e02038632018. Просмотр статьи: Google Scholar: PubMed / NCBI |
10 | Оразизаде М, Хашемитабар М, Бахрамзаде S, Dehbashi FN и Saremy S: Сравнение ферментативной и методы эксплантата для культивирования кератиноцитов, выделенных из крайняя плоть человека. Биомед Реп. 3: 304–308. 2015. Просмотр статьи: Google Scholar: PubMed / NCBI |
11 | Ци XF, Ким DH, Юн И.С., Ли Дж.Х., Джин Ди, Тэн YC, Kim SK и Lee KJ: флувастатин подавляет экспрессию хемокин MDC / CCL22, индуцированный гамма-интерфероном в клетках HaCaT, a линия клеток кератиноцитов человека.Br J Pharmacol. 157: 1441–1450. 2009 г. Просмотр статьи: Google Scholar: PubMed / NCBI |
12 | Уилсон С.Р., Те Л., Батиа Л.М., Битти К., Катиба Г.Е., Макклейн С.П., Пеллегрино М., Эстандиан Д.М. и Баутиста Д.М. Цитокин атопического дерматита TSLP, полученный из эпителиальных клеток активирует нейроны, чтобы вызвать зуд. Клетка. 155: 285–295. 2013. Просмотр статьи: Google Scholar: PubMed / NCBI |
13 | Хирата Х, Арима М, Ченг Дж, Хонда К, Фукусима Ф., Ёсида Н., Эда Ф. и Фукуда Т .: Производство TARC и MDC с помощью наивных Т-клеток у пациентов с астмой.J Clin Immunol. 23: 34–45. 2003. Просмотр статьи: Google Scholar: PubMed / NCBI |
14 | Инь С., О’Коннор Б., Ратофф Дж., Мэн К., Маллетт К., Кузинс Д., Робинсон Д., Чжан Дж., Чжао Дж., Ли Т.Х. и Корриган C: экспрессия тимического стромального лимфопоэтина увеличивается в астматических дыхательных путей и коррелирует с экспрессией Th3-привлекающих хемокины и тяжесть заболевания. J Immunol. 174: 8183–8190. 2005 г. Просмотр статьи: Google Scholar: PubMed / NCBI |
15 | Лю Ю.Дж .: Лимфопоэтин стромы тимуса: Главный выключатель при аллергическом воспалении.J Exp Med. 203: 269–273. 2006. Просмотр статьи: Google Scholar: PubMed / NCBI |
16 | Лейва-Кастильо Дж. М., Хенер П., Цзян Х. и Ли M: TSLP, продуцируемый кератиноцитами, способствует сенсибилизации аллергенов через кожу и тем самым запускает атопический марш у мышей. J Invest Дерматол. 133: 154–163. 2013. Просмотр статьи: Google Scholar: PubMed / NCBI |
17 | Вейтч NC, Райт Г.А. и Стивенсон ПК: Четыре новых тетранортритерпеноида из Cedrela odorata, связанные с отторжение листьев exopthalmus jekelianus.J Nat Prod. 62: 1260–1263. 1999. Просмотр статьи: Google Scholar: PubMed / NCBI |
18 | Наварро К., Уорд С. и Эрнандес М. дерево Cedrela odorata (Meliaceae): морфологически подразделенный виды в Коста-Рике. Rev Biol Trop. 50: 21–29. 2002. PubMed / NCBI |
19 | Thu PQ, Quang DN и Dell B: угроза для кедр, Cedrela odorata, плантации во Вьетнаме долгоносиком, Aclees sp.J Insect Sci. 10: 10. Просмотр статьи: Google Scholar: PubMed / NCBI |
20 | Миллан-Ороско Л., Корредойра Э и Сан-Хосе Mdel C: ризогенез in vitro: гистоанатомия Cedrela odorata (Meliaceae) микрочеренки. Rev Biol Trop. 59: 447–453. 2011.PubMed / NCBI |
21 | Wu WB, Zhang H, Dong SH, Sheng L, Wu Y, Li Дж. И Юэ Дж. М.: Новые тритерпеноиды с протеинтирозинфосфатазой 1B ингибирование от Cedrela odorata.J Asian Nat Prod Res. 16: 709–716. 2014. Просмотр статьи: Google Scholar: PubMed / NCBI |
22 | Пак Дж. У., Квон ОК, Юниато П., Марвото Б., Lee J, Oh SR, Kim JH и Ahn KS: улучшение вызванного LPS воспалительная реакция с использованием метанольного экстракта лагерстроемии ovalifolia для подавления активации NF-κB в RAW264.7 макрофаги. Int J Mol Med. 38: 482–490. 2016. Просмотреть статью: Google Scholar: PubMed / NCBI |
23 | Чой Дж.Х., Джин С.В., Пак Б.Х., Ким Х.Г., Ханал Т, Хан Х.Дж., Хван Ю.П., Чой Дж.М., Чунг Ю.К., Хван С.К. и др.: Культивированные. женьшень ингибирует 2,4-динитрохлорбензол-индуцированный атопический дерматитоподобные поражения кожи у мышей NC / Nga и индуцированные TNF-α / IFN-γ Активация TARC в клетках HaCaT.Food Chem Toxicol. 56: 195–203. 2013. Просмотр статьи: Google Scholar: PubMed / NCBI |
24 | Jung MR, Lee TH, Bang MH, Kim H, Son Y, Chung DK и Kim J: Подавление тимуса и активация регулируются хемокин (TARC / CCL17) производства 3-O-β-D-глюкопианозилспинастерин посредством блокирования NF-κB и STAT1 сигнальные пути в кератиноцитах HaCaT, индуцированных TNF-α и IFN-γ. Biochem Biophys Res Commun. 427: 236–241. 2012. Просмотр статьи: Google Scholar: PubMed / NCBI |
25 | Лоуренс Т .: Ядерный фактор NF-kappaB путь в воспаление.Cold Spring Harb Perspect Biol. 1: a0016512009. Просмотр статьи: Google Scholar: PubMed / NCBI |
26 | Стриксон С., Кэмпбелл Д.Г., Эммерих СН, Кнебель А., Плятер Л., Риторто М. С., Шпиро Н. и Коэн П. противовоспалительный препарат BAY 11-7082 подавляет MyD88-зависимый сигнальная сеть, нацеленная на убиквитиновую систему. Биохим Дж. 451: 427–437. 2013. Просмотр статьи: Google Scholar: PubMed / NCBI |
27 | Вурхиз Т., Чанг Дж., Яо Й, Каплан М. Х., Chang CH и Travers JB: Дендритные клетки производят воспалительные процессы. цитокины в ответ на бактериальные продукты из стафилококка aureus-инфицированные поражения атопического дерматита.Cell Immunol. 267: 17–22. 2011. Просмотр статьи: Google Scholar: PubMed / NCBI |
28 | Megna M, Napolitano M, Patruno C, Виллани A, Balato A, Monfrecola G, Ayala F и Balato N: Системное лечение атопического дерматита у взрослых: обзор. Дерматол Тер (Heidelb). 7: 1–23. 2017. Просмотр статьи: Google Scholar: PubMed / NCBI |
29 | Ли Дж. У., Пак Ха, Квон ОК, Пак Дж. У., Ли Дж., Lee HJ, Lee SJ, Oh SR и Ahn KS: NPS 2143, отборный антагонист кальций-чувствительных рецепторов подавляет воспаление легких, вызванное липополисахаридами.Мол Иммунол. 90: 150–157. 2017. Просмотр статьи: Google Scholar: PubMed / NCBI |
30 | Какинума Т., Накамура К., Вакугава М., Мицуи H, Tada Y, Saeki H, Torii H, Asahina A, Onai N, Matsushima K и Tamaki K: Тимус и регулируемый активацией хемокин при атопии. дерматит: сывороточный тимус и регулируемый активацией уровень хемокинов тесно связано с активностью болезни. J Allergy Clin Immunol. 107: 535–541. 2001. Просмотр статьи: Google Scholar: PubMed / NCBI |
31 | Пак Дж. У., Шин ИС, Ха УХ, О СР, Ким Дж. Х и Ан К.С.: Патофизиологические изменения, вызванные Pseudomonas aeruginosa вовлечены в активацию MMP-12 и MMP-13 в эпителиальных клетках карциномы человека и мышиной модели пневмонии.Заражение иммунной. 83: 4791–4799. 2015. Просмотр статьи: Google Scholar: PubMed / NCBI |
32 | Лим С.Дж., Ким М., Рэнди А., Нам ЭДЖ и Нхо CW: Эффекты Hovenia dulcis Thunb. экстракт и метилванилат на поражения кожи, подобные атопическому дерматиту, и индуцированные TNF-α / IFN-γ продукция хемокинов в клетках HaCaT. J Pharm Pharmacol. 68: 1465–1479. 2016. Просмотреть статью: Google Scholar: PubMed / NCBI |
33 | Пак Дж. У., Ли Х. С., Лим И, Квон ОК, Ким Дж. Х, Paryanto I, Yunianto P, Choi S, Oh SR и Ahn KS: Рододендрон Альбом Блюм ингибирует TNF-α / IFN-γ-индуцированный хемокин продукции посредством блокады активации NF-κB и JAK / STAT у человека. эпидермальные кератиноциты.Int J Mol Med. 41: 3642–3652. 2018.PubMed / NCBI |
34 | Пак Дж. У., Квон ОК, Ким Дж. Х., О СР, Ким Дж. Х., Пайк Дж. Х., Марвото Б., Виджхати Р., Джуниарти Ф., Ираван Д. и Ан К. С.: Альбом рододендрона Blume подавляет экспрессию iNOS и COX-2 в LPS-стимулированные клетки RAW264.7 посредством подавления NF-κB сигнализация. Int J Mol Med. 35: 987–994. 2015. Просмотр статьи: Google Scholar: PubMed / NCBI |
35 | Пак Дж. У., Ли IC, Шин Н. Р., Чон СМ, Квон ОК, Ко Дж. У., Ким Дж. Си, О СР, Шин И.С. и Ан К.С.: Оксид меди наночастицы усугубляют воспаление дыхательных путей и выработку слизи в астматические мыши с помощью передачи сигналов MAPK.Нанотоксикология. 10: 445–452. 2016. Просмотреть статью: Google Scholar: PubMed / NCBI |
36 | Чой Дж. К. и Ким Ш.: Тормозящее действие галангин при поражениях кожи, подобных атопическому дерматиту. Food Chem Toxicol. 68: 135–141. 2014. Просмотр статьи: Google Scholar: PubMed / NCBI |
37 | Ян Дж.Х., Ю Дж.М., Чо В.К. и Ма Джи: Противовоспалительное действие водного экстракта Sanguisorbae Radix на подавление дегрануляции тучных клеток и STAT-1 / Jak-2 активация в BMMC и кератиноцитах HaCaT.BMC Дополнение Альтернатива Med. 16: 3472016. Просмотр статьи: Google Scholar: PubMed / NCBI |
38 | Квон DJ, Пэ И.С., Джу С.М., Го А.Р., Юн Г.С., Choi SY и Park J: Казуаринин подавляет TARC / CCL17 и MDC / CCL22 продукция посредством блокирования активации NF-κB и STAT1 в HaCaT клетки. Biochem Biophys Res Commun. 417: 1254–1259. 2012. Просмотр статьи: Google Scholar: PubMed / NCBI |
39 | Накаяма Т., Хиэшима К., Нагакубо Д., Сато E, Nakayama M, Kawa K и Yoshie O: Селективная индукция Th3-привлекающие хемокины CCL17 и CCL22 в В-клетках человека путем латентный мембранный белок 1 вируса Эпштейна-Барра.J Virol. 78: 1665–1674. 2004. Просмотр статьи: Google Scholar: PubMed / NCBI |
Набор для ELISA гамма IFN человека (ab174443)
Обзор
Название продукта
Метод обнаружения
Колориметрический
точность
Интра-анализ Образец п Среднее значение SD CV% Всего 5 1.1% Промежуточный анализ Образец п Среднее значение SD CV% Всего 3 7.9% Тип образца
Супернатант клеточной культуры, сыворотка, плазма
Тип анализа
Сэндвич (количественный)
Чувствительность
470 пг / мл
Диапазон
0.468 нг / мл — 30 нг / мл
Восстановление
Извлечение по конкретному образцу Тип образца Среднее% Диапазон Сыворотка 102 98% — 104% Среда для культивирования клеток 86 77% — 93% Плазма гепатита 244 197% — 298% Плазма ЭДТА 122 117% — 124% Плазма Cit 107 96% — 115% Время анализа
1 ч. 30м
Продолжительность анализа
Одностадийный анализ
Реактивность видов
Реагирует с: Человек
Обзор продукции
Набор для ИФН-гамма-ИФН человека (ab174443) представляет собой 90-минутный сэндвич-ИФА с однократной промывкой, разработанный для количественного измерения ИФН-гамма-белка в надосадочной жидкости культуры клеток человека, образцах плазмы и сыворотки.Он использует нашу запатентованную технологию SimpleStep ELISA®. Определите количество гамма-интерферона человека с чувствительностью 470 пг / мл.
Технология SimpleStep ELISA® использует захватывающие антитела, конъюгированные с аффинной меткой, которая распознается моноклональным антителом, используемым для покрытия наших планшетов SimpleStep ELISA®. Такой подход к сэндвич-ELISA позволяет формировать сэндвич-комплекс антитело-аналит за один этап, что значительно сокращает время анализа. Дополнительные сведения см. В сводке протокола SimpleStep ELISA® в разделе изображений.Наша технология SimpleStep ELISA® обеспечивает несколько преимуществ:
— Протокол однократной промывки сокращает время анализа до 90 минут или менее
— Высокая чувствительность, специфичность и воспроизводимость по превосходным антителам
— Полностью подтверждена на биологических образцах
— Планшет с 96 лунками, разбиваемый на Стрипы 12 x 8 лунок384-луночный микропланшет SimpleStep ELISA® (ab203359) можно использовать в качестве альтернативы 96-луночному микропланшету, поставляемому с наборами SimpeStep ELISA®.
СПЕЦИФИЧНОСТЬ АНАЛИЗА
Этот набор распознает как нативный, так и рекомбинантный человеческий гамма-белок интерферон только в образцах сыворотки, плазмы и супернатанта клеточной культуры.
Образцы мочи, молока, экстрактов клеток и тканей не тестировались с помощью этого набора.
ПОМЕХИ ПРИ АНАЛИЗЕ
Этот набор несовместим с образцами плазмы (гепарин).
Банкноты
IFN гамма (IFNG) продуцируется лимфоцитами, активируемыми специфическими антигенами или митогенами.IFN гамма, помимо противовирусной активности, выполняет важные иммунорегуляторные функции. Это мощный активатор макрофагов, он оказывает антипролиферативное действие на трансформированные клетки и может усиливать противовирусные и противоопухолевые эффекты интерферонов типа I.
Платформа
Микропланшет
Недвижимость
Инструкции по хранению
Хранить при + 4 ° C.См. Протоколы.
Компоненты 1 x 96 тестов 10X захватывающее антитело IFNG человека 1 x 600 мкл 10X антитело детектора IFNG человека 1 x 600 мкл 10X Промывочный буфер PT (ab206977) 1 x 20 мл Разбавитель антител CPI — Блокатор HAMA (ab1) 1 x 6 мл Лиофилизированный рекомбинантный белок IFNG человека 2 флакона Пластинчатые уплотнения 1 шт. Разбавитель образца NBP 1 x 20 мл Разбавитель образца NS (ab1 )
1 x 12 мл 96-луночный микропланшет SimpleStep с предварительно нанесенным покрытием (ab206978) 1 шт. Стоп-раствор 1 x 12 мл Раствор для разработки TMB 1 x 12 мл Направления исследований
Функция
Производится лимфоцитами, активированными специфическими антигенами или митогенами.IFN-гамма, помимо противовирусной активности, выполняет важные иммунорегуляторные функции. Это мощный активатор макрофагов, он оказывает антипролиферативное действие на трансформированные клетки и может усиливать противовирусные и противоопухолевые эффекты интерферонов типа I.
Тканевая специфичность
Высвобождается в основном из активированных Т-лимфоцитов.
Участие в болезни
У европейцев генетическая изменчивость IFNG связана с риском апластической анемии (АА) [MIM: 609135].АК — редкое заболевание, при котором уменьшение количества циркулирующих клеток крови происходит в результате повреждения пула стволовых клеток в костном мозге. У большинства пациентов поражение стволовых клеток вызвано аутоиммунной атакой. Т-лимфоциты, активируемые эндогенным или экзогенным и чаще всего неизвестным антигенным стимулом, секретируют цитокины, включая IFN-гамма, которые, в свою очередь, способны подавлять кроветворение.
Сходства последовательностей
Принадлежит к семейству интерферонов типа II (или гамма).
Пост-трансляционные
модификацииПротеолитический процессинг вызывает гетерогенность С-конца с белками, оканчивающимися альтернативно Gly-150, Met-157 или Gly-161.
Сотовая локализация
Секретный.
- Информация от UniProt
Альтернативные названия
- IFN гамма
- Иммунный к IFN
- IFN, иммунный
- IFN-гамма
- IFNG
- IFNG_HUMAN
- Иммунный интерферон
- Интерферон гамма
- Интерферон II типа
посмотреть все
Ссылки на базу данных
Изображения
Другое — набор для ИФН гамма-ИФН человека (ab174443)
ТехнологияSimpleStep ELISA позволяет формировать комплекс антитело-антиген за один этап, сокращая время анализа до 90 минут.Добавьте образцы или стандарты и смесь антител в лунки сразу, инкубируйте, промойте и добавьте окончательный субстрат. См. Подробное пошаговое руководство в протоколе.
Пример стандартной кривой IFNG для измерений образцов супернатанта клеточных культур.
Значения данных за вычетом фона (среднее +/- SD) нанесены на график.
Пример стандартной кривой гамма-интерферона человека в разбавителе образца NS (для образцов супернатанта)
Стандартная кривая интерферон-гамма была построена, как описано.Значения исходных данных показаны в таблице. Значения данных за вычетом фона (среднее +/- SD) нанесены на график.
Пример стандартной кривой IFNG для измерений образцов сыворотки / плазмы.
Значения данных за вычетом фона (среднее +/- SD) нанесены на график.
Пример стандартной кривой гамма-интерферона человека в разбавителе образца NBP (для образцов сыворотки / плазмы)
Стандартная кривая интерферон-гамма была построена, как описано.Значения исходных данных показаны в таблице. Значения данных за вычетом фона (среднее +/- SD) нанесены на график.
Сравнение секретируемого IFNG в нестимулированных и PHA-стимулированных PBMC человека.
PBMC выращивали в отсутствие или в присутствии фитогемагглютинина (PHA) в течение 2 дней. Концентрации IFNG измеряли в супернатантах культур клеток, разведенных в 12 и 6 раз, для нестимулированных PBMC и стимулированных PBMC, а также в среде.Значения исходных данных (среднее +/- SD, n = 3) нанесены на график. Пунктирная линия соответствует нулевому фону образца.
Интерполированные концентрации секретируемого IFNG в нестимулированных и PHA-стимулированных PBMC человека.
Концентрации IFNG были интерполированы из значений данных, показанных на рисунке 3, с использованием стандартной кривой IFNG и скорректированы на разбавление образца. Средняя концентрация IFNG составила 1.8 нг / мл в супернатантах нестимулированных PBMC и 177,2 нг / мл в супернатантах стимулированных PBMC.
Линейность разбавления определяется на основе интерполированных значений стандартной кривой. Линейность разбавления определяет интервал концентрации образца, в котором интерполированные целевые концентрации прямо пропорциональны разбавлению образца.
Нативный гамма-интерферон измеряли в образцах супернатанта культуры клеток PBMC, стимулированных PHA, в серии 2-кратных разведений.Разведения образцов производятся в Sample Diluent NS.
Рекомбинантный гамма-интерферон вводили в образцы сыворотки и плазмы человека (цитрат и ЭДТА) и разводили в серии 2-кратных разведений в разбавителе образцов NBP.Чистые объединенные образцы сыворотки и плазмы (ЭДТА и цитрат) от здоровых доноров измеряли в двух экземплярах. Все значения были ниже определяемого диапазона анализа.
Чистую сыворотку от десяти отдельных здоровых доноров мужского и женского пола измеряли в двух экземплярах. Все значения были ниже определяемого диапазона анализа.
Листы данных и документы
SDS скачать
Страна / регион Выберите страну / регион
Язык Выбор языка
Скачать брошюру
Список литературы (6)
ab174443 упоминается в 6 публикациях.
- Wu J et al. lncRNA-CD160 снижает иммунитет CD8 + Т-клеток через эпигенетические механизмы при инфицировании вирусом гепатита B. Oncol Lett 20: 235-247 (2020). PubMed: 32565950
- Шен DD и др. Капсулы Liuweibuqi улучшают легочную функцию при стабильной хронической обструктивной болезни легких с синдромом дефицита ци легких путем регулирования STAT4 / STAT6 и MMP-9 / TIMP-1. Фарм Биол 57: 744-752 (2019). PubMed: 31679431
- Ислам M et al. Значение оси RANTES-CCR5 и связанная иммуномодуляция ниже по течению в патогенезе денге: исследование из Гувахати, Индия. J Med Virol 91: 2066-2073 (2019). PubMed: 31368534
- Qiao HB et al. Эффекты интерлейкина 2 и rAd-p53 при лечении глиобластомы. Mol Med Rep 17: 4853-4859 (2018). PubMed: 245
- Yamamoto M et al. Стадия дакриоаденита и сиаладенита, связанных с IgG4, по среде цитокинов сыворотки. Mod Rheumatol Н / Д: 1-5 (2018).


