Готовность документов о государственной регистрации
До последнего времени единственным способом уточнить степень готовности документов в 46 налоговой инспекции являлась телефонная служба проверки готовности. Телефон службы не умолкает ни на минуту и дозвониться туда, чтобы получить актуальную информацию, довольно сложно. Для вашего удобства был запущен новый уникальный сервис ФНС Готовность к выдаче документов.
Благодаря этому сервису вы имеете возможность не выходя из дома проверить готов ли ваш пакет документов в 46 налоговой инспекции на регистрацию, ликвидацию или реорганизацию фирмы.
ПРОВЕРИТЬ ГОТОВНОСТЬ ДОКУМЕНТОВ К ВЫДАЧЕ
В 46 НАЛОГОВОЙ ИНСПЕКЦИИ
Как осуществляется проверка готовности документов?
Для того, чтобы узнать, готов ли пакет документов в поисковую строку сервиса необходимо ввести номер входящего пакета с документацией. По этому номеру появятся следующие данные:
- Дата подачи пакета документов на оформление в регистрирующем органе.
- Название фирмы или имя ИП.
- Статус готовности пакета документации. Возможны несколько вариантов ответа: не найдено (если документы не были найдены по указанному номеру), в обработке, готовы к выдаче, выданы.
О готовности документов
Готовые в 46 налоговой инспекции документы могут быть выданы не ранее даты, указанной в вашей расписке на получение
Если при обращении к сервису вы не знаете входящий номер указанный на расписке на получение, то воспользуйтесь другим сервисом результат регистрации: вводя название компании, он автоматически подскажет номер пакета.
Если Вы заметили на сайте опечатку или неточность, выделите её |
Инспекция ФНС
Руководитель: Тимофеев Сергей Анатольевич Адрес: 142803, Московская область, г. Ступино, ул. Фрунзе, д. 3, корп. 3 Телефоны: контакт-центр 8-800-222-22-22 приемная +7 (496) 647-05-01 Факс: 7 (496) 642-51-12 Телефон доверия: +7 (496) 647-08-96 E—mail: [email protected] Cайт ФНС России:www.nalog.ru/rn50 |
Способ проезда На электропоезде из Москвы: с Павелецкого вокзала до станции «Ступино» или на автобусе из Москвы: от автостанции «Красногвардейская» (метро «Красногвардейская») автобусом «Москва — Ступино» до автостанции «Ступино», в г. Ступино автобусные остановки «Черемушки», «Бульвар Победы» и «Новый рынок» Инспекция на карте и сайте | График работы инспекции:
Пятница Перерыв на обед | График приема налогоплательщиков физических лиц для приема и выдачи документов и консультирования (окна №№ 1-8 в операционном зале ИФНС России по г. Ступино) Понедельник, среда с 9.00 до 18.00  nalog.ru/rn50/ifns/imns_50_45/#t2 nalog.ru/rn50/ifns/imns_50_45/#t2Без обеденного перерыва Онлайн запись на прием в инспекцию |
|---|
Заплатил налоги сам — подумай о тех, с кем планируешь отдых
В разгар отпусков гражданам, не исполнившим налоговые обязательства по полученным в прошлом году уведомлениям, стоит позаботиться о погашении задолженности перед государством. Тем, кто вовремя не исполнил требования налоговых органов, надо быть морально готовыми к возможным изменениям летних планов на отдых — при наличии налоговой задолженности судебный пристав вправе ограничить выезд должника за пределы Российской Федерации. Напомнить об уплате налогов стоит и тому, с кем планируется отдых. (Подробнее…)
В связи с наступлением отпускного периода ИФНС России по г. Ступино Московской области призывает налогоплательщиков, имеющих задолженность по налогам, срочно ее уплатить. Налоговые органы уже начали процедуру принудительного взыскания задолженности по имущественным налогам. (Подробнее…)
Телефоны отделов инспекции:
Контрольный отдел — 8 (496) 647-07-41; 647-07-38; 647-36-62
Отдел аналитической работы и расчетов с бюджетом — 8 (496) 647-07-35; 647-07-37
Отдел информационных технологий — 8 (496) 647-05-03
Отдел камеральных проверок № 1 — 8 (496) 647-08-97; 647-07-28; 647-07-46
Отдел камеральных проверок № 2 — 8 (496) 647-07-43; 647-07-44; 647-37-47
Отдел камеральных проверок № 3 — 8 (496) 647-07-33; 647-04-99
Отдел обеспечения процедур банкротства — 8 (496) 647-07-29
Отдел общего обеспечения — 8 (496) 647-07-32; 647-07-36
Отдел предпроверочного анализа и истребования документов — 8 (496) 647-09-01; 647-07-39
Отдел работы с налогоплательщиками — 8 (496) 647-07-34; 647-00-07; 647-08-08
Отдел регистрации и учета налогоплательщиков — 8 (496) 649-02-09
Отдел урегулирования задолженности — 8 (496) 647-07-40; 647-07-45
Отдел финансового обеспечения — 8 (496) 647-07-48; 647-07-25
Правовой отдел — 8 (496) 647-07-39
Реквизиты
Получатель платежа: Управление федерального казначейства по Московской области (ИФНС России по г. Ступино Московской области)
Ступино Московской области)
ИНН — 5045005336 КПП — 504501001
Банк получателя платежа: ГУ БАНКА РОССИИ ПО ЦФО//УФК по Московской области, г. Москве
БИК— 004525987
Единый казначейский счёт: 40102810845370000004
Номер счета получателя средств: 03100643000000014800
ОКТМО: 46776000
Проверка чека — СБИС ОФД
Проверка чека — СБИС ОФД Используя официальный сайт sbis.ru, вы даете согласие на работу с cookie, Яндекс.Метрикой, Google Analytics для сбора технических данных. Подробнее
- 77 Москва
- 78 Санкт-Петербург
- 01 Республика Адыгея
- 02 Республика Башкортостан
- 03 Республика Бурятия
- 04 Республика Алтай
- 05 Республика Дагестан
- 06 Республика Ингушетия
- 07 Респ. Кабардино-Балкария
- 08 Республика Калмыкия
- 09 Респ.
 Карачаево-Черкессия
Карачаево-Черкессия - 10 Республика Карелия
- 11 Республика Коми
- 12 Республика Марий Эл
- 13 Республика Мордовия
- 14 Республика Саха (Якутия)
- 15 Северная Осетия — Алания
- 16 Республика Татарстан
- 17 Республика Тыва
- 18 Республика Удмуртия
- 19 Республика Хакасия
- 20 Республика Чечня
- 21 Республика Чувашия
- 22 Алтайский край
- 23 Краснодарский край
- 24 Красноярский край
- 25 Приморский край
- 26 Ставропольский край
- 27 Хабаровский край
- 28 Амурская обл.

- 29 Архангельская обл.
- 30 Астраханская обл.
- 31 Белгородская обл.
- 32 Брянская обл.
- 33 Владимирская обл.
- 34 Волгоградская обл.
- 35 Вологодская обл.
- 36 Воронежская обл.
- 37 Ивановская обл.
- 38 Иркутская обл.
- 39 Калининградская обл.
- 40 Калужская обл.
- 41 Камчатский край
- 42 Кемеровская обл.
- 43 Кировская обл.
- 44 Костромская обл.
- 45 Курганская обл.
- 46 Курская обл.
- 47 Ленинградская обл.

- 48 Липецкая обл.
- 49 Магаданская обл.
- 50 Московская обл.
- 51 Мурманская обл.
- 52 Нижегородская обл.
- 53 Новгородская обл.
- 54 Новосибирская обл.
- 55 Омская обл.
- 56 Оренбургская обл.
- 57 Орловская обл.
- 58 Пензенская обл.
- 59 Пермский край
- 60 Псковская обл.
- 61 Ростовская обл.
- 62 Рязанская обл.
- 63 Самарская обл.
- 63 Тольятти
- 64 Саратовская обл.
- 65 Сахалинская обл.

- 66 Свердловская обл.
- 67 Смоленская обл.
- 68 Тамбовская обл.
- 69 Тверская обл.
- 70 Томская обл.
- 71 Тульская обл.
- 72 Тюменская обл.
- 73 Ульяновская обл.
- 74 Челябинская обл.
- 75 Забайкальский край
- 76 Ярославская обл.
- 79 Еврейская АО
- 83 Ненецкий АО
- 86 Ханты-Мансийский АО
- 87 Чукотский АО
- 89 Ямало-Ненецкий АО
- 91 Республика Крым
- 92 Севастополь
Налоговая инспекция Самарская область Самара (Промышленный район)
Информация об отделе налоговой:
Инспекция Федеральной налоговой службы по Промышленному району г. Самары
Самары
Начальник отдела: Супрун Тамара Романовна
бесплатный номер: 8-800-222-2222
Код ИФНС — 6319
ИНН — 6319061778
КПП — 631901001
Почтовый индекс — 443035
Режим работы:
- Пн. — Чт. 9.00-18:00
- Пт. 9.00-16:45
Личный кабинет налогоплательщика
Всю информацию можно получить только в вашем личном кабинете. Именно там можно узнать налоговую задолженность, узнать свой ИНН, запросить выписку из ЕГРЮЛ, получить выписку ЕГРИП, узнать налог. Данные услуги предоставляются бесплатно и вам достаточно иметь при себе паспорт. Услуги оказываются как юридическим, так и физическим лицам. Просто перейдите по ссылке ниже:
https://lkfl.nalog.ru/lk/
Работа
В настоящее время, открытых вакансий в налоговой службе города Самара нет, но вы можете позвонить нам и оставить ваше резюме.
Список отделов:
Отдел учета налогоплательщиков
Телефон: +7 (846) 933-83-64, 933-83-65
Кабинет: 16
Отдел работы с налогоплательщиками
Телефон: +7 (846) 933-83-85
Начальник: Белоножкина Светлана Борисовна
Кабинет: 37
Отдел камеральных проверок №2
Телефон: +7 (846) 933-83-59
Отдел урегулирования задолженности №1
Телефон: +7 (846) 933-83-89
Отдел общего и хозяйственного обеспечения
Телефон: +7 (846) 933-83-76
Отдел финансового обеспечения
Телефон: +7 (846) 933-83-96
Отдел кадров и безопасности
Телефон: +7 (846) 933-83-70
Юридический отдел
Телефон: +7 (846) 933-83-98
Отдел досудебного аудита
Телефон: +7 (846) 933-83-66
Отдел информационных технологий
Телефон: +7 (846) 933-83-69
Отдел обработки данных
Телефон: +7 (846) 933-83-72
Аналитический отдел
Телефон: +7 (846) 933-83-50
Отдел камеральных проверок №1
Телефон: +7 (846) 933-83-52
Отдел предпроверочного анализа и истребования документов
Телефон: +7 (846) 933-83-67
Отдел выездных проверок
Телефон: +7 (846) 933-83-61
Отдел оперативного контроля
Телефон: +7 (846) 933-83-80
Отдел обеспечения процедур банкротства
Отдел урегулирования задолженности №2
Налоговая инспекция Красногвардейского района Санкт-Петербурга
Сообщить об ошибке
Информация о проблеме
| Полное наименование: | Межрайонная инспекция Федеральной налоговой службы России № 21 по Санкт-Петербургу |
| Сокращенное наименование: | МИФНС РФ № 21 |
| Район: | Красногвардейский |
| Официальный сайт: | http://www.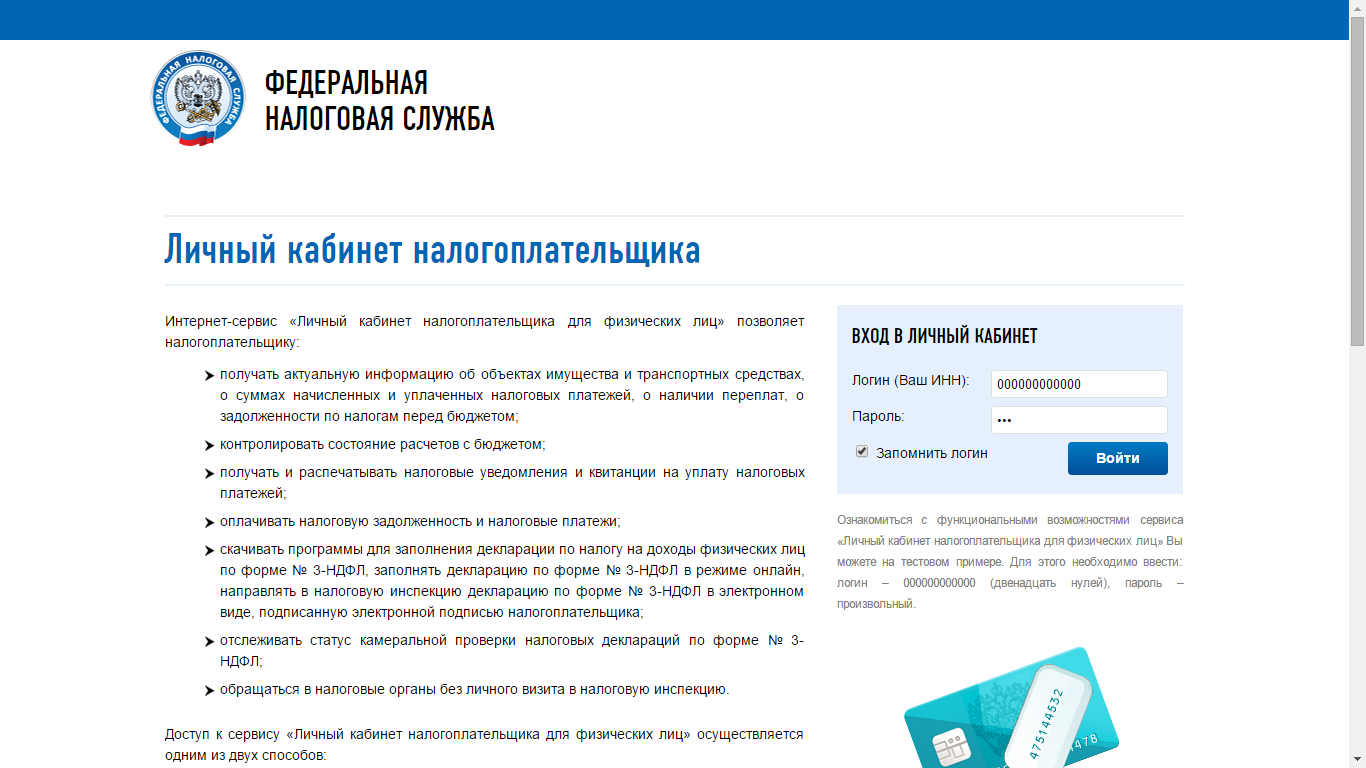 nalog.ru nalog.ru |
| E-mail: | e-mail отсутствует |
| Телефон: | 8 (800) 222-22-22 (контакт-центр) +7 (812) 335-46-01 (приемная) +7 (812) 222-25-93 (справочная служба) |
| Руководитель: | Андросова Наталья Александровна |
| Адрес: | Санкт-Петербург, Большая Пороховская улица, 12/34 |
| Метро: | Новочеркасская (3162 м) |
|
инспекция понедельник-четверг: с 09:00 до 18:00 пятница: с 09:00 до 16:45 операционный зал понедельник, среда: с 09:00 до 18:00 вторник, четверг: с 09:00 до 20:00 пятница: с 09:00 до 16:45 |
|
| Информация: |
Миссия ФНС России — эффективная контрольно-надзорная деятельность и высокое качество предоставляемых услуг для законного, прозрачного и комфортного ведения бизнеса, обеспечения соблюдения прав налогоплательщиков и формирования финансовой основы деятельности государства. ОСНОВНЫЕ НАПРАВЛЕНИЯ ДЕЯТЕЛЬНОСТИ ФЕДЕРАЛЬНОЙ НАЛОГОВОЙ СЛУЖБЫ
|
показать на карте
К сожалению, фотографий нет, но вы можете их добавить!
Госуслуги рядом
Краснодонская улица, 14 (0.35 км)
улица Тарасова, 9 (0. 48 км)
48 км)
проспект Металлистов, 34 (0.48 км)
Среднеохтинский проспект, 50 (0.52 км)
Синявинская улица, 8 (0.52 км)
Отзывы
Добавить
показать остальные 48
Семейство интерферонов (IFN) — Creative Diagnostics
Обзор
Интерфероны (IFN) представляют собой группу сигнальных белков, производимых и высвобождаемых клетками-хозяевами в ответ на присутствие нескольких патогенов, таких как вирусы, бактерии, паразиты и опухолевые клетки. В типичном сценарии инфицированная вирусом клетка выделяет интерфероны, заставляя соседние клетки повышать свою противовирусную защиту.
IFN относятся к большому классу белков, известных как цитокины / молекулы, которые используются для связи между клетками, чтобы запустить защитные механизмы иммунной системы, которые помогают уничтожить патогены.Интерфероны названы из-за их способности «мешать» репликации вирусов, защищая клетки от вирусных инфекций. IFN также имеют различные другие функции: они активируют иммунные клетки, такие как естественные клетки-киллеры и макрофаги; они повышают защиту хозяина за счет активации презентации антигена за счет увеличения экспрессии антигенов главного комплекса гистосовместимости (MHC). Некоторые симптомы инфекций, такие как лихорадка, мышечная боль и «симптомы гриппа», также вызваны выработкой IFNs и других цитокинов.
Члены IFN
У животных, включая человека, идентифицировано более двадцати различных генов и белков IFN. Их обычно делят на три класса: IFN типа I, IFN типа II и IFN типа III. IFN, принадлежащие ко всем трем классам, важны для борьбы с вирусными инфекциями и для регуляции иммунной системы.
Таблица 1. Продукты, относящиеся к семейству IFN
Все IFN типа I связываются со специфическим рецепторным комплексом клеточной поверхности, известным как рецептор IFN-α / β (IFNAR), который состоит из цепей IFNAR1 и IFNAR2. Интерфероны типа I, присутствующие в организме человека, представляют собой IFN-α, IFN-β, IFN-ε, IFN-κ и IFN-ω.
Интерфероны типа I, присутствующие в организме человека, представляют собой IFN-α, IFN-β, IFN-ε, IFN-κ и IFN-ω.
Рисунок 1. Трехмерная структура человеческого интерферона бета.
| IFN-α | Белки IFN-α продуцируются лейкоцитами. Они в основном участвуют в врожденном иммунном ответе против вирусной инфекции. Гены, ответственные за их синтез, делятся на 13 подтипов, которые называются IFNA1, IFNA2, IFNA4, IFNA5, IFNA6, IFNA7, IFNA8, IFNA10, IFNA13, IFNA14, IFNA16, IFNA17, IFNA21.Эти гены находятся вместе в кластере на хромосоме 9. IFN-α также производится синтетически в качестве лекарства от лейкемии волосатых клеток. Международное непатентованное название (МНН) продукта — интерферон альфа. Рекомбинантный тип — интерферон альфакон-1. Пегилированные типы представляют собой пегилированный интерферон альфа-2a и пегилированный интерферон альфа-2b. |
| IFN-β | Белки IFN-β в больших количествах продуцируются фибробластами.Они обладают противовирусной активностью, которая участвует в основном в врожденном иммунном ответе. Были описаны два типа IFN-β: IFN-β1 (IFNB1) и IFN-β3 (IFNB3) (ген, обозначенный IFN-β2, на самом деле является IL-6). IFN-β1 используется для лечения рассеянного склероза, поскольку он снижает частоту рецидивов. IFN-β1 не подходит для лечения пациентов с прогрессирующими, не рецидивирующими формами рассеянного склероза. |
| IFN-κ | Интерферон каппа, также известный как IFN-каппа, представляет собой белок, который у человека кодируется геном IFNK.IFN-каппа является членом семейства интерферонов типа I. Интерфероны типа I представляют собой группу родственных гликопротеинов, которые играют важную роль в защите хозяина от вирусных инфекций. Этот белок экспрессируется в кератиноцитах, и ген находится на хромосоме 9, рядом с кластером интерферона типа I. |
| IFN-ω | IFN-ω, хотя и имеет только одну функциональную форму, описанную на сегодняшний день (IFNW1), имеет несколько псевдогенов: IFNWP2, IFNWP4, IFNWP5, IFNWP9, IFNWP15, IFNWP18 и IFNWP19 у человека. Многие плацентарные млекопитающие, не являющиеся приматами, экспрессируют несколько подтипов IFN-ω. Многие плацентарные млекопитающие, не являющиеся приматами, экспрессируют несколько подтипов IFN-ω. |
Единственный член составляет интерфероны типа II (IFN), которые называются IFN-γ (гамма). Зрелый IFN-γ представляет собой антипараллельный гомодимер, который связывается с комплексом рецептора IFN-γ (IFNGR), чтобы вызвать сигнал в своей клетке-мишени. IFNGR состоит из двух субъединиц, и каждая из молекул обозначает IFNGR1 и IFNGR2.
IFN-γ участвует в регуляции иммунных и воспалительных реакций; у человека есть только один тип гамма-интерферона.Он вырабатывается активированными Т-клетками и естественными клетками-киллерами. IFN-γ обладает некоторыми противовирусными и противоопухолевыми эффектами, но, как правило, слабыми. Однако этот цитокин усиливает действие IFN типа I. IFN-γ, выделяемый клетками Th2, привлекает лейкоциты к месту инфекции, что приводит к усилению воспаления. Он также стимулирует макрофаги убивать бактерии, которые были поглощены. IFN-γ, выделяемый клетками Th2, также важен для регуляции ответа Th3. Поскольку IFN-γ жизненно важен для регуляции иммунного ответа, его продукция может приводить к аутоиммунным нарушениям.
Рисунок 2. Трехмерная структура гамма-интерферона человека.
Группа интерферонов III типа, классифицированная недавно, состоит из трех молекул IFN-λ (лямбда), называемых IFN-λ1, IFN-λ2 и IFN-λ3 (также называемых IL29, IL28A и IL28B соответственно). Эти сигналы IFN через рецепторный комплекс состоят из IL10R2 (также называемого CRF2-4) и IL28RA (также называемого IFNLR1, CRF2-12). Недавно новый белок со сходной функцией, связанный с IFN-λ3, был обнаружен в том же геномном локусе и был обозначен как IFN-λ4.Его внутриклеточная передача сигналов осуществляется через IFNLR1 и, следовательно, считается интерфероном типа III. Однако доказательства его биологической активности in vivo все еще остаются спорными.
IL29 | Интерлейкин-29 (IL-29) представляет собой белок, который у человека кодируется геном IL29, который находится на хромосоме 19. Он является членом семейства спиральных цитокинов и представляет собой интерферон III типа.Он также известен как IFNλ1 и очень похож по аминокислотной последовательности на IL-28, другой интерферон типа III. IL-29 играет важную роль в защите хозяина от микробов, и его ген в высокой степени регулируется в клетках, инфицированных вирусами. IL29 не присутствует в геноме мыши. Он является членом семейства спиральных цитокинов и представляет собой интерферон III типа.Он также известен как IFNλ1 и очень похож по аминокислотной последовательности на IL-28, другой интерферон типа III. IL-29 играет важную роль в защите хозяина от микробов, и его ген в высокой степени регулируется в клетках, инфицированных вирусами. IL29 не присутствует в геноме мыши. |
| IL28 | Интерлейкин-28 (IL-28) представляет собой цитокин, который представлен в двух изоформах, IL-28A и IL-28B, и играет роль в иммунной защите от вирусов, включая индукцию «антивирусного состояния» путем включения белков Mx, 2 ‘, 5’-олигоаденилатсинтетаза, а также ISGF3G (фактор 3 генов, стимулированный интерфероном).IL-28A и IL-28B относятся к семейству цитокинов интерферона III типа и очень похожи (по аминокислотной последовательности) на IL-29. Их классификация как интерферонов обусловлена их способностью вызывать противовирусное состояние, в то время как их дополнительная классификация как цитокинов обусловлена их хромосомным положением, а также тем фактом, что они кодируются несколькими экзонами, а не одним экзоном, как большинство типов. -I IFNs есть. |
Функции сотовой связи
Все интерфероны обладают несколькими общими эффектами: они являются противовирусными агентами и модулируют функции иммунной системы.Экспериментально показано, что введение IFN типа I ингибирует рост опухоли у животных, но положительное действие на опухоли человека широко не документировано. Клетка, инфицированная вирусом, выделяет вирусные частицы, которые могут заразить соседние клетки. Однако инфицированная клетка может подготовить соседние клетки к потенциальной инфекции вирусом, высвобождая интерфероны. В ответ на интерферон клетки продуцируют большое количество фермента, известного как протеинкиназа R (PKR). Этот фермент фосфорилирует белок, известный как eIF-2, в ответ на новые вирусные инфекции; фосфорилированный eIF-2 образует неактивный комплекс с другим белком, называемым eIF2B, для снижения синтеза белка в клетке. Другой клеточный фермент, РНКаза L, также индуцируемый действием интерферона, разрушает РНК внутри клеток, чтобы еще больше снизить синтез белка как вирусных генов, так и генов хозяина. Подавленный синтез белка разрушает как вирус, так и инфицированные клетки-хозяева. Кроме того, интерфероны индуцируют выработку сотен других белков, известных под общим названием гены, стимулированные интерфероном (ISG), которые играют роль в борьбе с вирусами и других действиях, вызываемых интерфероном. Они также ограничивают распространение вируса за счет увеличения активности р53, который убивает инфицированные вирусом клетки, способствуя апоптозу.Влияние IFN на p53 также связано с его защитной ролью против некоторых видов рака.
Другой клеточный фермент, РНКаза L, также индуцируемый действием интерферона, разрушает РНК внутри клеток, чтобы еще больше снизить синтез белка как вирусных генов, так и генов хозяина. Подавленный синтез белка разрушает как вирус, так и инфицированные клетки-хозяева. Кроме того, интерфероны индуцируют выработку сотен других белков, известных под общим названием гены, стимулированные интерфероном (ISG), которые играют роль в борьбе с вирусами и других действиях, вызываемых интерфероном. Они также ограничивают распространение вируса за счет увеличения активности р53, который убивает инфицированные вирусом клетки, способствуя апоптозу.Влияние IFN на p53 также связано с его защитной ролью против некоторых видов рака.
Другой функцией интерферонов является активация основных молекул комплекса гистосовместимости, MHC I и MHC II, и повышение активности иммунопротеасом. Более высокая экспрессия MHC I увеличивает представление вирусных пептидов цитотоксическим Т-клеткам, в то время как иммунопротеасома обрабатывает вирусные пептиды для загрузки на молекулу MHC I, тем самым увеличивая узнавание и уничтожение инфицированных клеток.Более высокая экспрессия MHC II увеличивает представление вирусных пептидов хелперным Т-клеткам; эти клетки выделяют цитокины (например, большее количество интерферонов и интерлейкинов, среди прочих), которые сигнализируют и координируют активность других иммунных клеток. Интерфероны, такие как гамма-интерферон, непосредственно активируют другие иммунные клетки, макрофаги и естественные клетки-киллеры.
Рис. 3. Линейное и мультипликационное изображение димера IFNγ.
Роль в болезни
Интерферон бета-1a и интерферон бета-1b используются для лечения и контроля рассеянного склероза, аутоиммунного заболевания.Это лечение эффективно для уменьшения приступов рецидивирующе-ремиттирующего рассеянного склероза и замедления прогрессирования и активности заболевания при вторично прогрессирующем рассеянном склерозе.
Интерфероновая терапия используется (в сочетании с химиотерапией и лучевой терапией) для лечения некоторых видов рака. Это лечение можно использовать при гематологических злокачественных новообразованиях; лейкоз и лимфомы, включая лейкоз волосатых клеток, хронический миелоидный лейкоз, узловую лимфому и кожную Т-клеточную лимфому.Пациенты с рецидивирующими меланомами получают рекомбинантный IFN-α2b. И гепатит В, и гепатит С лечат IFN-α, часто в комбинации с другими противовирусными препаратами. Некоторые из тех, кто лечится интерфероном, обладают устойчивым вирусологическим ответом и могут элиминировать вирус гепатита. Наиболее опасный штамм — вирус гепатита С генотипа I — можно лечить с 60-80% успешностью лечения с помощью действующего стандарта лечения интерфероном-α, рибавирином и недавно одобренными ингибиторами протеазы, такими как телапревир (Инсивек), май 2011 г. , Боцепревир (Victrelis) май 2011 г. или ингибитор нуклеотидного аналога полимеразы Софосбувир (Sovaldi) декабрь 2013 г.Биопсия пациентов, получавших лечение, показывает уменьшение повреждений печени и цирроза. Некоторые данные показывают, что введение интерферона сразу после заражения может предотвратить хронический гепатит С, хотя диагностика на ранней стадии инфекции затруднена, поскольку физические симптомы на ранней стадии инфицирования гепатитом С редки. Контроль хронического гепатита С с помощью IFN связан с уменьшением гепатоцеллюлярной карциномы.
Имеются доказательства низкого качества, свидетельствующие о том, что глазные капли с интерфероном могут быть эффективным средством лечения людей с эпителиальным кератитом, вызванным вирусом простого герпеса, типом глазной инфекции.Нет четких доказательств того, что удаление инфицированной ткани (санация) с последующим нанесением капель интерферона является эффективным подходом к лечению этих типов глазных инфекций. Доказательства низкого качества предполагают, что комбинация интерферона и противовирусного агента может ускорить процесс заживления по сравнению с одной противовирусной терапией.
Артикул:
| 1. | Де Андреа М., Равера Р., Джоя Д., Гариглио М., Ландольфо С. (2002).«Интерфероновая система: обзор». Европейский журнал детской неврологии . 6 Suppl A (6): A41–6; обсуждение A55–8. |
| 2. | Леви Д.Е., Мари И. Дж., Дурбин Дж. Э. (декабрь 2011 г.). «Индукция и функция интерферона типа I и III в ответ на вирусную инфекцию». Текущее мнение в области вирусологии. 1 (6): 476–86. |
| 3. | Германт П., Михильс Т. (2014).«Интерферон-λ в контексте вирусных инфекций: продукция, ответ и терапевтические последствия». Журнал врожденного иммунитета . 6 (5): 563–74. |
| 4. | Navratil V, de Chassey B, Meyniel L, Pradezynski F, André P, Rabourdin-Combe C, Lotteau V (июль 2010 г.). «Сравнение на системном уровне белок-белковых взаимодействий между вирусами и сетью системы интерферона человека I типа». Журнал протеомных исследований. 9 (7): 3527–36. |
| 5. | Шарифф К.А., Дункан Д., Юноси З. (февраль 2002 г.). «Достижения в лечении хронического гепатита С:« пегилированные »интерфероны». Кливлендский медицинский журнал клиники. 69 (2): 155–9. |
| 6. | Тан Й.Х., Тишфилд Дж., Раддл Ф.Х. (февраль 1973 г.). «Связывание генов человеческого интерферон-индуцированного противовирусного белка и признаков индофенолоксидазы-B с хромосомой G-21». Журнал экспериментальной медицины. 137 (2): 317–30. |
Вернуться к ресурсам
Твиттер Facebook
Международный журнал питания — Паб открытого доступа
Поскольку организм является крупнейшим органом защиты организма-хозяина, жизнеспособность микрофлоры желудочно-кишечного тракта имеет решающее значение для минимизации патофизиологических осложнений 1 . На функциональность микрофлории в значительной степени влияют различия в микробных сообществах. Эти сообщества формируются рядом сложных и динамичных эпигнетических факторов, включая диету, образ жизни и болезни 2 . Взаимодействие между микробиотой кишечника и иммунной системой хозяина может модулировать метаболические реакции, примером чего является производство желчных кислот, холина и короткоцепочечных жирных кислот, которые необходимы для здоровья хозяина 2 . Это усиливает связь между статусом питания хозяина, микробиотой / микробиомом и реакционными иммунными реакциями.Понимание этих осей является предпосылкой для оптимизации терапевтических стратегий, которые могут вызвать защитный иммунный ответ. В условиях продолжающегося финансового бремени наших национальных служб здравоохранения и сильной зависимости от фармацевтических препаратов в качестве контрмер для борьбы с болезнями открытие диетических стратегий, нацеленных на профилактику, а не на лечение, заслуживает дальнейшего изучения.
На функциональность микрофлории в значительной степени влияют различия в микробных сообществах. Эти сообщества формируются рядом сложных и динамичных эпигнетических факторов, включая диету, образ жизни и болезни 2 . Взаимодействие между микробиотой кишечника и иммунной системой хозяина может модулировать метаболические реакции, примером чего является производство желчных кислот, холина и короткоцепочечных жирных кислот, которые необходимы для здоровья хозяина 2 . Это усиливает связь между статусом питания хозяина, микробиотой / микробиомом и реакционными иммунными реакциями.Понимание этих осей является предпосылкой для оптимизации терапевтических стратегий, которые могут вызвать защитный иммунный ответ. В условиях продолжающегося финансового бремени наших национальных служб здравоохранения и сильной зависимости от фармацевтических препаратов в качестве контрмер для борьбы с болезнями открытие диетических стратегий, нацеленных на профилактику, а не на лечение, заслуживает дальнейшего изучения.
Мед — вязкое и гигроскопичное вещество, производимое пчелами из цветочного нектара.Эта богатая сахаром жидкость имеет решающее значение для экологии растений, эволюции насекомых и биоразнообразия. Исторически мед использовался как естественное лечебное средство, и наглядные свидетельства его использования датируются 8000 лет назад. Традиционно мед считается натуральным лечебным средством из-за его невероятно насыщенного питательного состава 3 . Почти весь «сырой» (т.е. непастеризованный) мед содержит несколько питательных микроэлементов (кальций, железо, магний, фосфор, калий, натрий и цинк), витамины (B2, B3, B5, B6, B9 и C) и ферменты (глюкозооксидаза), которые предположительно способствуют мощному ингибирующему эффекту, который он вызывает до 60 видов бактерий, грибов и вирусов 4 .Хотя мед состоит в основном из фруктозы и глюкозы, он также содержит пребиотический фруктоолигосахарид (ФОС). После ферментации в толстой кишке FOS стимулирует производство бифидобактерий, одного из основных родов бактерий, характеризующих «здоровую» микрофлору.
Неудивительно, что многофункциональные иммуномодулирующие свойства меда привлекли внимание ученых, и исследования показали, что он обладает противомикробными 5 , противовоспалительными 6 , антиоксидантными 7 и антимутагенными свойствами 6 , 8 .Особый интерес представляют иммунологические свойства меда, который в зависимости от биогеографического источника может содержать повышенные уровни встречающегося в природе казуаринового глюкозида; соединение, связанное с активным стимулированием более сильной провоспалительной реакции на патогены. Важно отметить, что казуарин глюкозид является вышестоящим регулятором различных плейотропных цитокинов, включая интерферон гамма (IFN-γ), димеризованный растворимый цитокин, который усиливает клеточный иммунитет и активирует естественные клетки-киллеры (NK) для обеспечения противовирусной активности 9 .
С клинической точки зрения, IFN-γ представляет собой важный медиатор нескольких клеточных процессов, которые помогают облегчить различные патологии, например рассеянный склероз 10 , трансплантация органов 11 и ревматоидный артрит 12 . IFN-γ также является важным индикатором активации Т-клеток гиперчувствительности замедленного типа (TDTH), которые высвобождают IFN-γ как ответную реакцию на антигены. Хотя в основном он рассматривается как цитокин, связанный с Т-клетками, IFN-γ также продуцируется другими иммунными клетками 13 .Действительно, комбинированная стимуляция как IFN-γ, так и липополисахаридами (LPS) или только LPS может значительно увеличить процент продуцирующих IFN-γ моноцитов у здоровых людей 13 . ЛПС / эндотоксин является составной частью клеточной стенки грамотрицательных бактерий, которая активирует микробицидные эффекторные функции макрофагов, а также продукцию различных провоспалительных цитокинов. Попадая в кровоток, LPS стимулирует противовоспалительную реакцию острой фазы за счет активации макрофагов, которые пытаются бороться с патогенными инвазиями.
Интересно, что в недавней экспериментальной работе Дэвидсона и Ротондо (2005) наблюдались сильные противовоспалительные эффекты перорального приема 20,4 г (концентрация казуарин глюкозида 1,3 мг) меда из тропических лесов (TFH) в 0, 2, 7, 14 и 21 день. после администрации. Пиковое увеличение IFN-γ было обнаружено на 2 день, то есть через 48 часов после употребления, со значениями, достигающими 4,6, 5,0, 9,7 и 13,0 раз выше, чем исходные уровни (день 0) в ответ на 0 мкг / мл, 0,01 мкг / мл, 1 мкг / мл и 100 мкг / мл липолисахарида (ЛПС) соответственно.
Учитывая, что даже небольшие количества IFN-γ могут повысить способность макрофагов бороться с патогенами 14 , следует отметить повышенные концентрации, наблюдаемые во время этого пилотного исследования. Однако, хотя обычно считается пищей с высоким содержанием питательных веществ, могут существовать существенные различия между и внутри как в макро-, так и в микронутриентном профиле любого данного меда 15 . Такие различия в значительной степени зависят от вариаций в его сложном химическом составе, который может значительно варьироваться в зависимости от происхождения нектара, вида пчел, географического положения и производственного процесса.Таким образом, сравнительная работа по изучению потенциальных различий в иммунологических биомаркерах между сортами меда может помочь выявить наиболее подходящие для патофизиологических осложнений.
Целью этого исследования было наблюдать влияние перорального приема двух разных видов меда (1) мед тропических лесов (TFH) и (2) мед манука; сила 12+ (MAN) на уровни циркулирующего IFN-γ в плазме после стимуляции ex vivo липополисахаридом (LPS) у здоровых людей.
Дифференциальные ответы на подтипы IFN-α в человеческих Т-клетках и дендритных клетках
Реферат
IFN типа I (IFN-αβ) составляют семейство цитокинов, которые обладают важными противовирусными и иммунорегуляторными свойствами и успешно используются при лечении широкого спектра заболеваний.Существует 12 функциональных подтипов человеческого IFN-α и один подтип IFN-β, которые передают сигнал через IFN-αβR на общей клеточной поверхности. На сегодняшний день практически отсутствует информация о специфичности ответов IFN-α в иммунных клетках. В этом исследовании анализировали передачу сигналов киназы Janus / STAT и транскрипционные ответы на выбранные подтипы IFN-α в человеческих Т-клетках и дендритных клетках. Были обнаружены доказательства специфичности IFN-α к подтипу и типу клеток. Также наблюдались различия между кинетикой экспрессии IFN-стимулированных генов (ISG) и потребностями отдельных ISG в дополнительных сигнальных путях.В частности, IFN-γ-индуцируемый белок-10 (IP-10), ключевой хемокин при воспалительных заболеваниях Th2-типа, регулировался дифференцированно. В дендритных клетках он сильно индуцировался IFN-α2 и IFN-α21, но гораздо менее эффективно IFN-α1. Эти подтипы Т-лимфоцитов лишь незначительно индуцировали его. В отличие от других проанализированных ISG, оптимальная индукция IP-10 зависела от активации киназы (ей) p38. Наблюдаемые вариации (дифференциалы, связанные с подтипом, типом клеток и ISG) позволяют лучше понять сложность и пластичность ответа IFN-αβ.Кроме того, новое наблюдение о том, что IFN-α1 плохо индуцирует IP-10, потенциально имеет клиническое значение, поскольку этот подтип может быть более полезным в случаях, когда Th2-опосредованные побочные эффекты (например, обострение аутоиммунных заболеваний) нежелательны.
IFN типа I (IFN-αβ) представляют собой семейство гомологичных цитокинов. Первоначально они были идентифицированы из-за их сильной противовирусной активности, но также было показано, что они обладают как антипролиферативной, так и широким спектром иммунорегуляторной активности (1, 2).IFN-αβ являются наиболее часто используемыми цитокинами для лечения широкого спектра заболеваний, включая рассеянный склероз, вирусный гепатит и меланому (3, 4).
IFN-αβ сильно индуцируются в ответ на вирусную инфекцию, но также могут продуцироваться при воздействии невирусных патогенов, включая грамотрицательные бактерии и простейшие (например, Escherichia coli , Leishmania major ) (5, 6). IFN-αβ является частью врожденного цитокинового ответа. Они быстро продуцируются при инфицировании и запускают ранние неспецифические защитные механизмы, включая индукцию генов, которые ингибируют репликацию вируса и активацию цитотоксичности NK-клеток.IFN-αβ также обеспечивает важную связь между врожденным и адаптивным иммунитетом, формируя многие компоненты Ag-специфического иммунного ответа. Например, IFN-αβ способствует ответам CTL, увеличивает продукцию Ab и способствует развитию наивных Th-клеток в направлении фенотипа Th2. Считается, что эти поздние иммунорегуляторные эффекты IFN-αβ опосредуются скорее косвенными, чем прямыми действиями, и, вероятно, будет задействована модуляция экспрессии цитокинов / рецепторов цитокинов и функции дендритных клеток (DC) 5 (7, 8, 9) .
У человека имеется несколько генов IFN-α и один ген IFN-β (2, 10, 11). Транскрибируется не менее 13 генов IFN-α. Кодирующие последовательности этих генов расходятся до 8%, давая начало 12 различным функциональным подтипам белков (IFN-α1 и -α13 идентичны). Все подтипы IFN-α и IFN-β сходны по структуре и имеют общий рецептор клеточной поверхности, состоящий из двух известных субъединиц, IFNAR1 и IFNAR2 (12, 13, 14). Обычно связывание IFN-αβ с рецепторным комплексом инициирует сигнальный каскад посредством активации тирозинкиназ Tyk2 и Janus-киназы (Jak) 1 и, следовательно, фосфорилирования и димеризации STAT1 и STAT2 (15).Активированные димеры STAT отделяются от рецепторного комплекса и перемещаются в ядро, где они регулируют экспрессию IFN-стимулированных генов (ISG) (5). В ответ на IFN-αβ образуется ряд комплексов факторов транскрипции. Фактор ISG 3 (ISGF3) состоит из STAT1, STAT2 и p48 / ISGF3γ / IFN регуляторного фактора (IRF) 9 и связывает IFN-стимулированные ответные элементы (ISRE), присутствующие во многих промоторах ISG. Гетеродимеры STAT1-2 и гомодимеры STAT1 управляют экспрессией подмножества ISG через элементы γ-активированной последовательности (GAS).Другие члены семейства STAT участвуют в передаче сигналов IFN-αβ. Например, было обнаружено, что IFN-αβ активирует STAT3 в большинстве типов клеток, STAT4 и STAT5 в Т-клетках и NK-клетках (16, 17, 18) и STAT6 в B-клетках (19). Кроме того, задействованы пути, опосредованные фосфатидилинозитол-3 (PI3) киназой (20, 21), киназой митоген-активированного протеина (MAP) p38 (22, 23, 24) и регулируемой внеклеточными сигналами киназой 1/2 (25). в передаче сигналов IFN-αβ, но их точные роли еще предстоит установить.
Существование множества различных подтипов IFN-α поднимает вопрос об их биологической значимости. Известно, что разные вирусы индуцируют разные паттерны экспрессии подтипа IFN-α (26, 27) и что продукция отдельных подтипов регулируется разными IRF (28, 29, 30). Сообщалось об отчетливой относительной активности отдельных подтипов in vitro и in vivo (31, 32, 33, 34, 35, 36, 37, 38). Однако все подтипы IFN-α, вероятно, обладают способностью проявлять классические активности IFN-αβ (например,g., противовирусные эффекты), как и следовало ожидать, учитывая, что они действуют через общий рецептор. Однако есть существенные биохимические доказательства того, что отдельные подтипы IFN связываются с разными сайтами IFN-αβR и имеют разную аффинность связывания, что приводит к образованию различных сигнальных комплексов (39, 40, 41, 42, 43, 44, 45), которые, априори, можно было ожидать по-разному рекрутировать нижестоящие сигнальные пути. Соответственно, разумно предположить следующее: 1) наложенные на широко перекрывающиеся классические функции, такие специфичные для подтипа сигнальные комплексы могут быть способны по-разному активировать вспомогательные ответы, характерные для этого подтипа; 2) любые такие различия, вероятно, зависят от клеточного фона и будут проявляться различиями в профилях экспрессии генов; и 3) принимая во внимание важность IFN-αβ для иммунной функции, различия подтипов IFN-α будут наиболее очевидны и соответствующим образом проанализированы в первичных клетках иммунной системы.
В этом исследовании изучали передачу сигналов через пути Jak / STAT и профили экспрессии генов для человеческих Т-клеток и DC, обработанных различными подтипами IFN-α. Помимо количественных различий между IFN-α1, -α2 и -α21 в их способности активировать STAT1–5 и ISG, были обнаружены доказательства специфичности IFN по подтипу и типу клеток, а также дифференциальные требования для дополнительных путей. Ярким примером является индукция IFN-γ-индуцируемого белка-10 (IP-10), хемокина, который играет важную роль в привлечении Th2-клеток и NK-клеток к участкам воспаления.Он сильно индуцировался IFN-α2 и -α21, но в гораздо меньшей степени IFN-α1 в DC. Напротив, он плохо индуцировался всеми этими подтипами IFN-α в Т-клетках. Оптимальная индукция IP-10, в отличие от других проанализированных классических ISG, зависела от активации киназы (ей) p38 MAP. Индуцибельная NO-синтаза (iNOS) и IL-12Rβ2 также дифференцированно индуцировались в DC и T-клетках. Существенные различия в кинетике накопления мРНК для разных подгрупп ISG усложняют ответ IFN-α.
Материалы и методы
Культура клеток и цитокин
РВМС выделяли из лейкоцитов центрифугированием плотности на Lymphoprep (Nycomed, Осло, Норвегия). Для получения Т-клеток PBMC активировали PHA (Murex, Kent, UK) и поддерживали в RPMI 1640 с добавлением 10% инактивированной FCS и rIL-2 человека (20 нг / мл) в течение 1 недели. Перед обработкой IFN-α бласты Т-клеток промывали и затем культивировали в течение 48 часов в отсутствие rIL-2.Для генерации DC моноциты выделяли из PBMC путем сортировки MACS с использованием анти-CD14-конъюгированных магнитных микрошариков (Miltenyi Biotec, Bergisch Gladbach, Германия) и культивировали в течение 6 дней в RPMI 1640 с добавлением 10% инактивированной FCS, 50 нг / мл GM- CSF и 50 нг / мл IL-4 (оба от R&D Systems, Миннеаполис, Миннесота). Использовали следующие бактериальные подтипы rIFN-α: IFN-α1 (IFN-αD; удельная активность 5,0 × 10 7 U / мг), IFN-α21 (IFN-αF; удельная активность 6,3 × 10 8 U / мг), как от PBL Biomedical Laboratories (Нью-Брансуик, Нью-Джерси), так и IFN-α2 (IFN-α2a; роферон; удельная активность, 5.4 × 10 8 Ед / мг) от Roche (Базель, Швейцария). Все цитокины не содержали эндотоксина, как определено анализом лизата амебоцитов Limulus (т.е. <0,1 ЕД / мл эндотоксина). Соединения SB203580 и LY294002 были получены от Sigma-Aldrich (Сент-Луис, Миссури).
Лизис клеток, иммунопреципитация, аффинная очистка и вестерн-блоттинг
Клетки обрабатывали в течение 20 минут подтипами IFN-α, а затем лизировали в 0,5% Nonidet P-40, 50 мМ Трис (pH 8.0), 10% глицерина, 150 мМ NaCl, 1 мМ DTT, 1 мМ EDTA, 1 мМ ортованадат натрия, 1 мМ PMSF, 100 Ед / мл апротинина и 1 мкг / мл лейпептина. Лизаты очищали центрифугированием и использовали либо непосредственно для SDS-PAGE, либо для иммунопреципитации с антителами против STAT2 (Santa Cruz Biotechnology, Санта-Крус, Калифорния) и протеином A-сефарозой. Аффинную очистку ДНК-связывающих белков проводили, как описано ранее (46), с использованием биотинилированного олигонуклеотида ДНК, содержащего консенсусный элемент GAS (5′-GTGGCTTTCCGGGAATCCTTG-3 ‘).Белки, элюированные загрузочным буфером, подвергали электрофорезу в гелях 7,5% полиакриламид-SDS и переносили на поливинилидендифторидные мембраны (Immobilon-P; Millipore, Bedford, MA). Мембраны были зондированы следующими Abs: анти-фосфотирозиновый Abs PY20 (Affinity, Ноттингем, Великобритания) и 4G10, анти-STAT1 фосфосерин 727 (оба от Upstate Biotechnology, Лейк-Плэсид, Нью-Йорк), анти-STAT1 фосфотирозин 701, антифосфо-фосфатный p38 и анти-p38 (все из New England Biolabs, Беверли, Массачусетс), анти-STAT1 p91 (NovoCastra, Newcastle, U.K.) и анти-STAT2, анти-STAT3, анти-STAT4 и анти-STAT5B (все от Santa Cruz Biotechnology). После ECL и авторадиографии мембраны очищали в 62,5 мМ Трис (pH 6,8), 2% SDS и 100 мМ 2-ME, а затем повторно зондировали при необходимости.
Экстракция РНК
Общую РНКвыделяли из клеток с использованием Trireagent (Helena Biosciences, Сандерленд, Великобритания) в соответствии с инструкциями производителя. Количество и качество РНК оценивали путем определения OD 260 и OD 280 с использованием спектрофотометрии и дополнительной визуализации с помощью электрофореза в агарозном геле.
Профилирование экспрессии генов: анализ макромассивов
кДНК, меченная радиоактивным изотопом, была получена из 5–10 мкг тотальной РНК путем обратной транскрипции с помощью Superscript II (Life Technologies, Rockville, MD) в присутствии [ 33 P] dCTP. Остаточную РНК гидролизовали щелочной обработкой при 70 ° C в течение 20 мин, и кДНК очищали с использованием колонок G-50 (Amersham Pharmacia, Bucks, UK). Перед гибридизацией с макромассивами меченую кДНК смешивали с 50 мкг COT-ДНК (Life Technologies) и 10 мкг поли (A) ДНК (Sigma-Aldrich), денатурировали при 95 ° C в течение 5 минут и гибридизовали в течение 1 часа. для минимизации неспецифического связывания.Подготовка макромассивов (представляющих 150 известных ISG), гибридизация радиоактивных кДНК, сканирование и анализ макромассивов проводились, как описано ранее (47).
Анализ защиты от РНКазы (RPA)
Как и ранее, проведеноРПА (48). Зонды IP-10, IL-12Rβ2, iNOS, супрессор передачи сигналов цитокинов (SOCS) 1, SOCS3 и GAPDH были приобретены у BD PharMingen (Сан-Диего, Калифорния). Вкратце, зонды были синтезированы из транскрипционных векторов SP6 / T7 и помечены [ 32 P] UTP до 2–5 × 10 8 импульсов в минуту на микрограмм входящей ДНК.Для анализа использовали аликвоты, эквивалентные 1–3 × 10 5 импульсов в минуту каждого зонда и 5–10 мкг общей РНК. Интенсивность радиоактивных полос определяли количественно с использованием PhosphorImager (Storm; Molecular Dynamics, Саннивейл, Калифорния). Представляющие интерес полосы были количественно оценены, скорректированы на фон и нормализованы к контрольной полосе (то есть, GAPDH или γ-актину). Результаты выражаются в виде интенсивностей PhosphorImager.
IP-10 ELISA
DC культивировали в 96-луночных планшетах (1 × 10 5 DC на 200 мкл) и обрабатывали подтипами IFN-α в течение 18 часов.Уровни белка IP-10 в супернатантах определяли с помощью специфического ELISA (HyCult Biotechnology, Норвуд, Массачусетс).
Результаты
Способность IFN подтипов IFN-α1, -α2 и -α21 активировать путь Jak / STAT и индуцировать значительный набор ISG была исследована на Т-клетках и DC. Эти подтипы были выбраны потому, что 1) IFN-α1 и -α2 обычно являются основными видами IFN, продуцируемыми в ответ на многие вирусы и поли (I: C) (49, 50, 51), 2) rIFN-α2 широко используется в терапевтических целях ( 4) и 3) IFN-α21 проявляет повышенную ингибирующую активность по сравнению с IFN-α2 (45).Кроме того, как рекомбинантный, так и природный IFN-α1 имеют в ~ 10 раз более низкую специфическую противовирусную активность, чем большинство подтипов, включая IFN-α2 и -α21 (52, 53). В соответствии с этим специфическая (противовирусная) активность используемых rIFN находилась в диапазоне 5 × 10 7 и 5 × 10 8 МЕ / мг белка для IFN-α1 по сравнению с -α2 и -α21, соответственно. В соответствии с существующей практикой везде указаны абсолютные концентрации подтипов. Для упрощения справки, абсолютные концентрации 2 нг / мл для IFN-α2 и -α21 и 20 нг / мл для IFN-α1 каждая соответствуют ~ 1000 МЕ / мл в зависимости от противовирусной активности.
Активация STAT в ответ на подтипы IFN-α
Человеческие Т-клетки и DC обрабатывали в течение 20 минут диапазоном концентраций различных подтипов IFN-α. Экстракты цельных клеток (фиг. 1⇓, A , верхние панели и C ) или иммунопреципитированные белки STAT2 ( A , нижние панели ) фракционировали с помощью SDS-PAGE, и фосфорилирование STAT было исследовали с помощью вестерн-блоттинга с антителами, специфичными для фосфорилированных остатков Tyr и / или Ser.Альтернативно, активированные димеры STAT подвергали аффинной очистке по их способности связываться с биотинилированным олигонуклеотидом, содержащим консенсусный элемент GAS, и связанные активированные STAT анализировали аналогичным образом (фиг. 1- B ).
РИСУНОК 1.Активация STAT подтипами IFN-α в Т-клетках и DC. Т-клетки ( A и B ) или DC ( C ) стимулировали различными концентрациями IFN-α1, IFN-α2 или IFN-α21 в течение 20 минут и получали лизаты цельных клеток. A и C , лизаты Т-клеток ( A ) и DC ( C ) разделяли с помощью SDS-PAGE, блотировали и исследовали на фосфорилирование STAT1 S727 и Y701 ( верхние панели ). Блот отделяли и повторно зондировали mAb против STAT1. Параллельно лизаты подвергали иммунопреципитации с помощью антител против STAT2 и иммуноблотировали с помощью антител против фосфотирозина (анти-P-Tyr), отделяли и повторно зондировали с помощью антител против STAT2 ( A , нижние панели ). B , лизаты Т-клеток очищали аффинно биотинилированным GAS-олигонуклеотидом (материал и методы ), подвергали электрофорезу, блоттингу и зондированию с помощью анти-STAT1, анти-STAT3, анти-STAT4 и анти-STAT5B Abs.Данные представляют как минимум два независимых эксперимента.
В Т-клетках мы наблюдали, что все три подтипа IFN-α индуцировали фосфорилирование тирозина STAT1 до -5 (рис. 1, A и B ). Однако фосфорилирование / активация этих STAT под действием IFN-α1 было сравнительно слабым: для детектируемого фосфорилирования тирозина для каждого из STAT требовались от 10 до 100 раз более высокие абсолютные концентрации этого подтипа (рис. 1⇑, A и ). B ).Аналогичным образом, для обнаружения положительного сигнала в менее чувствительном анализе фосфорилирования Ser 727 для STAT1 требовались от 10 до 100 раз более высокие концентрации подтипа IFN-α1 (рис. 1⇑ A ). Такое фосфорилирование не было обнаружено анализом экстракта целых клеток при любой из протестированных концентраций IFN-α1 (до 10 нг / мл; фиг. 1⇑ A ). Однако при более высоких концентрациях (20 и 200 нг / мл) фосфорилированные формы STAT1 Ser 727 можно было наблюдать в анализе GAS oligo pull-down.В этом анализе (рис. 1⇑ B ) две формы STAT1 с различной электрофоретической подвижностью представляют собой STAT1, фосфорилированный по тирозину (нижняя полоса , ), и STAT1, фосфорилированный как по тирозину, так и по серину ( верхняя полоса ) (46). Для IFN-α2 и IFN-α21 наблюдались сходные кривые доза-ответ для фосфорилирования как тирозина, так и серина, хотя IFN-α2 оказался немного более эффективным при более низких концентрациях.
В DC сравнение ответов на IFN-α1 и IFN-α2 аналогичным образом выявило большие количественные различия между этими подтипами в их способности индуцировать фосфорилирование тирозина и серина STAT1 (рис.1 C ) и STAT3 (данные не показаны) и индуцировать образование комплекса ISGF3, как определено с помощью EMSA (данные не показаны).
Также была исследована кинетика активации STAT в Т-клетках (рис. 2⇓ A ) и DC ( B ). Фосфорилирование STAT1 на Y701 поддерживалось в течение 1-2 часов, а затем снижалось. Учитывая количественно более низкую активность IFN-α1, не наблюдалось явных различий между подтипами IFN-α в кинетике фосфорилирования STAT1 Y701.Аналогичный анализ кинетики активации STAT2, -3 и -4 в Т-клетках и STAT3 в DC не выявил различий между подтипами IFN-α (данные не показаны).
ФИГУРА 2.Кинетика активации STAT1 в Т-клетках и ДК. Т-клетки ( A ) или DC ( B ) стимулировали различными концентрациями IFN-α1, IFN-α2 или IFN-α21 в течение различных периодов времени, как указано. Готовили лизаты цельных клеток и проводили иммуноблоттинг с антифосфо-Y701.Блоты удаляли и повторно зондировали mAb против STAT1. Данные представляют два независимых эксперимента.
Взятые вместе, результаты показывают, что существуют существенные количественные, но не качественные различия между подтипами IFN-α в отношении активации STAT как в Т-клетках, так и в DC.
Профилирование экспрессии генов
Индивидуальные макромассивы на основе кДНК, каждый из которых представляет 150 известных ISG в трех экземплярах ( Материалы и методы и Ref.47), были использованы в начальном скрининге дифференциальной экспрессии генов в ответ на три подтипа IFN-α. В предыдущих экспериментах для IFN-α2 в линиях клеток на основе HT1080 оптимальная индукция практически всех представленных ISG обычно наблюдалась при 2 нг / мл в течение 6-8 часов (47). Соответственно, в этом исследовании ответы на все три подтипа были проанализированы при 2 нг / мл, что соответствует физиологическим концентрациям ∼1000 МЕ / мл для IFN-α2 и IFN-α21 и 100 МЕ / мл для IFN-α1 (материалы ). и методы ).Чтобы компенсировать более низкую специфическую противовирусную активность, подтип IFN-α1 также исследовали в DC при более высокой абсолютной концентрации 20 нг / мл (1000 МЕ / мл). Была проанализирована общая РНК из необработанных и обработанных подтипом клеток. Результаты показаны как кратность индукции по сравнению с необработанными клетками. Данные для этих генов, индуцированных в 2 раза или более (27 в Т-клетках и 36 в DC), включая классические ISG MxA, 2′-5′-олигоаденилатсинтетазу и PKR , которые, как известно, участвуют в противовирусных ответах, представлены (Таблица I⇓).Как и ожидалось для ISG, не наблюдалось значительной репрессии (> 2-кратной) любого из представленных генов. Что касается активации STAT, как в Т-клетках, так и в DC, в целом, ISG сильнее индуцируются IFN-α2 и -α21, чем IFN-α1. И снова IFN-α21 был немного менее эффективным, чем IFN-α2 (Таблица I⇓). IFN-α1 в концентрации 2 нг / мл достаточно для активации STAT1 и -2 (рис. 1 и 2). В соответствии с этим, хотя и менее эффективен, чем IFN-α2 или -α21, IFN-α1 в концентрации 2 нг / мл явно индуцировал, особенно в DC, более высоко индуцибельный из спектра ISG, наблюдаемый с более сильными IFN-α2 и -α21. подтипы.То, что любое различие в значительной степени является количественным, было по существу подтверждено более близким соответствием, наблюдаемым при увеличении концентрации IFN-α1 с 2 до 20 нг / мл (таблица I, DC, , первая колонка ). Интересно, однако, что IFN α2 и α21 индуцировали экспрессию хемокина IP-10 и мРНК iNOS в DC, но не в T-клетках. Это является еще одним примером специфичности клеточного типа в ответе на IFN-α (47). Что еще более важно в этом исследовании, что касается специфичности подтипа IFN-α, не наблюдалось значительной индукции гена IP-10 в DC в ответ на IFN-α1, даже при повышенной концентрации 20 нг / мл, тогда как он был сильно индуцирован в этих клетках 2 нг / мл IFN-α2 (14.В 4 раза) и IFN-α21 (в 6,6 раза) (таблица I⇓). Потенциально подобные различия, специфичные для подтипа IFN-α, наблюдались для ряда других ISG (например, RING4, GBP-1, IFI16 и Caspase 1 ). Однако эти различия были менее значительными и менее последовательными среди трех проанализированных донорских образцов, и их еще предстоит установить. Следовательно, из проанализированных IP-10 оказался наиболее вероятным кандидатом на ген ответа, специфичный для подтипа IFN-α. Соответственно, индукцию мРНК и белка IP-10 анализировали дополнительно.
Таблица I.Индукция ISG подтипами IFN-α a
Индукция мРНК и белка IP-10 подтипами IFN-α
Кинетику индукции мРНК IP-10 сравнивали с помощью RPA с кинетикой для отбора IFN-α-индуцибельных мРНК как в DC, так и в T-клетках, обработанных IFN-α1 (2 и 20 нг / мл) или IFN-α2 ( 0,2 и 2 нг / мл) в течение 1, 4 и 8 ч (рис. 3⇓). Наблюдались различия 1) в кинетике индукции различных ISG, 2) между типами клеток и 3) между подтипами IFN-α.
РИСУНОК 3.Подтипы и типы клеток в профилях экспрессии мРНК, индуцированных IFN-α. A , Кинетика индукции мРНК ISG. Т-клетки и DC обрабатывали IFN-α1 (20 и 2 нг / мл) или IFN-α2 (2 и 0,2 нг / мл) в течение указанного времени. Аликвоты (5 мкг) цитоплазматической РНК анализировали на предмет индуцируемой экспрессии гена с помощью RPA с использованием зондов IP-10, iNOS, IL-12Rβ2, SOCS3 и SOCS1 с GAPDH в качестве контроля загрузки ( верхние панели ) и ISG-65K, 6-16 и 9-27 зонды и γ-актин в качестве контроля нагрузки ( нижние панели ).Данные представляют из трех независимых экспериментов. B , Количественный анализ данных постоянного тока. Гели ( A , левая панель ) подвергали количественному анализу PhosphorImager. Были рассчитаны данные для кратности индукции после поправки на контрольные нагрузки GAPDH и γ-актина. Данные для IP-10, ISG-56K, 6-16 и 9-27 представлены в качестве примеров.
Дифференциальная кинетика индукции.
Индукция мРНК SOCS3 была исключительно ранней и преходящей, индукция ISG-56K была ранней, но продолжительной, тогда как индукция даже первично индуцированных мРНК 6-16, 9-27 и STAT1 оказалась немного задержанной.Ясно, что точка обнаружения зависит от чувствительности анализа, но различия в формах (переходные и продолжительные) кривых остаются. Транскрипционный ответ для всех основных идентифицированных мРНК (Рис. 3⇑ и Таблица I well) хорошо установлен. Поскольку мы изучаем накопление мРНК, нельзя, конечно, исключить дополнительную модуляцию через различия в стабильности мРНК.
Дифференциалы типов клеток.
В ответ, например, на 2 нг / мл IFN-α2, IP-10 и iNOS сильно индуцировались в DC (IP-10, 242 раза через 4 часа; iNOS, 30 раз через 1 час; рис.3⇑ A , дорожки 8 и 4 ), но лишь незначительно в Т-клетках (IP-10, 4 раза через 4 часа; iNOS 2 раза через 1 час; A , полосы 21 и 17 ), таким образом подтверждая дифференциацию клеточного типа, наблюдаемую в макромассивах (Таблица I⇑). Дополнительным примером специфичности клеточного типа является ген IL-12Rβ2 , который активируется в Т-клетках (рис. 3 ( A , дорожки 19–22 ), но не в DC ( A , переулки 1–13 ).
дифференциала подтипа IFN-α.
В DC, все время анализируемого, мРНК IP-10 сильно индуцировалась IFN-α2 (0,2 и 2 нг / мл), но гораздо менее эффективно при 10-кратном повышении концентрации (2 и 20 нг / мл) IFN- α1 (рис. 3⇑). Это особенно очевидно в момент времени 8 часов на рис. 3 ⇑ A (сравните полосы 10, и 11 с 12 и 13 ) и соответствует фактическому отсутствию IFN-α1. -индуцированный ответ IP-10 через 8 ч в макромассиве (таблица I⇑).В соответствии с этим повышенные уровни мРНК IP-10 все еще определялись через 24 часа в ответ на IFN-α2 (2 нг / мл), но не на IFN-α1 (20 нг / мл) (данные не показаны). Более того, что важно, в ответ на IFN-α1 вырабатывалось значительно меньше белка IP-10, чем IFN-α2 (фиг. 4). Действительно, для индукции сравнимых количеств белка IP-10 требовались по крайней мере в 100 раз более высокие концентрации IFN-α1 (20 нг / мл), чем IFN-α2 (0,2 нг / мл) (рис. 4⇓), в результате согласуется с аналогичной разницей в эффективности индукции мРНК IP-10 (рис.3⇑, A , сравните полосы 2 и 5 , 6 и 9 , 10 и 13 и B ). Это контрастирует с данными для подавляющего большинства ISG, для которых индукция в ответ на IFN-α2 (0,2 и 2 нг) и в 10 раз более высокие концентрации IFN-α1 (2 и 20 нг / мл) были весьма сопоставимы ( Рис. 3⇑ и Таблица I⇑). Таким образом, хотя при абсолютных концентрациях, скорректированных в 10 раз, чтобы компенсировать 10-кратную разницу в специфической противовирусной активности и сродстве к рецепторам (см. Выше), IFN-α1 и -α2 могут проявлять аналогичную противовирусную активность и индуцировать большинство ISG в одинаковой степени, они гораздо больше различаются по своей способности индуцировать IP-10.Данные предполагают, что для оптимальной индукции IP-10, но не для большинства ISG, оцененных в таблице I⇑, может потребоваться, по крайней мере, в DC, дополнительный сигнал (ы), активируемый IFN-α2, но не IFN- α1.
РИСУНОК 4.Индукция белка IP-10 IFN-α1 и IFN-α2. DC стимулировали различными концентрациями IFN-α1 или -α2 в течение 18 часов. Среду из трех лунок собирали и объединяли, и уровни IP-10 определяли в двух экземплярах с помощью ELISA (материалы и методы , ).Данные представлены как среднее значение ± стандартная ошибка среднего для двух независимых экспериментов.
Активация p38 необходима для оптимальной индукции IP-10
Промотор IP-10 содержит ISRE (54). Активированные STAT1 и -2 необходимы (вместе с уже существующим p48 / ISGF3γ / IRF9) для образования ISGF3, который опосредует ответы IFN-α через ISRE. Следовательно, можно разумно предположить, что активированные STAT1 и -2 необходимы (хотя и не обязательно достаточны) для индукции IP-10 с помощью IFN-α.Никакой разницы в активации STAT1 и -2 или в образовании ISGF3 в ответ на IFN-α1 и -α2 не наблюдалось (например, фиг. 1). Следовательно, различия в индукции IP-10 подтипами IFN-α1 и -α2 нельзя объяснить различиями в активации STAT. Помимо передачи сигналов Jak / STAT, пути киназ p38 и PI3 участвуют в ответах IFN-α (20, 21, 22, 23, 24). Поэтому была исследована роль этих путей в индукции IP-10 и других классических ISG в ответ на IFN-α1 и -α2.ДК обрабатывали IFN-α1 и -α2 (при 20 и 2 нг / мл соответственно) в отсутствие или в присутствии хорошо охарактеризованных ингибиторов киназы PI3 (LY294002) и p38 (SB203580) путей (рис. 5⇓). А ). Транскрипционные ответы оценивали через 8 ч, в этот момент разница между подтипами IFN-α при этих концентрациях была наиболее очевидной (рис. 3⇑ A ). Индукция IP-10 в ответ на оба подтипа IFN-α сильно ингибировалась SB203580, но не LY294002, что указывает на то, что путь киназы p38, но не PI3, участвует в регуляции этого гена.SB203580 ингибировал индукцию мРНК IP-10 дозозависимым образом, при этом ингибирование IP-10 наблюдалось с использованием всего лишь 1 мкМ этого соединения (данные не показаны). Напротив, этот ингибитор не влиял на индукцию мРНК ISG-56K, 2′-5′-олигоаденилатсинтетазы и 6-16 (фиг. 5⇓, A и B ) даже при значительно более высоких концентрациях. (20 мкМ; данные не показаны). Хотя LY294002 не влиял на индукцию мРНК IP-10, он был активен в этих клетках. Он сильно ингибировал накопление белка IP-10 в среде обработанных клеток (ELISA; три независимых эксперимента; данные не показаны).Скорее всего, это отражает потребность в киназе PI3 для секреции белка посредством экзоцитоза секреторных везикул (55).
РИСУНОК 5.Участие p38 в индукции IP-10. A , Влияние ингибиторов киназы PI3 и p38 на IFN-α-индуцированную экспрессию генов. DC обрабатывали IFN-α1 или IFN-α2 в концентрации 20 и 2 нг / мл соответственно в отсутствие или в присутствии LY294002 (LY) или SB203580 (SB) (оба по 10 мкМ) в течение 8 часов. Аликвоты (5 мкг) цитоплазматической РНК анализировали на предмет индуцируемой экспрессии гена с помощью RPA с использованием зондов IP-10, ISG-56K и 6-16 и GAPDH в качестве контроля загрузки. B , Количественное определение данных RPA с помощью анализа PhosphorImager двух независимых экспериментов (показано в A , а данные не показаны). Индукцию складок рассчитывали после поправки на контроль GAPDH. Данные представлены в виде процента ответа IFN-α2 в отсутствие ингибиторов (средние значения ± стандартная ошибка среднего). C , IFN-α индуцирует фосфорилирование p38. ДК обрабатывали IFN-α1 (20 нг / мл) или IFN-α2 (2 нг / мл) в течение 20 минут. Готовили лизаты цельных клеток и подвергали иммуноблоттингу с использованием антител против фосфо-p38, отделяли и повторно зондировали антителами против p38.
В соответствии с требованием к p38 для оптимальной индукции IP-10, как IFN-α1 (при 20 нг / мл), так и IFN-α2 (при 2 нг / мл) индуцировали фосфорилирование p38 (рис. 5⇑ C ). Фосфорилирование протеинкиназы B, субстрата киназы PI3, не наблюдалось (данные не показаны). Очевидно, что путь p38 используется обоими подтипами IFN-α и необходим для оптимальной индукции IP-10, но не для других анализируемых ISG.
Обсуждение
В этом исследовании мы впервые представляем анализ передачи сигналов через Jak / STAT и дополнительные пути, а также экспрессии генов в человеческих Т-клетках и DC в ответ на различные подтипы IFN-α.Наблюдались существенные вариации, включая различия в ответах IFN-α-подтипа и клеточного типа и экспрессии ISG. Важно отметить, что хемокин IP-10 дифференциально индуцировался в DC под действием IFN-α1 по сравнению с IFN-α2 и IFN-α21. При физиологических концентрациях (2 нг / мл) мРНК и белок IP-10 сильно индуцировались IFN-α2 и -α21, но слабо — IFN-α1 (таблица I и фиг. 3 и 4). В отличие от других проанализированных ISG, увеличение концентрации IFN-α1 до 20 нг / мл не приводило к индукции уровней IP-10, сравнимых с уровнями, индуцированными 2 нг / мл IFN-α2.
IP-10 был первоначально идентифицирован как IFN-γ-индуцированный белок (56). Исследования in vivo с использованием либо нейтрализующих IP-10 Abs, либо мышей с дефицитом IP-10 показывают, что этот хемокин играет важную неизбыточную роль в привлечении / перемещении эффекторных клеток Th2 в участки воспаления ткани (57, 58). Было высказано предположение, что ранняя экспрессия, в частности IP-10 in vivo, имеет решающее значение для установления защитных клеточных иммунных ответов против определенных патогенов, и что ответственны за это компоненты врожденной иммунной системы, а не IFN-γ (57).IFN-αβ являются вероятными кандидатами на роль таких компонентов. Действительно, недавно было показано, что индуцированная IFN-αβ продукция IP-10 DC в ответ на Mycobacterium tuberculosis имеет решающее значение для избирательного рекрутирования активированных Т-клеток (59). Следовательно, есть основания полагать, что нарушение индукции IP-10 под действием IFN-α1 в физиологических концентрациях может иметь важные последствия для иммунной регуляции. Следует отметить, что IFN-α1 играет важную роль в ответе на IFN-α, потому что он обычно является одним из основных продуцируемых подтипов (49, 50, 51).
Помимо защитной роли IP-10 при инфекциях, требующих сильных клеточно-опосредованных иммунных ответов, IP-10 также может способствовать прогрессированию определенных заболеваний. Экспрессия IP-10 наблюдалась при многих воспалительных / аутоиммунных заболеваниях Th2-типа, включая псориаз (60), рассеянный склероз (61, 62), ревматоидный артрит (63) и диабет 1 типа (64). Более того, мышиные модели аутоиммунитета Th2-типа in vivo установили критическую роль IP-10 в возникновении и прогрессировании заболевания (58, 65, 66).Очевидно, что индукция IP-10 и последующее привлечение клеток Th2 к участкам воспаления нежелательны при этих заболеваниях. В этом отношении интересно отметить, что терапевтическое применение IFN-α противопоказано пациентам с Th2-связанными расстройствами в анамнезе. Более того, были клинические примеры, когда введение IFN-α вызывало индукцию аутоиммунных заболеваний (67, 68) и приводило к обострению псориатических поражений (69). Принимая во внимание важную роль IP-10 в воспалительных заболеваниях Th2-типа, наблюдение, что индукция этого хемокина нарушается в ответ на IFN-α1, может иметь клиническое значение, поскольку этот подтип может быть более подходящим кандидатом для терапевтического применения в случаях, когда Воспалительные реакции Th2 нежелательны.Хотя эту возможность еще предстоит установить, удивительно, что IFN-α1 вызывал меньше побочных эффектов, чем IFN-α2, у пациентов со злокачественными заболеваниями (70).
В двух предыдущих исследованиях использовались инструменты глобального профилирования экспрессии генов для решения связанного с этим вопроса о том, существуют ли функциональные различия между IFN-α2 и IFN-β (37, 71). Эти исследования продемонстрировали, что при данной концентрации IFN-β индуцировало больше генов, чем -α2 (37, 71), но модели индукции ISG становились идентичными при увеличении концентрации IFN-α2 (37) — результат схожий. к этому для большинства ISG в ответ на IFN-α2 по сравнению с IFN-α1 в этом исследовании (Таблица I⇑).Принимая во внимание тот факт, что IFN-αβ действует через общий рецептор, это перекрытие в ответах, возможно, неудивительно. Тем не менее, текущие данные показывают, что даже при относительно высокой физиологической концентрации 2 нг / мл индукция IP-10 IFN-α1 серьезно нарушалась. Хотя индукция IFN-αβ может быть высокой в ответ, по крайней мере, на некоторые вирусные инфекции (72), она может быть относительно низкой в ответ на другие патогены (6), и есть также хорошие доказательства низкой конститутивной экспрессии (73). Таким образом, различия в действиях IFN-αβ при более низких концентрациях также могут быть биологически значимыми.
Были обнаружены существенные количественные различия между IFN-α1, -α2 и -α21 в способности активировать STAT1 до -5 и спектре ISG. При высоких концентрациях IFN-α все подтипы индуцировали фосфорилирование STAT1 до -5 в Т-клетках и STAT1 до -3 в DC (STAT4 и -5 не анализировались) и аналогичные паттерны экспрессии ISG (рис. 1 и таблица I). ). Различия между подтипами в этом отношении количественные, а не качественные и аналогичны тем, которые описаны для IFN-α2 и IFN-β (37).Важно отметить, что никаких существенных различий в кинетике активации STAT разными подтипами в диапазоне концентраций не наблюдалось (рис. 2, данные не представлены). Следовательно, нет очевидной специфичности активации STAT для этих конкретных подтипов в этих конкретных клетках. Недавно Cull et al. (38) сообщили о селективной активации STAT5 в ответ на различные подтипы IFN-α в иммортализованной линии клеток эритробластов мыши. Тем не менее, остается возможным, что это снова отражает количественную разницу в зависимости от концентрации, особенно потому, что активация STAT1 и -3 различными подтипами, как было показано, сильно зависит от используемой дозы.
Менее эффективное фосфорилирование / активация STAT под действием IFN-α1, чем -α2 (рис. 1⇑), коррелирует с известным более низким сродством связывания с рецептором IFN-αβ (в 20 раз ниже K d ) (39) и более низкая (в 5-20 раз) специфическая противовирусная активность в зависимости от типа клеток (52). Однако индукция большинства ISG была только в 2–4 раза ниже в ответ на IFN-α1, чем на IFN-α2 и -α21 (все при 2 нг / мл). Увеличение концентрации IFN-α1 до 20 нг / мл приводило к индукции ISG, сравнимой с IFN-α2 и -α21 (за исключением IP-10), несмотря на более низкую активацию STAT даже при этой более высокой концентрации IFN-α1 (Таблица I⇑ и Рис. .1⇑). Таким образом, количественная разница между IFN-α1 и IFN-α2 или -α21 оказывается меньше для индукции ISG, чем для активации STAT. Это произошло не просто из-за различий в чувствительности используемых анализов, потому что относительно небольшие различия в индукции ISG наблюдались в широком диапазоне концентраций (для IFN-α1, от 20 до 0,2 нг / мл; IFN-α2, от 2 до 0,02 нг / мл), и формы кривых доза-ответ для IFN-α1 и IFN-α2 были аналогичными (данные не показаны). Ранее сообщалось о различиях между активацией STAT и функциональными ответами; например, различия в противовирусной и антипролиферативной активности ряда гибридов IFN-α2 / 21 не коррелировали с их способностью активировать STAT1 / 2 (45) и противовирусной активностью IFN-β в клеточной линии, экспрессирующей усеченный IFN. Рецептор -αβ был сильно нарушен, в отличие от активации передачи сигналов Jak / STAT (43).Соответственно, вероятно, будут задействованы дополнительные факторы, ограничивающие скорость.
Оба пути киназы p38 и PI3 участвуют в передаче сигналов IFN-α (20, 21, 22, 23, 24). В DC активация p38, но не киназы PI3, по-разному требовалась для оптимальной индукции IP-10 по сравнению с другими мРНК ISG (фиг. 5⇑). И IFN-α1, и IFN-α2 активируют киназу (ы) p38 (рис. 5⇑ C ). Соответственно, дифференциальная индукция p38 кажется маловероятной, чтобы быть основой наблюдаемой разницы в индукции IP-10 в ответ на два подтипа IFN-α.Сообщалось о потребности в p38 как для ISRE-, так и для GAS-управляемой экспрессии репортерных конструкций (22, 23, 24). Требование активации p38 для IFN-α для оптимальной индукции IP-10, насколько нам известно, является первой демонстрацией участия этого пути в регуляции эндогенного ISG с помощью IFN-α. Таким образом, среди ISG, проанализированных в этом исследовании, IP-10 был уникальным в том смысле, что он 1) дифференциально регулируется подтипами IFN-α, 2) зависит от активации p38 и 3) индуцируется в DC, но не в Т-клетках.
Хотя это исследование не является конкретным направлением, оно также предоставило дополнительные доказательства специфичности клеточного типа для ответа на IFN-α (см. Ссылку 47) и основных различий в кинетике экспрессии подмножеств ISG. Помимо IP-10, примеры специфичности клеточного типа включают индукцию iNOS в DC, но не в T-клетках, и IL-12Rβ2 в T-клетках, но не в DC (таблица I и фиг. 3). В соответствии с последним, IL-12Rβ2 является геном, чувствительным к STAT4, а незрелые DC не экспрессируют STAT4 (74, 75, 76).Среди исследованных мРНК ISG наблюдалась очень разная кинетика накопления (рис. 3⇑ B и данные не представлены). Например, SOCS1 показал очень раннюю переходную кинетику, IP-10 и ISG-56K были аналогичными временными, но с небольшой задержкой, тогда как 6-16, 9-27 и STAT1 показали более устойчивую индукцию (рис. 3⇑). Очевидно, что точка обнаружения зависит от чувствительности анализа и выбранных временных точек, но различия в форме кривых, которые могут отражать или не отражать основные различия в стабильности мРНК, остаются.Интересно, что такие различия не наблюдались в аналогичном анализе для IFN-α2 в клетках фибросаркомы человека HT1080. В них накопление мРНК для всех 150 проанализированных ISG было продолжительным и оптимальным через 6-8 часов (ссылка 47; J. F. Schlaak и I. M. Kerr, неопубликованные данные). Эти противоположные результаты подчеркивают как сложность ответов, так и их зависимость от типа клеток. Очевидно, что в этой области данные, полученные в одной системе ячеек, не обязательно экстраполировать на другие.
В заключение, настоящее исследование предоставляет новую информацию об ответах подтипа IFN-α в человеческих Т-клетках и DC.Наблюдались существенные различия в активности подтипа IFN-α, в специфичности типа клеток и в требованиях к пути p38 MAPK. Индукция IP-10 была наиболее ярким примером в этом отношении. Дальнейшие примеры вариаций активности IFN-α-подтипа, вероятно, по-прежнему будут иметь важное значение для развития понимания роли (-ей) различных подтипов в иммунном ответе.
Благодарности
Мы благодарим докторов наук. Дорин Кантрелл, Патрик Костелло, Сандра Диболд и Факундо Батиста за критическое чтение рукописи.
Сноски
№1 Работа поддержана грантом Федора-Линена от Общества Александра фон Гумбольдта компании J.F.S.
№2 Cancer Research UK Лондонский научно-исследовательский институт состоит из лабораторий Lincoln’s Inn Fields и Clare Hall, входивших в состав бывшего Императорского фонда исследований рака после слияния Императорского фонда исследований рака с Кампанией по исследованию рака в феврале 2002 года.
№3 Фактический адрес: Эссенский университет, отделение гастроэнтерологии и гепатологии, Hufelandstrasse 55, 45122 Essen, Germany.
↵4 Адрес для корреспонденции и перепечатки запросов на перепечатку д-ру Яну М. Керру, Лондонский исследовательский институт рака, Великобритания, Lincoln’s Inn Fields Laboratories, 44 Lincoln’s Inn Fields, London WC2A 3PX, UK Адрес электронной почты: ian.kerr {at} рак .org.uk
↵5 В статье использованы сокращения: DC — дендритная клетка; Jak, Janus kinase; ISG, IFN-стимулированный ген; ISGF3, фактор ISG 3; IRF, регуляторный фактор IFN; ISRE, IFN-стимулированный ответный элемент; ГАЗ, γ-активированная последовательность; PI3, фосфатидилинозитол 3; MAP, митоген-активированный белок; IP-10, IFN-γ-индуцибельный белок-10; iNOS, индуцибельная NO-синтаза; SOCS, супрессор передачи сигналов цитокинов; RPA, анализ защиты от РНКазы.
- Получено 15 апреля 2003 г.
- Принято 2 сентября 2003 г.
- Авторское право © 2003 Американская ассоциация иммунологов
Ссылки
- ↵
Герберман Р. Б. 1997. Влияние α-интерферонов на иммунную функцию. Семин. Онкол. 24: (Прил. 9) : S9.78.
- ↵
De Maeyer, E., J. De Maeyer-Guignard.1998. Интерфероны типа I. Int. Rev. Immunol. 17:53.
- ↵
Беларделли, Ф., И. Грессер. 1996. Игнорированная роль интерферона типа I в ответе Т-клеток: значение для его клинического использования. Иммунол. Сегодня 17:369.
- ↵
Gutterman, J. U .. 1994. Цитокиновая терапия: уроки интерферона-α. Proc. Natl. Акад. Sci. США 91: 1198.
- ↵
Дифенбах, А., Х. Шиндлер, Н. Донхаузер, Э. Лоренц, Т. Ласкей, Дж. МакМикинг, М. Роллингхофф, И. Грессер, К. Богдан. 1998. Интерферон 1-го типа (IFNα / β) и синтаза оксида азота 2-го типа регулируют врожденный иммунный ответ на простейших паразитов. Иммунитет 8:77.
- ↵
Синг, А., Т. Мерлин, Х. П. Кнопф, П. Дж. Нильсен, Х. Лоппнов, К. Галанос, М. А. Фройденберг. 2000. Бактериальная индукция β-интерферона у мышей является функцией липополисахаридного компонента.Заразить. Иммун. 68: 1600.
- ↵
Фаррар, Дж. Д., К. М. Мерфи. 2000. Развитие интерферонов I типа и Т-хелперов. Иммунол. Сегодня 21: 484.
- ↵
Бирон, К. А. 2001. Интерфероны α и β как иммунные регуляторы: новый взгляд. Иммунитет 14: 661.
- ↵
Ле Бон, А., Дж. Скьявони, Дж. Д’Агостино, И. Грессер, Ф. Беларделли, Д.F. Жесткий. 2001. Интерфероны типа I сильно усиливают гуморальный иммунитет и могут способствовать переключению изотипа, стимулируя дендритные клетки in vivo. Иммунитет 14: 461.
- ↵
Weissmann, C., H. Weber. 1986. Гены интерферона. Прог. Nucleic Acid Res. Мол. Биол. 33: 251.
- ↵
Пестка, С. 1997. Виды интерферона-α человека и гибридные белки. Семин. Онкол. 24: (Прил. 9) : S9.4.
- ↵
Узе Г., Лутфалла Г., Грессер И. 1990. Генетический перенос функционального рецептора интерферона-α человека в клетки мыши: клонирование и экспрессия его кДНК. Ячейка 60: 225.
- ↵
Новик, Д., Б. Коэн, М. Рубинштейн. 1994. Рецептор интерферона α / β человека: характеристика и молекулярное клонирование. Ячейка 77: 391.
- ↵
Лутфалла, Г., SJ Holland, E. Cinato, D. Monneron, J. Reboul, NC Rogers, JM Smith, GR Stark, K. Gardiner, KE Mogensen, et al 1995. Мутантные клетки U5A дополняются субъединицей рецептора интерферона-αβ, генерируемой путем альтернативного процессинга нового члена кластера генов рецепторов цитокинов. EMBO J. 14: 5100.
- ↵
Старк, Г. Р., И. М. Керр, Б. Р. Уильямс, Р. Х. Сильверман, Р. Д. Шрайбер. 1998. Как клетки реагируют на интерфероны.Анну. Rev. Biochem. 67: 227.
- ↵
Чо, С. С., К. М. Бэкон, К. Сударшан, Р. К. Рис, Д. Финблум, Р. Пайн, Дж. Дж. О’Ши. 1996. Активация STAT4 IL-12 и IFN-α: доказательства участия лиганд-индуцированного фосфорилирования тирозина и серина. J. Immunol. 157: 4781.
- ↵
Yu, C. R., J. X. Lin, D. W. Fink, S. Akira, E. T. Bloom, A. Yamauchi. 1996. Дифференциальное использование активатора сигнального преобразователя киназы Janus сигнальных путей транскрипции при стимуляции естественных киллеров человека IL-2, IL-12 и IFN-α.J. Immunol. 157: 126.
- ↵
Матикайнен, С., Т. Саренева, Т. Ронни, А. Лехтонен, П. Дж. Коскинен, И. Юлкунен. 1999. Интерферон-α активирует множество белков STAT и активирует связанные с пролиферацией гены IL-2Rα , c- myc и pim-1 в Т-клетках человека. Кровь 93: 1980.
- ↵
Гупта, С., М. Цзян, А. Б. Пернис. 1999. IFN-α активирует Stat6 и приводит к образованию комплексов Stat2: Stat6 в B-клетках.J. Immunol. 163: 3834.
- ↵
Янг, К. Х., А. Мурти, С. Р. Пфеффер, Дж. Г. Ким, Д. Б. Доннер, Л. М. Пфеффер. 2001. Интерферон α / β способствует выживанию клеток, активируя ядерный фактор κB через фосфатидилинозитол-3-киназу и Akt. J. Biol. Chem. 276: 13756.30.
- ↵
Рани М. Р., Л. Хибберт, Н. Сиземор, Г. Р. Старк, Р. М. Рансохофф. 2002. Потребность в фосфоинозитид-3-киназе и Akt для опосредованной интерфероном-β индукции гена β- R1 ( SCYB11 ).J. Biol. Chem. 277: 38456.
- ↵
Го, К. К., С. Дж. Хак, Б. Р. Уильямс. 1999. Киназа p38 MAP необходима для фосфорилирования серина STAT1 и активации транскрипции, индуцированной интерферонами. EMBO J. 18: 5601.
- ↵
Уддин, С., Б. Майчжак, Дж. Вудсон, П. Арункумар, Ю. Алсайед, Р. Пайн, П. Р. Янг, Э. Н. Фиш, Л. К. Платаниас. 1999. Активация митоген-активируемой протеинкиназы p38 интерферонами I типа.J. Biol. Chem. 274: 30127.
- ↵
Уддин, С., Ф. Лекмине, Н. Шарма, Б. Майчжак, И. Майер, П. Р. Янг, Г. М. Бокоч, Э. Н. Фиш, Л. К. Платаниас. 2000. Путь митоген-активируемой протеинкиназы Rac1 / p38 необходим для интерферон-зависимой транскрипционной активации, но не фосфорилирования серина белков Stat. J. Biol. Chem. 275: 27634.
- ↵
Дэвид М., Э.Петрикоин, III, К. Бенджамин, Р. Пайн, М. Дж. Вебер, А. К. Ларнер. 1995. Потребность в активности киназы MAP (ERK2) в экспрессии генов, стимулированной интерфероном α и β интерфероном, через белки STAT. Наука 269: 1721.
- ↵
Hiscott, J., K. Cantell, C. Weissmann. 1984. Дифференциальная экспрессия генов интерферона человека. Nucleic Acids Res. 12: 3727.
- ↵
Макдональд, Н. Дж., D. Kuhl, D. Maguire, D. Naf, P. Gallant, A. Goswamy, H. Hug, H. Bueler, M. Chaturvedi, J. de la Fuente, et al 1990. Различные пути опосредуют индуцируемость вирусом гены IFN-α1 и IFN -β человека. Ячейка 60: 767.
- ↵
Мари, И., Дж. Э. Дурбин, Д. Э. Леви. 1998. Дифференциальная вирусная индукция отдельных генов интерферона-α посредством положительной обратной связи через фактор регуляции интерферона-7. EMBO J. 17: 6660.
- ↵
Лин, Р., П. Генин, Ю. Мамане, Дж. Хискотт. 2000. Селективное связывание ДНК и ассоциация с коактиватором связывающего белка CREB способствуют дифференциальной активации генов интерферона α / β факторами регуляции интерферона 3 и 7. Mol. Клетка. Биол. 20: 6342.
- ↵
Барнс, Б. Дж., П. А. Мур, П. М. Пита. 2001. Вирус-специфическая активация нового фактора регуляции интерферона, IRF-5, приводит к индукции различных генов интерферона α.J. Biol. Chem. 276: 23382.
- ↵
Реберг, Э., Б. Келдер, Э. Г. Хоул, С. Пестка. 1982. Удельная молекулярная активность рекомбинантных и гибридных лейкоцитарных интерферонов. J. Biol. Chem. 257: 11497.
- ↵
Белл, Д. М., Н. Дж. Робертс, младший, К. Б. Холл. 1983. Различные противовирусные спектры активности интерферона макрофагов человека. Природа 305: 319.
- ↵
Рыба, Е.Н., К. Банерджи, Н. Стеббинг. 1983. Подтипы лейкоцитарного интерферона человека обладают различной антипролиферативной и противовирусной активностью в отношении клеток человека. Biochem. Биофиз. Res. Commun. 112: 537.
- ↵
Фостер, Г. Р., О. Родригес, Ф. Гуз, Э. Шульте-Фролинде, Д. Теста, М. Дж. Ляо, Г. Р. Старк, Л. Ледбитер, Х. К. Томас. 1996. Различная относительная активность подтипов интерферона-α человеческого клеточного происхождения: IFN-α8 обладает очень высокой противовирусной активностью.J. Interferon Cytokine Res. 16: 1027.
- ↵
Йео, В. С., К. М. Лоусон, М. В. Бейльгарц. 1998. Противовирусная активность отдельных подтипов мышиного IFN-α in vivo: внутримышечная инъекция конструкций экспрессии IFN снижает репликацию цитомегаловируса. J. Immunol. 160: 2932.
- ↵
Hibbert, L., G.R. Foster. 1999. Интерфероны человека типа I сильно различаются по своему влиянию на пролиферацию первичных В-клеток.J. Interferon Cytokine Res. 19: 309.
- ↵
да Силва, А. Дж., М. Брикельмайер, Г. Р. Мажо, А. В. Лукашин, Дж. Пейман, А. Уитти, П. С. Хохман. 2002. Сравнение паттернов экспрессии генов, индуцированных обработкой эндотелиальных клеток пупочной вены человека IFN-α2b и IFN-β1a: понимание функциональной взаимосвязи между отдельными интерферонами типа I, которые действуют через общий рецептор. J. Interferon Cytokine Res. 22: 173.
- ↵
Калл, В.С., П. А. Тилбрук, Э. Дж. Бартлетт, Н. Л. Брекало, К. М. Джеймс. 2003. Дифференциальная терапия интерфероном I типа при эритролейкозе: специфичность активации STAT. Кровь 101: 2727.
- ↵
Йонехара, С., М. Йонехара-Такахаши, А. Исии, С. Нагата. 1983. Различное связывание человеческого интерферона α1 и α2 с общими рецепторами на человеческих и бычьих клетках: исследования с рекомбинационными интерферонами, продуцируемыми в Escherichia coli . J. Biol.Chem. 258: 9046.
- ↵
Ху, Р., Ю. Ган, Дж. Лю, Д. Миллер, К. К. Зун. 1993. Доказательства множественных сайтов связывания для нескольких компонентов человеческого лимфобластоидного интерферона-α. J. Biol. Chem. 268: 12591.
- ↵
Абрамович К., Л. М. Шульман, Э. Ратовицкий, С. Харроч, М. Тови, П. Эйд, М. Ревель. 1994. Дифференциальное фосфорилирование тирозина цепи IFNAR рецептора интерферона типа I и связанного поверхностного белка в ответ на IFN-α и IFN-β.EMBO J. 13: 5871.
- ↵
Платаниас, Л. К., С. Уддин, П. Домански, О. Р. Коламоничи. 1996. Различия в передаче сигналов интерферона α и β: интерферон β избирательно индуцирует взаимодействие субъединиц α и βL рецептора интерферона I типа. J. Biol. Chem. 271: 23630.
- ↵
Domanski, P., O. W. Nadeau, L.C. Platanias, E. Fish, M. Kellum, P. Pitha, O.R. Colamonici.1998. Дифференциальное использование субъединицы βL рецептора интерферона I типа (IFN) определяет специфичность передачи сигналов для IFNα2 и IFNβ. J. Biol. Chem. 273: 3144.
- ↵
Леверенц, М., К. Э. Могенсен, Г. Узе. 1998. Общие рецепторные компоненты, но отдельные комплексы для α и β интерферонов. J. Mol. Биол. 282: 585.
- ↵
Ху, Р., Дж. Бекиш, М. Хейс, С. Одет, Дж. Билер, Э. Петрикоин, К.Зун. 1999. Дивергенция связывания, передачи сигналов и биологических ответов на рекомбинантный гибридный IFN человека. J. Immunol. 163: 854.
- ↵
Athie-Morales, V., H. Flotow, K. L. Hilyard, D. A. Cantrell. 2000. IL-12 селективно регулирует STAT4 через фосфатидилинозитол-3-киназу и Ras-независимые пути передачи сигнала. Евро. J. Immunol. 30: 1425.
- ↵
Шлаак, Дж. Ф., К. М. Хилкенс, А.П. Коста-Перейра, Б. Штробл, Ф. Абергер, А. М. Фришауф, И. М. Керр. 2002. Типы клеток и специфичные для доноров транскрипционные ответы на интерферон-α: использование индивидуальных массивов генов. J. Biol. Chem. 277: 49428.27.
- ↵
Мюллер М., К. Лакстон, Дж. Бриско, К. Шиндлер, Т. Импрота, Дж. Э. Дарнелл-младший, Г. Р. Старк, И. М. Керр. 1993. Комплементация мутантной клеточной линии: центральная роль полипептида 91 кДа ISGF3 в путях передачи сигналов интерферона-α и -γ.EMBO J. 12: 4221.
- ↵
Лаллеманд, К., П. Лебон, П. Рицца, Б. Бланшар, М. Г. Тови. 1996. Конститутивная экспрессия определенных изотипов интерферона в лейкоцитах периферической крови здоровых людей и в промоноцитарных клетках U937. J. Leukocyte Biol. 60: 137.
- ↵
Поль Г., У. Хеллман, Э. Лундгрен, С. Лундберг. 1994. Пять доминирующих подтипов α-интерферона вируса Сендай стимулировали лейкоциты человека.J. Interferon Res. 14: S63.
- ↵
Фостер, Г. Р., Н. Б. Финтер. 1998. Все ли интерфероны человека I типа эквивалентны ?. J. Viral Hepat. 5: 143.
- ↵
Streuli, M., A. Hall, W. Boll, W. E. Stewart, II, S. Nagata, C. Weissmann. 1981. Специфичность клеток-мишеней двух видов человеческого интерферона-α, продуцируемого в Escherichia coli , и гибридных молекул, производных от них.Proc. Natl. Акад. Sci. США 78: 2848.
- ↵
Zoon, K. C., D. Miller, J. Bekisz, D. zur Nedden, J. C. Enterline, N. Y. Nguyen, R.Q. Hu. 1992. Очистка и характеристика множества компонентов человеческого лимфобластоидного интерферона-α. J. Biol. Chem. 267: 15210.
- ↵
Омори Ю., Т. А. Гамильтон. 1995. Стимулируемый интерфероном элемент ответа и сайт κB опосредуют синергическую индукцию транскрипции мышиного гена IP-10 IFN-γ и TNF-α.J. Immunol. 154: 5235.
- ↵
Одзава, К., Т. Масудзима, К. Икеда, Ю. Кодама, Ю. Нономура. 1996. С помощью светового микроскопа с видеоусилением выявлены различные пути ингибирующего действия вортманнина на экзоцитоз. Biochem. Биофиз. Res. Commun. 222: 243.
- ↵
Lustre, A. D., J. C. Unkeless, J. V. Ravetch. 1985. γ-Интерферон транскрипционно регулирует ген раннего ответа, содержащий гомологию с белками тромбоцитов.Природа 315: 672.
- ↵
Хан, И. А., Дж. А. Маклин, Ф. С. Ли, Л. Кашотти, Э. ДеХаан, Дж. Д. Шварцман, А. Д. Ластер. 2000. IP-10 имеет решающее значение для транспортировки эффекторных Т-клеток и выживания хозяина при инфекции Toxoplasma gondii . Иммунитет 12: 483.
- ↵
Dufour, J. H., M. Dziejman, M. T. Liu, J. H. Leung, T. E. Lane, A. D. Luster. 2002. Мыши с дефицитом IFN-γ-индуцируемого белка 10 (IP-10; CXCL10) обнаруживают роль IP-10 в генерации и перемещении эффекторных Т-клеток.J. Immunol. 168: 3195.
- ↵
Р. Ланде, Э. Джакомини, Т. Грасси, М. Э. Ремоли, Э. Иона, М. Миеттинен, И. Юлкунен, Э. М. Кочча. 2003. IFN-αβ, высвобождаемый дендритными клетками человека, инфицированными Mycobacterium tuberculosis , индуцирует экспрессию CXCL10: избирательное привлечение NK и активированных Т-клеток. J. Immunol. 170: 1174.
- ↵
Готтлиб А.Б., Ластер А.Д., Д.Н. Познетт, Д. М. Картер. 1988. Обнаружение индуцированного γ-интерфероном белка IP-10 в псориатических бляшках. J. Exp. Med. 168: 941.
- ↵
Балашов, К. Э., Дж. Б. Роттман, Х. Л. Вайнер, В. В. Хэнкок. 1999. CCR5 + и CXCR3 + Т-клетки увеличиваются при рассеянном склерозе, и их лиганды MIP-1α и IP-10 экспрессируются в демиелинизирующих поражениях головного мозга. Proc. Natl. Акад. Sci. США 96: 6873.
- ↵
Соренсен, Т.L., M. Tani, J. Jensen, V. Pierce, C. Lucchinetti, VA Folcik, S. Qin, J. Rottman, F. Sellebjerg, RM Strieter, et al. 1999. Экспрессия специфических хемокинов и хемокиновых рецепторов в центральная нервная система больных рассеянным склерозом. J. Clin. Вкладывать деньги. 103: 807.
- ↵
Патель, Д. Д., Дж. П. Захария, Л. П. Уичард. 2001. Лиганды CXCR3 и CCR5 в синовиальной оболочке ревматоидного артрита. Clin. Иммунол. 98:39.
- ↵
Шимада, А., Дж. Моримото, К. Кодама, Р. Судзуки, Ю. Оикава, О. Фунае, А. Касуга, Т. Сарута, С. Наруми. 2001. Повышенный уровень сывороточного IP-10 наблюдается при диабете 1 типа. Уход за диабетом 24: 510.
- ↵
Лю М. Т., Х. С. Кейрстед, Т. Э. Лейн. 2001. Нейтрализация хемокина CXCL10 снижает инвазию воспалительных клеток и демиелинизацию и улучшает неврологическую функцию в вирусной модели рассеянного склероза. J. Immunol. 167: 4091.
- ↵
Саломон, И., Н. Нецер, Г. Вильдбаум, С. Шиф-Цук, Г. Маор, Н. Карин. 2002. Нацеливание на функцию IFN-γ-индуцируемого белка 10 подавляет продолжающийся адъювантный артрит. J. Immunol. 169: 2685.
- ↵
Роннблом, Л. Э., Г. В. Альм, К. Оберг. 1991. Аутоиммунные явления у больных злокачественными карциноидными опухолями при лечении интерфероном-α. Acta Oncol. 30: 537.
- ↵
Бози, Э., Минелли Р., Э.Баззигалуппи, М. Салви. 2001. Фульминантный аутоиммунный диабет 1 типа во время терапии интерфероном-α: случай Th2-опосредованного заболевания ?. Диабет. Med. 18: 329.
- ↵
Quesada, J. R., J. U. Gutterman. 1986. Псориаз и α-интерферон. Ланцет 1: 1466.
- ↵
Хокинс, М. Дж., Э. К. Борден, Дж. А. Мерритт, Б. С. Эдвардс, Л. А. Болл, Э. Гроссбард, К. Дж. Саймон. 1984. Сравнение биологических эффектов двух рекомбинантных человеческих интерферонов α (rA и rD) на человека.J. Clin. Онкол. 2: 221.
- ↵
Дер, С. Д., А. Чжоу, Б. Р. Уильямс, Р. Х. Сильверман. 1998. Идентификация генов, дифференциально регулируемых интерфероном α, β или γ с использованием массивов олигонуклеотидов. Proc. Natl. Акад. Sci. США 95: 15623.
- ↵
Маркус, П. И., М. Дж. Секеллик. 1994. Индукция интерферона: регуляция как вирусом, так и клеткой. Хоккайдо Игаку Засси 69: 1320.
- ↵
Танигучи, Т., А. Такаока. 2001. Слабый сигнал для сильных ответов: пересмотр интерферона-α / β. Nat. Rev. Mol. Cell Biol. 2: 378.
- ↵
Sinigaglia, F., D. D’Ambrosio, P. Panina-Bordignon, L. Rogge. 1999. Регулирование оси IL-12 / IL-12R: критический шаг в дифференцировке Т-хелперных клеток и эффекторной функции. Иммунол. Откр.170: 65.
- ↵
Фрухт, Д. М., М. Аринджер, Дж. Галон, К. Даннинг, М.Браун, С. Фан, М. Чентола, К. Ю. Ву, Н. Ямада, Х. Эль-Габалави, Дж. Дж. О’Ши. 2000. Stat4 экспрессируется в активированных моноцитах периферической крови, дендритных клетках и макрофагах в местах Th2-опосредованного воспаления. J. Immunol. 164: 4659.
- ↵
Fukao, T., D. M. Frucht, G. Yap, M. Gadina, J. J. O’Shea, S. Koyasu. 2001. Индуцируемая экспрессия Stat4 в дендритных клетках и макрофагах и его критическая роль в врожденных и адаптивных иммунных ответах.J. Immunol. 166: 4446.
Вирус Эпштейна-Барра LF2: антагонист интерферона I типа
РЕФЕРАТ
При вирусной инфекции основной защитой, обеспечиваемой иммунной системой хозяина, является активация опосредованного интерфероном (IFN) противовирусного пути, который опосредуется Факторы регуляции IFN (IRF). Для завершения своего жизненного цикла вирусы должны модулировать иммунные ответы хозяина, опосредованные IFN. Несмотря на связь со значительными проблемами со здоровьем человека, активность вируса Эпштейна-Барра (EBV), вызывающего опухоль человека герпесвируса, по ускользанию от IFN-опосредованного врожденного иммунитета хозяина не была хорошо охарактеризована.Для поиска генов EBV, которые блокируют передачу сигнала IFN, мы провели скрининг открытых рамок считывания EBV на их способность блокировать IFN-α / β-опосредованную экспрессию люциферазы при заражении вирусом Сендай. Этот скрининг демонстрирует, что белок-тегумент LF2 EBV специфически взаимодействует с центральным ингибирующим ассоциативным доменом IRF7, и это взаимодействие приводит к ингибированию димеризации IRF7, которая подавляет продукцию IFN-α и IFN-опосредованный иммунитет. Это демонстрирует новый механизм иммунного уклонения EBV LF2 при блокировании клеточного IRF7-опосредованного врожденного иммунитета.
Врожденный иммунный ответ — это передовая линия защиты хозяина от микробной инфекции (15). Центральное место в противовирусном ответе хозяина занимает продукция интерферона I типа (IFN), которая тонко регулируется членами семейства регуляторных факторов IFN (IRF) (5, 15, 21-23). Это семейство участвует в противовирусной защите, иммунной регуляции, регуляции роста клеток и апоптозе (3, 18, 33). Отличительной особенностью этого семейства является высококонсервативный аминоконцевой ДНК-связывающий домен (DBD).Два близкородственных члена этого семейства, IRF3 и IRF7, по-видимому, являются основными преобразователями вирусной передачи сигналов при индукции IFN типа I (19, 22, 23, 27, 35). Транскрипционная активность IRF3 и IRF7 зависит от C-концевого фосфорилирования, опосредованного IKK-родственными киназами TBK1 и IKKε (12, 16, 36). Фосфорилирование запускает серию изменений в IRF3 и IRF7, включая изменение конформации, димеризацию через уникальный C-концевой домен, известный как ингибирующий связанный домен (IAD), и ядерную транслокацию.Эти изменения приводят к связыванию ДНК с IRF3 и IRF7 через их экспонированные DBD, что в конечном итоге активирует транскрипцию IFN типа I (28, 30, 39).
В то время как IRF3 является повсеместным белком, IRF7 является IFN-индуцибельным и преимущественно существует в клетках лимфоидного происхождения (1, 2, 4). Считается, что при вирусной инфекции IFN-β, экспрессия которого в основном регулируется IRF3, продуцируется первым из-за его повсеместной экспрессии. IFN-β после связывания с рецептором IFN активирует сигнальный каскад, который в конечном итоге приводит к индукции транскрипции сотен критических противовирусных генов, включая IFN-индуцируемую протеинкиназу R, 2 ‘, 5’-олигоаденилатсинтетазы, TLR3, TLR7, и IRF7 (11, 35).Транскрипция IFN-α, которая в первую очередь регулируется IRF7, сильно активируется в результате усиления экспрессии гена IRF7. Впоследствии секретируемый IFN-α индуцирует еще один цикл передачи сигнала, опосредованного рецептором IFN, в качестве механизма положительной обратной связи.
Большинство вирусов разработали стратегии защиты от ответов хозяина IFN (13, 15). Эти стратегии включают ингибирование передачи сигналов IFN путем подавления базальных уровней сигнальной молекулы JAK-STAT, подавление определенных молекулярных модификаций и предотвращение молекулярной транслокации.Например, VP35 вируса Эбола отменяет продукцию IFN типа I, ингибируя активацию IRF3 (6, 7). В рамках вируса герпеса, ассоциированного с саркомой Капоши (KSHV), прототипа гамма-2 герпесвируса, открытая рамка считывания 45 (ORF45) кодирует белок, блокирующий продукцию IFN типа I путем ингибирования фосфорилирования и ядерной локализации IRF7 (40). Кроме того, недавно сообщалось, что KSHV vIRF3, называемый латентно-ассоциированным ядерным антигеном 2 (LANA2), значительно снижает выработку IFN типа I путем физического связывания с IRF7 (24).Вирус простого герпеса, прототип альфа-герпесвируса, кодирует по крайней мере два модулятора ответа IFN, US11 и ICP34.5, которые нацелены на аналогичный путь ответа IFN, путь двухцепочечной РНК-зависимой протеинкиназы R (8-10, 31).
Вирус Эпштейна-Барра (EBV) — это повсеместный ДНК-вирус: им инфицировано 90% населения (25). После заражения вирус остается с хозяином до конца своей жизни. Первичная инфекция EBV приводит к инфекционному мононуклеозу, в то время как длительное воздействие EBV не имеет явных симптомов у иммунокомпетентного хозяина.Кроме того, ВЭБ ассоциируется с множеством опухолей, включая иммунобластную лимфому, болезнь Ходжкина, носоглоточную карциному, лимфому Беркитта и карциному желудка у пациентов со СПИДом с ослабленным иммунитетом и реципиентов трансплантатов органов при иммуносупрессивном лечении (25, 26). Это указывает на то, что ВЭБ находится под жестким контролем иммунной системы хозяина. Описаны два белка EBV, которые значительно подавляют адаптивные иммунные ответы (20, 34). EBV BGLF5 помогает вирусу избежать распознавания Т-клетками-хозяевами и уничтожения инфицированной клетки, отключая экспрессию генов главного комплекса гистосовместимости (MHC) класса I и MHC класса II (34).BNLF2a, белок раннего литического цикла EBV, блокирует презентацию MHC класса I за счет инактивации пептидного транспортера TAP1 / TAP2 для нарушения ответа Т-клеток CD8 + (20). Недавно сообщалось, что EBV BZLF1 негативно регулирует IRF7, но механизм остается неясным (17). Несмотря на ее связь с различными проблемами здоровья человека, наши знания о стратегии уклонения от EBV против врожденного иммунитета хозяина, опосредованного IFN I типа, отсутствуют, особенно по сравнению с другими герпесвирусами.
Для поиска специфических генов EBV, которые блокируют передачу сигнала IFN, мы провели скрининг ORF для EBV на их способность блокировать IFN-α / β-опосредованную экспрессию люциферазы при вирусной инфекции.Для создания библиотеки экспрессии EBV 150 исходных клонов EBV были субклонированы в векторы-получатели pCR3-Flag-His 6 с использованием системы Gateway. Каждый вирусный клон исследовали расщеплением рестриктазой и секвенированием ДНК, в то время как экспрессию вирусного белка определяли анализом иммуноблоттинга (данные не показаны). Чтобы идентифицировать белки EBV, которые ингибируют продукцию IFN типа I, клетки 293T трансфицировали IRF7, репортером люциферазы, управляемым промотором IFN-α6, и трансфекционным контрольным репортером люциферазы Renilla вместе с отдельными экспрессирующими клонами EBV, а затем инфицировали 50 гемагглютинирующими (НА) единицы вируса Сендай (SeV), мощный стимул выработки интерферона I типа.Через 24 часа после инфицирования клетки собирали для репортерных анализов. Вирус Эбола VP35, который, как было показано, блокирует передачу сигнала IFN (6, 7), был включен в качестве положительного контроля. Этот скрининг обнаружил, что EBV LF2 значительно ингибирует SeV-индуцированную активацию активности промотора IFN-α6. Чтобы определить, является ли ингибирующая способность LF2 общей или специфической для IRF7, мы протестировали его влияние на активацию промоторов IFN-α1, -4 и -6, которые регулируются в первую очередь клеточным IRF7 (11, 19, 22, 23). , 27, 35).Результаты показали, что в зависимости от дозировки экспрессия LF2 надежно подавляла IRF7-индуцированную активацию промоторных активностей IFN-α1, -4 и -6 (фиг. 1A). Чтобы дополнительно рассмотреть ингибирование активности промотора IFN с помощью LF2, мы измерили уровни мРНК IFN типа I в присутствии или в отсутствие экспрессии LF2. Через 24 часа после трансфекции с использованием IRF7, с EBV LF2 и без него, клетки 293T инфицировали SeV в течение 16 часов, а затем собирали для выделения общих РНК. ПЦР с обратной транскрипцией проводили с равными количествами тотальной РНК для определения уровней мРНК IFN I типа.После инфицирования SeV заметное увеличение мРНК IFN-α1, IFN-α4 и IFN-α6 было обнаружено в клетках, трансфицированных вектором IRF7, тогда как повышение было минимальным или не обнаруживалось в клетках, трансфицированных как IRF7, так и LF2 (рис. 1B). . Кроме того, иммуноферментный анализ показал, что подобно KSHV vIRF3, EBV LF2 эффективно подавлял секрецию IFN-α, вызванную инфекцией SeV (рис. 1C). Эти результаты показывают, что EBV LF2 эффективно блокирует опосредованную IRF7 активацию экспрессии IFN типа I.
В то время как IRF7 и IRF3 являются критическими регуляторами транскрипции экспрессии гена IFN типа I, IRF7 в первую очередь активирует активность промотора IFN-α1, -4, -6 и -14, а IRF3 индуцирует активность промотора ISRE (IFN-стимулированный чувствительный элемент) ( 11, 19, 22, 23, 35). Мы исследовали, отменяет ли экспрессия LF2 индуцированную IRF3 активацию активности промотора ISRE. Через 24 часа после трансфекции репортером люциферазы, управляемым промотором ISRE, с увеличивающимся количеством LF2, клетки 293T инфицировали SeV в течение 12 часов, а затем собирали для анализа люциферазы.Результаты показали, что, в отличие от его надежного аннулирования транскрипционной активности IRF7, LF2 не обнаруживает эффекта на IRF3-индуцированную активацию активности промотора ISRE (Рис. 1D). Напротив, VP35 вируса Эбола значительно подавлял индуцированную вирусом активность промотора ISRE в тех же условиях (рис. 1D). Эти результаты предполагают, что EBV LF2 специфически ингибирует активность IRF7, но не IRF3.
Учитывая ингибирующий эффект EBV LF2 на транскрипцию, индуцированную IRF7, мы протестировали потенциальное взаимодействие LF2 с IRF7.Через 48 часов после трансфекции экспрессионными векторами IRF7 и Flag-tagged LF2 или Flag-tagged IRF7 и V5-tagged LF2 экспрессирующие векторы клетки 293T использовали для иммунопреципитации (IP) с антителом против Flag с последующим иммуноблоттингом с анти-IRF7 или анти-IRF7 -V5 антитела соответственно. Co-IPs показали эффективное взаимодействие между LF2 и IRF7 (рис. 2A и B). Несмотря на высокую степень сходства с IRF7, IRF3 не способен связываться с LF2 в тех же условиях (рис. 2C). Взятые вместе, эти данные демонстрируют, что LF2 специфически взаимодействует с IRF7, но не с IRF3, и это взаимодействие, скорее всего, объясняет способность LF2 блокировать опосредованную IRF7 активацию экспрессии IFN типа I.
При вирусной инфекции IRF7 подвергается индуцированному инфекцией фосфорилированию серина в пределах своего карбоксиконцевого регуляторного домена. Эта модификация впоследствии стимулирует димеризацию белка, удерживание в ядре и взаимодействие с транскрипционными коактиваторами, что приводит к активации устойчивого ответа, состоящего из широкого спектра изотипов IFN (28, 30). Как было показано ранее (12, 16, 36), экспрессия киназ TBK1 и IKKε, которые фосфорилируют карбоксиконцевой регуляторный домен IRF7, приводит к активации транскрипционной активности IRF7, что приводит к резкому увеличению активности промотора IFN-α4 ( Инжир.3А). Однако коэкспрессия LF2 эффективно подавляла опосредованную TBK1 или IKKε киназой активацию транскрипционной активности IRF7 (фиг. 3A). В этих условиях коэкспрессия IKKε или TBK приводит к почти полному сдвигу IRF7 в его медленно мигрирующую фосфорилированную форму во время электрофореза в полиакриламидном геле с додецилсульфатом натрия (фиг. 3B). Мы обнаружили, что LF2 не влияет на TBK- или IKKε-опосредованную задержку миграции IRF7 (фиг. 3B). Было показано, что мутация C-концевых 477 и 479 остатков серина IRF7 в отрицательно заряженную глутаминовую кислоту, называемая IRF7 S477D S479D, имитирует TBK- или IKKε-опосредованное фосфорилирование, что приводит к конститутивной активации транскрипционной активности IRF7 (28, 30, 39).LF2 подавлял зависимым от дозы образом транскрипционную активность IRF7 S477D S479D так же эффективно, как и активность IRF7 дикого типа (фиг. 3C). Более того, LF2 не влияет на ядерную транслокацию IR7, потому что LF2 также локализуется в ядре (Fig. 4). Наконец, несмотря на то, что IRF7 подвергается протеосомному пути деградации (38), экспрессия LF2 не влияет на уровни белка IRF7 на детектируемом уровне (рис. 5). Эти результаты в совокупности указывают на то, что взаимодействие LF2 не влияет на фосфорилирование IRF7 и стабильность белка.
IRF7 состоит из N-концевого повтора триптофана, содержащего DBD, домен трансактивации, IAD и C-концевой регуляторный домен (RD) (28, 30, 39). Вызванное вирусом фосфорилирование IRF7, по-видимому, ослабляет внутримолекулярную ассоциацию между двумя аутоингибиторными доменами и демаскирует N-концевой DBD и C-концевой IAD, что приводит к образованию гомодимеров через IAD. Димеры IRF7 впоследствии перемещаются из цитоплазмы в ядро и стимулируют связывание ДНК и транскрипционную активность (28, 30, 39).Чтобы проверить, блокирует ли взаимодействие LF2 димеризацию IRF7, слияние глутатион S -трансфераза (GST) -IRF7 и белки Flag-IRF7 были коэкспрессированы в клетках 293T вместе с увеличивающимися количествами V5-LF2. Анализ GST pull-down показал, что гомодимеризация GST-IRF7 и Flag-IRF7, по-видимому, снижалась при экспрессии LF2, в то время как взаимодействие GST-IRF7 и V5-LF2 увеличивалось в тех же условиях (фиг. 6A). Клетки трансфицировали вектором экспрессии V5-LF2 и слияниями GST-IRF7, содержащими DBD, домен активации (AD), IAD, RD или полноразмерный ген, с последующим удалением GST.Анализ методом pull-down показал, что меченый V5 LF2 эффективно взаимодействует с полноразмерными GST-IRF7 и GST-IAD, но не с GST, GST-DBD, GST-AD и GST-RD (фиг. 6B). Эти результаты показывают, что LF2 эффективно ингибирует димеризацию IRF7, взаимодействуя с IAD IRF7, что может объяснять нарушение транскрипции, индуцированной IRF7.
IRF7 является главным регулятором врожденного иммунитета, а также играет важную роль в переходе от врожденного иммунитета к приобретенному (22). Из-за своей важной роли в иммунитете хозяина многие вирусы разработали различные стратегии подавления активации IRF7.ICP0, кодируемый вирусом простого герпеса и вирусом герпеса 1 крупного рогатого скота, ингибирует фосфорилирование TBK1 и IKKε (29). В ответ на вирусную инфекцию, предранний литический белок KSHV, кодируемый ORF45, который представляет собой белок тегумента вириона, связывается с IRF7 и блокирует его фосфорилирование и накопление в ядре, что приводит к блокированию транскрипции IFN-α и IFN-β (40 ). Кроме того, ранний литический фактор ядерной транскрипции KSHV RTA действует как убиквитин E3 лигаза, способствуя убиквитинизации и деградации белка IRF7 протеасомозависимым образом (38).Кроме того, недавно было показано, что KSHV vIRF3 связывает IRF7, что подавляет ДНК-связывающую способность IRF7 (24). Наше настоящее исследование добавляет EBV LF2 к расширяющемуся семейству вирусных белков, которые ингибируют клеточную транскрипционную активность IRF7 посредством белок-белковых взаимодействий.
Кодируемая EBV нуклеотидогидролаза dUTP (dUTPase), как недавно сообщалось, индуцирует иммунную дисрегуляцию in vivo у мышей (14). EBV LF1 (ORF10) и LF2 (ORF11) оба содержат dUTPase-подобный домен, что предполагает потенциальную роль dUTPase-подобного домена для активности против IFN.Однако наше предварительное исследование показало, что dUTPase-подобный домен не требуется для ингибирования продукции IFN типа I с помощью LF2 (неопубликованные данные). Кроме того, EBV LF1 и LF2, по-видимому, не важны для вирусной репликации в культуре клеток, поскольку геномная область, содержащая эти последовательности, удалена из штамма EBV B95-8, часто используемого для изучения вирусной репликации и иммортализации. Кроме того, мы также обнаружили, что ген LF2 лимфокриптовируса резуса, вируса, наиболее близкого к EBV (32, 37), эффективно подавляет индуцированную IRF7 транскрипцию IFN типа I, предполагая генетическую и функциональную консервацию LF2 в этих двух вирусах (неопубликованные данные). данные).Конструирование LF2-нокаутного лимфокриптовируса-резуса может быть полезным для выяснения функционального значения LF2 как антагониста IFN типа I, таким образом обеспечивая лучшее понимание того, вносит ли и как LF2 вклад в успешную инфекцию EBV и патогенез in vivo.
РИС. 1.LF2 подавляет продукцию IFN типа I. Всего 150 начальных клонов EBV, сконструированных Juergen Hass, были субклонированы в целевой вектор, названный pCR3.1-flag / 6xhis-dest, для создания библиотеки экспрессии EBV с использованием Gateway LR Clonase (Invitrogen, San Diego, CA).Расщепление рестрикционным ферментом и секвенирование ДНК подтвердили все клоны EBV в pCR3.1-flag / 6xhis-dest. Экспрессию вирусного белка определяли иммуноблоттингом с антителом против Flag (Sigma, Сент-Луис, Миссури). Затем последовательность EBV LF2 амплифицировали из входящего клона и субклонировали в вектор pCDNA5 / FRT / To (Invitrogen), меченный V5, между сайтами BamHI и XhoI. (A) LF2 ингибирует IRF7-индуцированную активность промоторов IFN типа I. Клетки 293T трансфицировали репортером люциферазы (luc), управляемым промотором IFN (IFN-α1, IFN-α4 или IFN-α6) типа I, репортером люциферазы Renilla и векторами экспрессии IRF7 вместе с увеличивающимися количествами вектора экспрессии LF2 .Через 24 часа после трансфекции клетки инфицировали 50 единицами НА SeV в течение 12 часов. Через 24 часа после инфицирования активность люциферазы измеряли с помощью набора для анализа двойного люциферазы-репортера от Promega Biotech (Мэдисон, Висконсин) и нормализовали до активности люциферазы Renilla для стандартизации эффективности трансфекции. Результаты представляют собой средние значения четырех независимых экспериментов. Четыреста нанограммов вируса Эбола VP35 (крайняя правая полоса на панелях) использовали в качестве положительного контроля в эксперименте. (B) Подавление SeV-индуцированных мРНК IFN с помощью EBV LF2.Всего 1 × 10 5 клеток 293T высевали в шестилуночные планшеты перед трансфекцией и затем трансфицировали с использованием IRF7 с LF2 или без него с последующей стимуляцией 100 единицами НА SeV в течение 12 часов. Количественная ОТ-ПЦР в реальном времени была проведена для определения уровней мРНК IFN типа I, как описано ранее (24). (C) Подавление SeV-индуцированной продукции IFN-α EBV LF2. Клетки 293T трансфицировали векторами экспрессии IRF7 с вектором экспрессии LF2 или без него. Через 24 часа после трансфекции клетки инфицировали 100 единицами НА SeV в течение дополнительных 12 часов.Для определения уровней IFN-α собирали среды для культивирования клеток для ELISA. KSHV vIRF3 был включен в качестве контроля. Результаты представляют собой среднее значение трех независимых экспериментов. (D) LF2 не влияет на IRF3-индуцированную активацию активности промотора ISRE. Клетки 293T трансфицировали репортером люциферазы, управляемым промотором ISRE, и репортером люциферазы Renilla вместе с увеличивающимися количествами LF2. Затем клетки обрабатывали 100 единицами НА SeV в течение 12 часов. Люциферазную активность измеряли, как описано на рис.1А. Вирус Эбола VP35 был включен в качестве контроля (показано последней полосой на панели).
РИС. 2. Взаимодействие(A и B) LF2 с IRF7. Клетки 293T трансфицировали IRF7 и / или Flag-LF2 (A) или Flag-IRF7 и / или V5-LF2. Через 48 ч после трансфекции клетки собирали на IP с антителом против Flag с последующим вестерн-иммуноблоттингом (WB) с антителом против IRF7 (A) или антителом против V5 (B). (C) LF2 не взаимодействует с IRF3. Клетки 293T трансфицировали Flag-LF2 и либо V5-IRF7, либо V5-IRF3 для Co-IP, как описано выше.WCL, лизаты целых клеток.
РИС. 3. ЭкспрессияLF2 не влияет на фосфорилирование IRF7. (A) LF2 подавляет опосредованную IKKε или TBK1 активацию транскрипционной активности IRF7. Клетки 293T трансфицировали репортером люциферазы (luc), управляемым промотором IFN-α4, репортером люциферазы Renilla , вектором IRF7 и вектором IKKε (верхняя панель) или TBK1 (нижняя панель) вместе с увеличивающимися количествами вектора LF2. Люциферазную активность измеряли, как описано на фиг. 1A. Уровень экспрессии IRF7 контролировали с помощью анализа иммуноблоттинга (один пример показан ниже).(B) LF2 не ингибирует фосфорилирование IRF7, индуцированное IKKε или TBK1. Клетки 293T трансфицировали Flag-IKKε или Flag-TBK1 и IRF7 с Flag-LF2 или без него. Затем был проведен вестерн-иммуноблоттинг (WB) с соответствующими антителами. (C) LF2 снижает активность промотора IFN типа I, индуцированного конститутивно активным мутантом IRF7 S477D S479D. Клетки 293T трансфицировали репортером люциферазы, управляемым промотором IFN (IFN-α1, IFN-α4 или IFN-α6), репортером люциферазы Renilla и IRF7 S477D S479D вместе с увеличивающимися количествами LF2.Люциферазную активность измеряли, как описано на фиг. 1. KSHV vIRF3 был включен в качестве контроля.
РИС. 4. ЭкспрессияLF2 не влияет на ядерную транслокацию IRF7. Клетки 293T или клетки HeLa трансфицировали либо меченным флагом IRF7 отдельно, либо вместе с меченным V5 LF2. Затем клетки инфицировали SeV через 12 ч после трансфекции. Иммуноокрашивание проводили на фиксированных клетках через 6 часов после инфицирования, и использовали конфокальную микроскопию для наблюдения флуоресценции.
РИС. 5. ЭкспрессияLF2 не влияет на уровень белка IRF7.Клетки 293T трансфицировали вектором IRF7 и увеличивающимся количеством вектора Flag-LF2. Клетки собирали для анализа вестерн-иммуноблотом (WB) для определения уровней экспрессии IRF7 и LF2 с использованием соответствующих антител.
РИС. 6.LF2 блокирует димеризацию IRF7 путем связывания с IAD IRF7. (A) LF2 блокирует димеризацию IRF7. Клетки 293T трансфицировали GST-IRF7 и Flag-IRF7 вместе с увеличивающимися количествами V5-LF2. GST-pull-down (PD) выполняли через 36 часов после трансфекции с последующим вестерн-иммуноблоттингом (WB) с антителами против Flag или против V5.Лизаты цельных клеток (WCL) были включены в анализ иммуноблоттинга. (B) LF2 связывается с IAD IRF7. Домены IRF7 показаны на схематической диаграмме. Каждый домен IRF7 был слит с GST млекопитающих в рамке считывания. Через 36 часов после трансфекции вектором слияния GST-IRF7 и вектором V5-LF2 клетки 293T собирали для удаления GST с последующим иммуноблоттингом с антителом против V5.
БЛАГОДАРНОСТИ
Эта работа частично поддержана грантами Службы общественного здравоохранения США CA106156, CA82057, CA91819 и RR00168, а также грантом Корейского исследовательского фонда KRF-2004-037-C00104.
Мы благодарим П. Палезе и Дж. Хискотта за предоставленные реагенты.
СНОСКИ
- Получено 18 марта 2008 г.
- Принято 26 сентября 2008 г.
- Авторские права © Американское общество микробиологии, 2009 г.
ССЫЛКИ
- 1.↵
WC , Д. В. ЛаФлер, Б. Томбал и П. М. Питха. 1998. Характеристика регуляторного фактора интерферона-7 и его потенциальной роли в активации транскрипции генов интерферона А.J. Biol. Chem. 273 : 29210-29217.
- 2.↵
Au, W. C., P. A. Moore, W. Lowther, Y. T. Juang и P. M. Pitha. 1995. Идентификация члена семейства факторов регуляции интерферона, который связывается с элементом ответа, стимулированным интерфероном, и активирует экспрессию индуцированных интерфероном генов. Proc. Natl. Акад. Sci. USA92 : 11657-11661.
- 3.↵
Барнс, Б. Дж., М. Дж. Келлум, К. Э. Пиндер, Дж.А. Фрисанчо и П. М. Пита. 2003. Интерферон регулирующий фактор 5, новый медиатор остановки клеточного цикла и гибели клеток. Cancer Res.63 : 6424-6431.
- 4.↵
Барнс, Б. Дж., П. А. Мур и П. М. Пита. 2001. Вирус-специфическая активация нового фактора регуляции интерферона, IRF-5, приводит к индукции различных генов интерферона альфа. J. Biol. Chem. 276 : 23382-23390.
- 5.↵
Барнс, Б.Дж., Дж. Ричардс, М. Манкл, С. Ханаш, Л. Беретта и П. М. Пита. 2004. Глобальные и отдельные мишени IRF-5 и IRF-7 во время врожденного ответа на вирусную инфекцию J. Biol. Chem.279 : 45194-45207.
- 6.↵
Basler, C. F., A. Mikulasova, L. Martinez-Sobrido, J. Paragas, E. Mühlberger, M. Bray, H.-D. Кленк, П. Палезе и А. Гарсия-Састре. 2003. Белок VP35 вируса Эбола ингибирует активацию регуляторного фактора интерферона 3. J. Virol.77 : 7945-7956.
- 7.↵
Basler, C. F., X. Wang, E. Muhlberger, V. Volchkov, J. Paragas, H. D. Klenk, A. Garcia-Sastre и P. Palese. 2000. Белок VP35 вируса Эбола действует как антагонист интерферона I типа. Proc. Natl. Акад. Sci. USA97 : 12289-12294.
- 8.↵
Кэссиди, К. А., М. Гросс и Б. Ройзман. 1998. Белок вируса простого герпеса U S 11 эффективно компенсирует γ 1 34.5, если он присутствует до активации протеинкиназы R путем предотвращения его фосфорилирования и фосфорилирования α-субъединицы фактора инициации трансляции 2 эукариот. J. Virol.72 : 8620-8626.
- 9.
Cheng, G., M.-E. Бретт и Б. Он. 2002. Сигналы, которые диктуют ядерное, ядрышковое и цитоплазматическое перемещение белка γ 1 34,5 вируса простого герпеса типа 1. J. Virol.76 : 9434-9445.
- 10.↵
Чжоу, Дж., Дж. Дж. Чен, М. Гросс и Б. Ройзман. 1995. Ассоциация фосфопротеина M (r) 90 000 с протеинкиназой PKR в клетках, демонстрирующих повышенное фосфорилирование фактора инициации трансляции eIF-2 альфа и преждевременное прекращение синтеза белка после инфицирования гамма 134,5 — мутантов вируса простого герпеса 1. Proc . Natl. Акад. Sci. USA92 : 10516-10520.
- 11.↵
Civas, A., M. L. Island, P. Genin, P. Morin и S. Navarro. 2002. Регулирование вирус-индуцированных генов интерферона-А. Biochimie84 : 643-654.
- 12.
Фицджеральд, К. А., С. М. Мак-Уиртер, К. Л. Файя, Д. К. Роу, Э. Латц, Д. Т. Голенбок, А. Дж. Койл, С. М. Ляо и Т. Маниатис. 2003. IKKε и TBK1 являются важными компонентами сигнального пути IRF3. Nat. Immunol.4 : 491-496.
- 13.↵
Garcia-Sastre, A., and C.A. Biron. 2006. Интерфероны типа 1 и отношения вирус-хозяин: урок разрядки.Science312 : 879-882.
- 14.↵
Глейзер, Р., М. Л. Лицки, Д. А. Паджетт, Р. А. Байокки, Э. В. Янг, М. Чен, П. Э. Йе, К. Б. Грин-Черч, М. А. Калиджури и М. В. Уильямс. 2006. dUTPase, кодируемая EBV, вызывает нарушение регуляции иммунитета: значение для патофизиологии EBV-ассоциированного заболевания. Вирусология 346 : 205-218.
- 15.↵
Гудборн, С., Л. Дидкок и Р. Э. Рэндалл. 2000 г.Интерфероны: клеточная сигнализация, иммунная модуляция, противовирусный ответ и меры противодействия вирусам. J. Gen. Virol. 81 : 2341-2364.
- 16.↵
Хакер, Х. и М. Карин. 2006. Регулирование и функция IKK и IKK-родственных киназ. Sci. СТКЕ357 : re13.
- 17.↵
Hahn, A.M., L.E. Huye, S. Ning, J. Webster-Cyriaque и J. S. Pagano. 2005. Интерфероновый регуляторный фактор 7 отрицательно регулируется ранним геном вируса Эпштейна-Барра, BZLF-1 .J. Virol.79 : 10040-10052.
- 18.↵
Харада, Х., М. Китагава, Н. Танака, Х. Ямамото, К. Харада, М. Исихара и Т. Танигучи. 1993. Антионкогенные и онкогенные возможности факторов регуляции интерферона-1 и -2. Science259 : 971-974.
- 19.↵
Hiscott, J. 2007. Запуск врожденного противовирусного ответа через активацию IRF-3. J. Biol. Chem.282 : 15325-15329.
- 20.↵
Хислоп, А. Д., М. Э. Рессинг, Д. ван-Леувен, В. А. Падни, Д. Хорст, Д. Копперс-Лалик, Н. П. Крофт, Дж. Дж. Нифьес, А. Б. Рикинсон и Э. Дж. Вирц. 2007. CD8 + Т-клеточный белок уклонения от иммунитета, специфичный для вируса Эпштейна-Барра и его близких родственников у приматов Старого Света. J. Exp. Med.204 : 1863-1873.
- 21.↵
Хонда, К. и Т. Танигучи. 2006. IRF: главные регуляторы передачи сигналов Toll-подобными рецепторами и рецепторами распознавания цитозольных образов.Nat. Rev. Immunol.6 : 644-658.
- 22.↵
Хонда, К., Х. Янаи, Х. Негиси, М. Асагири, М. Сато, Т. Мизутани, Н. Шимада, Я. Охба, А. Такаока, Н. Йошида , и Т. Танигучи. 2005. IRF-7 является главным регулятором интерферон-зависимых иммунных ответов I типа. Nature434 : 772-777.
- 23.↵
Хонда, К., Х. Янаи, А. Такаода и Т. Танигучи. 2005. Регулирование индукции IFN типа I: современный взгляд.Int. Immunol.17 : 1367-1378.
- 24.↵
Джу, К. Х., Ю. К. Шин, М. Гак, Л. Ву, Д. Леви и Дж. У. Юнг. 2007. Ингибирование опосредованной интерферон-регуляторным фактором 7 (IRF7) передачи сигнала интерферона гомологом IRF вируса герпеса Капоши vIRF3, ассоциированным с саркомой Капоши. J. Virol. 81 : 8282-8292.
- 25.↵
Kieff, E., and A. B. Rickinson. 2001. Вирус Эпштейна-Барра и его репликация, с.2511–2573. В Д. М. Книп, П. М. Хоули, Д. Э. Гриффин, Р. А. Лэмб, М. А. Мартин, Б. Ройзман и С. Е. Штраус (ред.), Филдс-вирусология, 4-е изд. Липпинкотт Уильямс и Уилкинс, Филадельфия, Пенсильвания.
- 26.↵
Kutok, J. L., and F. Wang. 2006. Спектр заболеваний, связанных с вирусом Эпштейна-Барра. Анну. Rev. Pathol.1 : 375-404.
- 27.↵
Леви, Д. Э., И. Мари, Э. Смит и А. Пракаш. 2002 г.Усиление и диверсификация индукции IFN за счет положительной обратной связи, опосредованной IRF7. J. Interferon Cytokine Res.22 : 87-93.
- 28.↵
Lin, R., Y. Mamane, and J. Hiscott. 2000. Множественные регуляторные домены контролируют активность IRF7 в ответ на вирусную инфекцию. J. Biol. Chem.275 : 4320-4327.
- 29.↵
Лин Р., Р. С. Нойс, С. Э. Коллинз, Р. Д. Эверетт и К. Л. Моссман. 2004. RING-домен ICP0 вируса простого герпеса ингибирует опосредованную IRF3 и IRF7 активацию генов, стимулированных интерфероном.J. Virol.78 : 1675-1684.
- 30.↵
Марие И., Э. Смит, А. Пракаш и Д. Э. Леви. 2000. Индуцированная фосфорилированием димеризация регуляторного фактора 7 интерферона разоблачает связывание ДНК и домен двусторонней трансактивации. Мол. Клетка. Биол.20 : 8803-8814.
- 31.↵
Попперс, Дж., М. Малви, Д. Ху и И. Мор. 2000. Ингибирование активации PKR богатым пролином РНК-связывающим доменом белка Us11 вируса простого герпеса 1 типа.J. Virol.74 : 11215-11221.
- 32.↵
Rivallier, P., H. Jiang, Y.-G. Чо, К. Куинк и Ф. Ван. 2002. Полная нуклеотидная последовательность лимфокриптовируса резуса: генетическая проверка модели вируса Эпштейна-Барра на животных. J. Virol.76 : 421-426.
- 33.↵
Romieu-Mourez, R., M. Solis, A. Nardin, D. Goubau, V. Baron-Bodo, R. Lin, B. Massie, M. Salcedo и J. Хискотт. 2006. Различная роль регуляторного фактора IFN (IRF) -3 и IRF-7 в активации противоопухолевых свойств макрофагов человека.Cancer Res.66 : 10576-10585.
- 34.↵
Роу, М., Б. Глаунсингер, Д. ван-Леувен, Дж. Зуо, Д. Свитман, Д. Ганем, Дж. Мидделдорп, Э. Дж. Вирц и М. Э. Рессинг. 2007. Отключение хозяина во время продуктивной инфекции вирусом Эпштейна-Барра опосредуется BGLF5 и может способствовать уклонению от иммунитета. Proc. Natl. Акад. Sci. USA104 : 3366-3371.
- 35.↵
Сато, М., Х. Суэмори, Н. Хата, М. Асагири, К. Огасавара, К.Накао, Т. Накая, М. Кацуки, С. Ногути, Н. Танака и Т. Танигучи. 2000. Четкие и важные роли факторов транскрипции IRF3 и IRF7 в ответ на вирусы для индукции гена IFN-альфа / бета. Иммунитет13 : 539-548.
- 36.↵
Sharma, S., B.R. tenOever, N. Grandvaux, G.P. Zhou, R. Lin и J. Hiscott. 2003. Запуск противовирусного ответа интерферона через IKK-связанный путь. Science300 : 1148-1151.
- 37.↵
Ву, Л. и Л. М. Хатт-Флетчер. 2007. Совместимость гомологов gH вируса Эпштейна-Барра и родственных лимфокриптовирусов. J. Gen. Virol. 88 : 2129-2136.
- 38.↵
Yu, Y., S. E. Wang, and G. S. Hayward. 2005. Фактор ранней транскрипции KSHV RTA кодирует активность лигазы убиквитина E3, которая нацелена на IRF7 для опосредованной протеосомами деградации. Иммунитет22 : 59-70.
- 39.↵
Zhang, L., and J. S. Pagano. 2002. Устройство и функции ИРФ-7. J. Interferon Cytokine Res.22 : 95-101.
- 40.↵
Zhu, F. X., S. M. King, E. J. Smith, D. E. Levy, and Y. Yuan. 2002. Герпесвирусный белок, ассоциированный с саркомой Капоши, подавляет вирус-опосредованную индукцию интерферона I типа, блокируя фосфорилирование IRF-7 и накопление в ядрах. Proc. Natl. Акад. Sci. USA99 : 5573-5578.
IRF11 положительно регулирует транскрипцию IFN типа I и противовирусный ответ у мандариновой рыбы Siniperca chuatsi., Сравнительная иммунология развития
У позвоночных сообщается об одиннадцати регуляторных факторах (IRF) интерферона (IFN), от IRF1 до IRF11, с консервативным присутствием от IRF1 до IRF9 во всех классах позвоночных. Однако IRF10 был зарегистрирован только у рыб и птиц, а IRF11, по-видимому, является специфическим членом IRF для рыб. В этом исследовании было обнаружено, что IRF11 у мандаринов Siniperca chuatsi активируется после вирусной инфекции, а IRF11 постоянно локализуется в ядре, что выявлено с помощью иммунофлуоресцентного теста.Анализы сверхэкспрессии и / или репортера люциферазы показали, что IRF11 может транскрипционно индуцировать активность ISRE и экспрессию IFN типа I, IFNc и IFNh, а также стимулированного IFN гена Mx, таким образом ингибируя рабдовирус Siniperca chuatsi ( SCRV), как указано в сниженной экспрессии генов вирусных белков. Таким образом, предполагается, что IRF11 у мандаринов и, вероятно, у других костистых рыб может проявлять свой противовирусный эффект за счет активации IFN и ISG типа I.
中文 翻译 :
IRF11 调节 man 鱼 Siniperca chuatsi 中 的 I 型 IFN 转录 和 抗 病毒 反应。
脊椎动物 中 , 据 报道 共有 11 种 干扰素 (IFN) 调节 因子 (IRFs) , 即 IRF1 IRF11 , 在 所有 的 脊椎动物 中 均 存在 IRF1 至 IRF9 保守。 但是 , 仅 在 鱼类 和 鸟类中 报告 了 IRF10 IRF11 似乎 是 鱼类 的 IRF。 在 这项 中 , 发现 普通 вирус 鱼 Siniperca chuatsi 中 的 IRF11 荧光 11.中。 过 和 / 荧光 基因 检测 结果 表明 IRF11 可以 转录 ISRE , 并 诱导 I 型 IFN , IFNc 和 IFNh 以及 IFN Mx u 从而 抑制 Siniperca ch.状 病毒 (SCRV) 复制 , 如 病毒 蛋白 基因 降低 所 指示。 因此 , 建议 man 和 其他 硬 骨 鱼 中 使用 IRF11 可以 通过 上调 I 型 IFN 和 ISG 发挥 其 抗病毒作用。
Ifn-β-кондиционированные дендритные клетки | Энциклопедия
1.Введение
Иммунотерапия рака обычно направлена на стимуляцию или усиление противоопухолевого иммунного ответа у онкологических пациентов. Среди различных иммунотерапевтических подходов терапевтические противораковые вакцины разработаны для того, чтобы дать иммунной системе команду идентифицировать и уничтожить опухолевые клетки, одновременно предохраняя нормальные клетки и ткани от иммунной атаки, предположительно предотвращая нежелательные побочные эффекты. Противораковые вакцины обладают потенциалом для борьбы с опухолями в виде монотерапии или в сочетании с другими формами иммунотерапии, а также с неиммунными методами лечения, такими как лучевая терапия или химиотерапия.В частности, у пациентов с минимальной остаточной болезнью после удаления опухоли этот терапевтический вариант может привести к увеличению выживаемости и улучшению качества жизни. Вследствие недавнего успеха ингибиторов иммунных контрольных точек (ICI) в лечении онкологических больных [1] дендритные клетки (DC), специализирующиеся на сенсибилизации лимфоцитов к опухолевым антигенам, вновь приобрели интерес в качестве важнейших клеточных адъювантов в иммунотерапии. подходы. В частности, вакцины на основе DC и блокада контрольных точек Т-клеток могут действовать как синергические партнеры, поскольку ингибиторы контрольных точек просто действуют как усилители иммунных ответов, и их эффективность пропорциональна уже существующему количеству опухолеспецифических Т-клеток в месте опухоли. .
2. Связь между IFN типа I и DC при отторжении рака
DC — это профессиональные антигенпрезентирующие клетки (APC), действующие на границе раздела между окружающей средой и иммунной системой и преодолевающие разрыв между врожденным и адаптивным иммунитетом [2] . Благодаря своей уникальной способности захватывать и обрабатывать антигены в периферической крови и тканях, DC играют решающую роль в инициации первичных иммунных ответов. При созревании / активации DC претерпевают фенотипические изменения, увеличивают экспрессию MHC и костимулирующих молекул и повышают выработку цитокинов.Зрелые DC быстро мигрируют в дренирующие лимфатические узлы, чтобы примировать наивные Т-клетки и инициировать адаптивный иммунный ответ [2] . С момента их открытия было показано, что происхождение DC является сложным и включает множество различных подмножеств: обычные DC (cDC), плазмоцитоидные DC (pDC), клетки Лангерганса и DC, полученные из моноцитов (moDC). DC привлекли к себе большое внимание как потенциальные лекарственные средства для клеток при приготовлении терапевтических противораковых вакцин. Вакцинация против рака проводилась с использованием реинфузии определенных популяций DC, полученных ex vivo из периферической крови, включая использование BDCA1 + cDC и pDC [3] [4] [5] .Однако дефицит этих подмножеств DC в периферической крови до сих пор накладывал серьезные ограничения на их использование в клинических условиях. Следовательно, в большинстве вакцин на основе ДК используются moDC, дифференцированные ex vivo из моноцитов, культивируемых в присутствии IL-4 и GM-CSF или других цитокинов, из-за относительной легкости выделения большого количества этих клеток из периферической крови. Однако выбор оптимального протокола генерации DC in vitro для приготовления клинически эффективных терапевтических противораковых вакцин по-прежнему представляет собой серьезную проблему.Хотя оптимальные условия культивирования для создания наиболее эффективных moDC все еще остаются спорными, некоторые группы, включая нашу, показали, что частично зрелые и высокоактивные moDC из моноцитов крови могут быть быстро получены в присутствии IFN-α и GM-CSF (IFN -DC) [6] [7] .
Хотя IFN типа I (IFN-α и IFN-β; далее IFN-I) изначально характеризовался своей противовирусной активностью [8] , он также известен как опосредующий антипролиферативный и противоопухолевый эффекты и оказался наиболее полезным и широко распространенным. ранжирующий биологический агент против нескольких опухолей [9] .IFN-α использовался для лечения выбранных опухолей, включая меланому и рак почек, показывая свою лучшую эффективность при гематологических злокачественных новообразованиях, таких как волосатоклеточный лейкоз, хронический миелоидный лейкоз и фолликулярная лимфома [10] . Прямым доказательством активности IFN-α как в B-, так и в T-клеточных лимфомах низкой степени злокачественности является регресс неопластических поражений кожи и конъюнктивы после повторных инъекций in situ этого плейотропного препарата [11] [12] . В случае солидных опухолей результаты были более разочаровывающими.Однако существуют данные, показывающие, что IFN-α может быть полезен против рака на ранних стадиях, но гораздо менее эффективен против установленных или метастатических опухолей [13] . Из-за побочных эффектов системного введения высоких доз IFN-α у онкологических больных и разработки более эффективных лекарств и протоколов первоначальный интерес к терапии на основе IFN быстро угас. И наоборот, растет интерес к иммуномодулирующей роли IFN типа I, поскольку значительный объем доказательств ясно демонстрирует, что IFN-α может соединять врожденный и адаптивный иммунитет за счет своего воздействия на дифференцировку / активацию DC, смещая функции DC в сторону прайминга и расширение защитных противоопухолевых иммунных ответов [14] [15] .Также были проведены исследования по оценке прямого действия IFN-α на экспериментальные и обычные вакцины у мышей и людей [16] . Тем не менее, в нескольких пилотных исследованиях также предпринимались попытки оценить возможную иммуномодулирующую активность этих цитокинов в стратегиях вакцинации. В некоторых из них IFN-α индуцировал улучшенные иммунологические ответы [17] [18] [19] или повышенную иммуногенность пептидов [20] [21] [22] .В целом, эти результаты полностью согласуются с исследованиями, проведенными за последние 20 лет, показывающими важность генерации высокоактивных DC под действием IFN-α и индукции адаптивного иммунитета. Ле Бон и др. продемонстрировали, что DC являются клетками, опосредующими адъювантный эффект IFN-I in vivo, индуцируя долгосрочную продукцию антител и иммунологическую память против слабо иммуногенного антигена [23] . Кроме того, активация DC IFN типа I может способствовать спонтанным иммунным ответам на опухолевые клетки, включая перекрестный прайминг опухолеспецифических Т-лимфоцитов CD8, [24] [25] [26] [27] .Таким образом, иммунный ответ отторжения рака, по-видимому, использует воспалительные механизмы, напоминающие механизмы, активируемые при ранней противовирусной защите, опосредованной высвобождением IFN типа I из pDC и макрофагов [28] . С этой точки зрения, IFN-α может быть вовлечен в провоспалительное состояние, способствующее превращению моноцитов in vivo в DC, инициируя противовирусные и противоопухолевые специфические иммунные ответы. Фактически, значительные количества IFN типа I могут высвобождаться локально в месте инфекции или воспаления.Это может способствовать дифференцировке циркулирующих моноцитов в активированные ДК, опосредуя активацию естественных клеток-киллеров, генерацию Th2-поляризованного Т-хелперного ответа и индукцию цитолитического ответа как против вирусов, так и против раковых клеток. Стоит упомянуть, что инфильтрация IFN-DC была продемонстрирована при регрессе поражений кожи контагиозным моллюском, характеризующихся накоплением pDC и местным продуцированием IFN типа I [29] . Разумно, что условия культивирования, разработанные для генерации IFN-DC in vitro, могут воспроизводить естественную цитокиновую среду, позволяющую быстро дифференцировать DC от моноцитов in vivo, и могут рассматриваться как физиологический путь превращения моноцитов в DC.
3. IFN-α-Кондиционированные дендритные клетки (IFN-DC)
IFN-α и IFN-β по-разному модулируют активацию / созревание DC, в зависимости от экспериментальной модели и условий культивирования. Действительно, было показано, что IFN-α заметно увеличивает созревание DC [30] [31] [32] . Более того, IFN-α может взаимодействовать с полиинозиновой: полицитидиловой кислотой (pI: C) и «классическим» коктейлем поляризующих цитокинов типа 1, что позволяет бессывороточно генерировать полностью зрелые поляризованные поляризованные типа 1 DC (DC1) [ 33] [34] , обеспечивая DC с различными хемоаттрактивными свойствами [35] .Однако в 1998 году стало очевидно, что IFN-α сам по себе способен управлять дифференцировкой моноцитов крови в DC [36] . Вскоре после этого наша группа сообщила, что трехдневное культивирование в присутствии IFN-α и GM-CSF может превращать моноциты крови в полностью функциональные и частично зрелые DC (IFN-DC) без добавления факторов созревания или дальнейших этапов культивирования. [6] [7] . С тех пор многочисленные исследования подтвердили, что ИФН типа I может эффективно индуцировать дифференцировку моноцитов крови в ДК, способствуя смещенному ответу Th2, огромной продукции IFN-γ и эффективному размножению эффекторных Т-клеток CD8 [37] [38] ] [39] [40] [41] .В результате транскрипционной сигнатуры IFN-α IFN-DC демонстрирует отличительные молекулярные и функциональные особенности, демонстрируя более продвинутый фенотип созревания по сравнению с обычными moDC, полученными с IL-4 и GM-CSF, с более высокими уровнями костимулирующей экспрессии. молекул, а также различные количества маркера созревания CD83 [6] [7] . Они также демонстрируют смешанные признаки естественных киллеров (NK-клетки) и pDC со значительными уровнями CD123 [7] [29] [38] .
IFN-DC может эффективно инициировать адаптивный иммунный ответ благодаря высокой экспрессии некоторых важных молекул, участвующих в процессинге, миграции и локализации антигена в лимфатических узлах [28] [29] . IFN-DC обладают улучшенным миграционным ответом на хемокины и экспрессируют очень высокие уровни CCR5. Они также проявляют повышенный ответ на его лиганды CCL5, CCL3, CCL4. Значительная часть IFN-DC также экспрессирует интегрин α4 и CCR7 [42] .
Более того, IFN-DC демонстрируют улучшенный миграционный ответ на CCL19 и экспрессируют значительные уровни самих CCL19 вместе с CCL18 и CXCL10 [42] . Следует отметить, что высокие уровни хемоаттрактантных белков моноцитов (MCP), CXCL2 и CXCL-3 придают IFN-DC способность эффективно опосредовать рекрутирование других врожденных эффекторных клеток, а также продукцию цитокинов с перекосом по Th2 [38] [ 43] . Несмотря на свое продвинутое состояние созревания, IFN-DC сохраняют эффективную фагоцитарную активность [7] , быстро приобретая полностью зрелый фенотип при взаимодействии с лимфоцитами периферической крови (PBL) [44] .IFN-DC может захватывать апоптотические клетки через рецептор-поглотитель лектин-подобного окисленного LDL-рецептора-1 (LOX-1) и перекрестно презентировать свои антигены CD8 + Т-клеткам. [45] . IFN-DC также имеют прямую лицензию для CD4-независимого праймирования CD8 + Т-клеток, нацеливания антигена на молекулы класса I, кросс-презентации очень эффективных малых количеств растворимых белков в CD8 + Т-клетки [46] . И незрелый, и зрелый IFN-DC экспрессируют большое количество субъединиц иммунопротеасом (LMP2, LMP7 и MECL1) вместе с повышенными уровнями TAP1, TAP2, калнексина, кальретикулина, тапазина и молекул HLA класса I [47] [48] .Такое функциональное отношение IFN-DC приводит к очень эффективному запуску специфических CD8 T-лимфоцитов, специфичных для субдоминантного MHC-I-рестриктированного вирусного эпитопа и MART-127–35 эпитопа [48] . Примечательно, что улучшенная способность IFN-DC защищать интернализованные белки от ранней деградации и эффективно направлять антигены по пути процессинга MHC-I, обеспечивает длительную способность перекрестного праймирования [49] . Это предполагает потенциальную способность IFN-DC удерживать антигены в лимфатических узлах в течение длительного периода после их поглощения, что позволяет обнаруживать и привлекать редкие специфические предшественники CD8 + Т-клеток, что имеет важное значение для разработки терапевтических вакцин на основе DC.Важно отметить, что IFN-DC также управляет праймингом наивных CD4 T-клеток, что приводит к массивной экспансии CD4 Th2 клеток, продуцирующих CXCR3 + IFN-γ [50] . IFN-DC экспрессируют высокие уровни Fas-L и TRAIL, оказывая прямое противоопухолевое действие [6] [38] [39] [44] . Сходным образом, недавно была описана важная роль трансмембранного TNF-α как медиатора киллерной активности IFN-DC, которая становится дефектной у пациентов с глиомой высокой степени злокачественности [51] .Прямая цитотоксическая активность IFN-DC против опухолевых клеток представляет собой важную функциональную особенность, поскольку она может способствовать поглощению опухолевого антигена, что приводит к более ранней и улучшенной индукции противоопухолевого иммунного ответа.
4. IFN-DC в иммунотерапии ракаIFN-DC — хороший кандидат для клинического применения вакцины у онкологических больных. По сути, можно предусмотреть два основных способа разработки новых методов лечения на основе IFN-DC: стандартное введение IFN-DC, содержащего аутологичные опухолевые клетки, и внутриопухолевую вакцинацию, основанную на концепции предварительного кондиционирования опухоли с иммуногенной гибелью клеток. агентов, за которыми следует выгруженный IFN-DC.Оба подхода в конечном итоге приведут к перекрестной презентации ассоциированных с опухолью антигенов Т-клеткам CD8 и их активации. Важно отметить, что нагруженные IFN-DC цельные опухолевые клетки ex vivo или in vivo обладают преимуществом индукции иммунитета против всего набора антигенов, экспрессируемых опухолью, обеспечивая более широкий и эффективный противоопухолевый иммунный ответ. В этом отношении вакцина IFN-DC на основе цельных опухолевых клеток, индуцированных для иммуногенной гибели клеток, может представлять собой оптимальный антигенный состав для загрузки IFN-DC.
Рисунок 1. Возможное клиническое использование IFN-DC в вакцинации против рака. Пациенты проходят лейкаферез для сбора PBMC и очистки моноцитов крови, необходимых для образования IFN-DC. Большое количество частично созревшего IFN-DC можно легко получить за один раз из очищенных моноцитов периферической крови, культивируемых в присутствии IFN-α и GM-CSF, загруженных или не содержащих опухолевые антигены, и криоконсервированных в готовых к употреблению используйте аликвоты для запрограммированных циклов лечения.Слева изображена прототипная стратегия внутриопухолевой вакцинации, основанная на концепции предварительного кондиционирования опухоли иммуногенными агентами гибели клеток с последующим введением незагруженного IFN-DC. Внутриопухолевые инъекции контролируются ультразвуком и выполняются радиологом для обеспечения правильного введения. В левой правой части рисунка показана стратегия терапевтической вакцинации. IFN загружают in vitro выбранным составом опухолевых антигенов и вводят внутрикожно, в непосредственной близости от подмышечных и паховых лимфатических узлов или непосредственно в здоровый лимфатический узел.В обеих стратегиях циклы лечения повторяются с двухнедельными интервалами. IFN-DC характеризуются способностью высвобождать уникальный набор цитокинов и хемокинов, которые, как известно, способствуют ответу типа Th2 и мощно стимулируют клеточные иммунные ответы CD8 + Т-клеток, а также способствуют ответу антител изотипа IgG1 [6] .
Вероятно, монотерапия на основе IFN-DC может развиться в режимах комбинаторной терапии без химиотерапии с антителами, ингибирующими иммунные контрольные точки, а также с иммуномодулирующими или эпигенетическими препаратами.Блокада тормозных путей или активация способствует примированию Т-лимфоцитов CD8 после вакцинации. Ингибирование Treg снижает супрессорную активность этих клеток в отношении эффекторных Т-клеток CD8 + . Блокада взаимодействия PD-1 / PD-L1 реактивирует обезвреженные клетки CD8 и противоопухолевые эффекторные функции. Привлекательным иммуномодулирующим препаратом, который можно комбинировать с терапией на основе IFN-DC, является леналидомид, поскольку он действует путем повышения противоопухолевого иммунитета и модификации микроокружения опухоли.Также эпигенетические методы лечения рака, включая ингибиторы ДНК-метилтрансферазы (DNMTi), ингибиторы гистон-деацетилазы (HDACi) и ингибиторы гистон-метилтрансферазы (HMTi), могут стимулировать противоопухолевый иммунитет как в опухолевых клетках, так и в эффекторных иммунных клетках хозяина.
Запись с номера 10.3390 / Vacines8040617.
Holiday Inn Club Vacations запускает кампанию «Тени надежды», посвященную месяцу осведомленности о раке молочной железы
GlobeNewswire
Регистрируется рынок Geohazard 4.7% CAGR до 2028 г .; Внедрение новейших технологий для разработки точного оборудования для стимулирования роста рынка: Fortune Business Insights ™
Ключевые компании, включенные в отчет об исследовании рынка геологической опасности: Geosyntec Consultants, Fugro, Penspen, Geo Serve Arabia, SRK Consulting, Benthic, RINA, WSB, Lloyd’s Register, Applus + Velosi, GeoStabilization International, Schlumberger, Geofem Ltd, Gardline Limited, Maccaferri, через + Visitless Integrity Assessment Ltd. Пуна, Индия, 23 марта 2021 г. (GLOBE NEWSWIRE) — По прогнозам, размер глобального рынка геологических опасностей достигнет 910 долларов США. .2 миллиона к 2028 году, при этом среднегодовой темп роста в прогнозируемый период составит 4,7%. Fortune Business Insights ™ делится этой информацией в своем отчете под названием «Рынок геологических опасностей, 2021–2028 годы». Согласно отчету, стоимость рынка в 2020 году составила 629,9 миллиона долларов США. Центр исследований в области эпидемиологии стихийных бедствий База данных чрезвычайных событий (EM-DAT) упомянул в своем отчете, что в 2018 году пострадали почти 3,5 миллиона человек. по geohazards. Эти природные происшествия ложатся тяжелым финансовым бременем на страны во всем мире.Правительства по всему миру и лидеры отрасли сосредотачиваются на использовании новейших технологий для эффективной оценки таких бедствий. В мае 2020 года Департамент транспорта Калифорнии (Caltrans) выделил Калифорнийскому университету штата Калифорния 1,5 миллиона долларов США. Грант направлен на создание исследовательской программы по сейсмической геологической опасности с целью оценки и решения сложных проблем геологической опасности. Запрос на образец брошюры в формате PDF: https://www.fortunebusinessinsights.com/enquiry/request-sample-pdf/geohazard-market-105033 Сегментация рынка Мы классифицировали рынок на основе услуг, конечных пользователей и географии.С точки зрения обслуживания рынок подразделяется на исследования участков, оценку рисков, моделирование и другие. В зависимости от конечного пользователя он разделен на нефтегазовую, морскую, жилую и коммерческую, инфраструктурную и т. Д. Наконец, на основе географии он делится на Северную Америку, Европу, Южную Америку, Азиатско-Тихоокеанский регион, Ближний Восток и Африку. Что предлагает отчет? В отчете представлен подробный анализ ключевых аспектов рынка, а именно доминирующих компаний, конечных пользователей и ведущих типов продуктов.Помимо этого, отчет содержит осязаемую информацию о текущих и будущих рыночных тенденциях и освещает важные события в отрасли. В дополнение к этим факторам, отчет дает целостное представление об основных драйверах, ограничениях и сегментах, которые способствуют росту рынка. Движущие силы и ограничения Использование искусственного интеллекта для разработки продуктов для стимулирования роста Чтобы лучше подготовиться к геологическим угрозам, таким как землетрясения, цунами и оползни, лидеры отрасли во многом полагаются на инновации.Производители начинают использовать новейшие доступные технологии для разработки систем, способных анализировать условия и лучше прогнозировать возникновение геологической опасности. Такие технологии, как искусственный интеллект (AI), широко используются компаниями для повышения точности. По оценкам, эта растущая зависимость от передовых технологий стимулирует рост глобального рынка геологических опасностей. Например, компания ИИ под названием Minerva Intelligence Inc. подписала контракт с White Gold Corp.(WGO) в апреле 2020 года, чтобы определить и понять геохимические отношения, существующие между различными структурами. Цель состоит в том, чтобы помочь компании расширить геологоразведочные работы на различных объектах. Однако высокая стоимость, связанная с внедрением сложных датчиков в сочетании с расходами на ремонт, по оценкам, повысит спрос на системы оценки геологической опасности. Щелкните здесь, чтобы узнать о краткосрочном и долгосрочном влиянии COVID-19 на этот рынок. Посетите: https: // www.fortunebusinessinsights.com/enquiry/queries/geohazard-market-105033 Региональные исследования Высокий спрос на энергию в Азиатско-Тихоокеанском регионе для стимулирования роста в регионе Рыночная стоимость Азиатско-Тихоокеанского региона в 2020 году составила 198,54 миллиона долларов США. доля рынка в прогнозный период. Растущие потребности в энергии, вызванные быстро растущим населением, приведут к увеличению числа построений электростанций в основных развивающихся странах, что повысит спрос на системы оценки геологической опасности в регионе.Кроме того, согласно прогнозам, увеличение объемов морской деятельности из таких стран, как Индия и Китай, будет способствовать дальнейшему усилению роста. Ожидается, что рынок в Северной Америке продемонстрирует устойчивый рост в течение прогнозируемого срока. Многочисленные региональные организации и учреждения внедряют заводы и оборудование для исследовательских и производственных целей в различных частях региона. Это будет стимулировать рост рынка в регионе. Конкурентная среда Сотрудничество с лидерами отрасли, чтобы помочь ключевым игрокам обосноваться в ключевых регионах Ключевые игроки, работающие на рынке, сосредоточивают внимание на сотрудничестве с известными предприятиями нефтегазовой отрасли с целью расширения своего бизнеса в ключевых регионах.Например, в сентябре 2020 года Fugro подписала контракт с Oil and Natural Gas Corporation Limited (ONGC). В соответствии с трехлетним контрактом, компания должна освоить участки ONGC на западном и восточном побережьях Индии. Запросите настройку: https://www.fortunebusinessinsights.com/enquiry/customization/geohazard-market-105033 Изменения в отрасли: в мае 2020 года Hilcorp Alaska LLC получила разрешение от Bureau of Ocean Energy Management (BOEM). Получив разрешение, компания приступила к проведению исследования по расчистке территории с геологической опасностью в заливе Кука, Аляска.Список ключевых компаний, включенных в отчет о рынке геологических опасностей: Geosyntec Consultants (США) Fugro (Нидерланды) Penspen (Великобритания) Geo Serve Arabia (Саудовская Аравия) SRK Consulting (Канада) Benthic (США) RINA (Италия) WSB (США) Lloyd’s Register ( Великобритания) Applus + Velosi (Кувейт) GeoStabilization International (США) Schlumberger (США) Geofem Ltd (Кипр) Gardline Limited (Великобритания) Maccaferri (Италия) через + Visitless Integrity Assessment Ltd. (Канада) Быстрая покупка — Geohazard Market: https: // www .fortunebusinessinsights.com / checkout-page / 105033 Основное содержание: Введение Объем исследования Сегментация рынка Методология исследования Определения и допущения Краткое содержание Рыночная динамика Драйверы рынка Ограничения рынкаОбновления рынка Основные выводы Ключевые новые тенденции — для основных стран Ключевые изменения в отрасли Анализ нормативной базы Анализ влияния отрасли воздействия COVID-19 COVID-19 на рынок геологических опасностей Шаги, предпринятые правительством для преодоления воздействия Разработки отраслевых игроков в ответ на COVID-19 Потенциальные возможности и проблемы, связанные со вспышкой COVID-19 Анализ глобального рынка геологических опасностей (в миллионах долларов США), аналитическая информация и прогноз, 2017-2028 гг. ОценкаМоделированиеДругой анализ рынка, аналитическая информация и прогноз — по конечным пользователям Нефть и газ Морская и жилая и коммерческая инфраструктураДругой анализ рынка, аналитические данные и прогнозы — по регионам Северная АмерикаЕвропаАзия Тихоокеанский регион Ближний Восток и АфрикаЛатинская Америка TOC Продолжение.. Поговорите с нашим аналитиком: https://www.fortunebusinessinsights.com/enquiry/speak-to-analyst/geohazard-market-105033 Ознакомьтесь с выводами соответствующих исследований: размер рынка геотехнических услуг, доля и анализ воздействия COVID-19, Автор Тип (пространство подземного города, склон и выемка грунта, земля и фундамент), по конечному пользователю (муниципальные, мосты и туннели, нефть и газ, горнодобывающая промышленность, морское хозяйство, строительство зданий и др.) И региональный прогноз, 2020-2027 гг. Объем рынка осветлителей, доля и отраслевой анализ, по типу (флокулянты, органические коагулянты, неорганические коагулянты, стабилизаторы pH), по применению (коммунальное хозяйство, целлюлозно-бумажная промышленность, текстильная промышленность, нефтехимия, металлургия и горнодобывающая промышленность, другие) и региональный прогноз, 2019 г. -2026.Размер рынка с нулевым сбросом жидкости, доля и анализ отрасли, по технологиям (на основе термической обработки, на основе мембран), по областям применения (энергия и энергия, продукты питания и напитки, химическая и нефтехимическая промышленность, текстильная промышленность, фармацевтика, другие) и региональный прогноз, 2019–2026 гг. Размер рынка частотно-регулируемых приводов HVAC, доля и анализ воздействия Covid-19, по типу (привод переменного тока, привод постоянного тока и сервопривод), по диапазону мощности (микро, низкая, средняя и высокая), по применению (жилое, коммерческое и Промышленный) и региональный прогноз, 2020-2027 гг.Размер рынка промышленных древесных пеллет, доля и анализ воздействия COVID-19, по видам сырья (лесные отходы, сельскохозяйственные отходы и другие), по областям применения (производство электроэнергии и комбинированное производство тепла и электроэнергии [ТЭЦ ]) и региональный прогноз, 2020–2027 гг.

 Карачаево-Черкессия
Карачаево-Черкессия

