Порядок ликвидации юридических лиц | ФНС России
Дата публикации: 02.04.2020 14:23
За 2019 год из Единого государственного реестра юридических лиц было исключено более 3000 организаций, обладающих признаками недействующих либо имеющих запись о недостоверности сведений. Исключение таких организаций по решению налоговых органов может повлечь в дальнейшем негативные последствия для их учредителей и руководителей. Налоговые органы рекомендуют, в случае отсутствия финансово-хозяйственной деятельности, принимать решение о ликвидации юридического лица в добровольном порядке. Порядок ликвидации юридического лица определен статьями 61-64 Гражданского кодекса РФ.
Решение о ликвидации принимается общим собранием участников. Кроме того, нужно сформировать ликвидационную комиссию или назначить ликвидатора.
С момента назначения ликвидатора (формирования ликвидационной комиссии) к нему (к ней) переходят полномочия по управлению делами юридического лица.
В течение 3 рабочих дней после даты принятия решения о ликвидации нужно представить в регистрирующий орган уведомление по форме № Р15001 (утверждена приказом ФНС России от 25.
Ликвидационная комиссия обязана опубликовать в журнале «Вестник государственной регистрации» и Едином федеральном реестре юридически значимых сведений о фактах деятельности юридических лиц, индивидуальных предпринимателей и иных субъектов экономической деятельности (www.fedresurs.ru) сообщение о ликвидации, а также о порядке и сроке заявления требований кредиторами общества. Этот срок не может быть менее 2 месяцев с момента публикации сообщения о ликвидации.
В этот период ликвидационная комиссия выявляет кредиторов и завершает расчеты с ними, а также предпринимает действия по сбору дебиторской задолженности.
По истечении 2 месяцев со дня публикации ликвидационная комиссия обязана составить промежуточный ликвидационный баланс. Об этом необходимо сообщить в регистрирующий орган путем представления уведомления по форме № Р15001. После завершения всех расчетов с кредиторами в регистрирующий орган необходимо представить заявление о государственной регистрации юридического лица в связи с его ликвидацией (форма № Р16001) ликвидационный баланс, утвержденный учредителями, документ об оплате государственной пошлины.
Документы могут быть поданы в налоговую инспекцию любым удобным способом: лично руководителем ликвидационной комиссии; через представителя по нотариально удостоверенной доверенности; по почте с объявленной ценностью и описью вложения либо в электронном виде. При направлении документов для государственной регистрации в форме электронных документов, в том числе через МФЦ и нотариуса, уплачивать государственную пошлину не требуется. Воспользоваться услугой электронной регистрации можно на сайте ФНС России.
Ликвидация юридического лица считается завершенной, а юридическое лицо — прекратившим существование после внесения сведений о его прекращении в Единый государственный реестр юридических лиц.
Ликвидация и исключение организаций из ЕГРЮЛ
Ликвидация с последующим исключением сведений о компании из ЕГРЮЛ подразумевает полное прекращение деятельности фирмы. Она утрачивает свой статус юридического лица и лишается права на осуществление экономической деятельности.
Ликвидация возможна:
- На основании решения учредителей организации в добровольном порядке;
- По решению суда в случае серьезных нарушений действующего законодательства;
- По решению регистрирующего органа, в роли которого выступает налоговая служба.
Самое неприятное — это ликвидация ООО по инициативе регистрирующих органов, в особенности после недавних, датированных 2017 годом, изменений в ст. 21.1 в ФЗ «О госрегистрации ЮЛ и ИП».
Смотрите также:
Договор субаренды
Указанная выше статья регламентирует все ситуации, касающиеся исключения юрлица из реестра по инициативе ФНС. В частности, налоговая вправе исключить учреждение из ЕГРЮЛ по своему собственному решению в случаях, если:
-
ООО на протяжении 12 месяцев перед решением ФНС об исключении не сдает налоговую отчетность и не ведет каких-либо операций по счету.
 ФНС вправе посчитать такое учреждение недействующим и исключить из реестра.
ФНС вправе посчитать такое учреждение недействующим и исключить из реестра. - Предприятие не может быть ликвидировано ввиду отсутствия финансовых средств на проведение ликвидационной процедуры, а также эти расходы не могут быть отнесены на участников юридического лица;
- Отметка в ЕГРЮЛ о недостоверности сведений, которая сохраняется 6 месяцев со дня внесения и если не принимаются меры к их исправлению.
Раньше ФНС исключала по своему решению лишь «пустышки», которые не вели свою деятельность, то теперь серьезную угрозу нормальной деятельности организаций представляют и полномочияналоговиков по исключению ввиду недостоверности сведений о фирме. В 2018 году по этим основаниям было исключено свыше 1,5 тыс. юридических лиц.
Типичная ситуация: юридический адрес ООО в 2018 году был помечен как «недостоверный», и компания не смогла или не захотела вносить верные сведения.
В каких случаях ФНС ставит отметку о недостоверности
При проведении проверочных мероприятий госорган может отметить представленные в ЕГРЮЛ сведения как недостоверные. Чаще всего это:
- Данные об учредителях, в том числе в случае «множественности» учредителя, когда одно и то же лицо значится в 5 и более юр лицах в составе учредителей;
- Отсутствие компании по юридическому адресу, неполучение ей корреспонденции и отсутствие директора по этому же адресу. ФНС тщательно проверяет, присутствует ли офис фирмы по указанным данным или же нет.
Организации, которые осуществляли смену юридического адреса ООО в 2018 году столкнулись с очень строгими требованиями налоговой к месту осуществления деятельности:
-
Должны быть представлены документы, свидетельствующие о праве пользоваться указанным в документах адресом: сведения о собственности, договор аренды, гарантийное письмо, сведения о регистрации директора (если ООО оформлено по месту жительства руководства) и т.

- Адрес должен быть указан максимально подробно, вплоть до этажа и номера комнаты;
- Место регистрации не должно быть «множественным» — если на одну и ту же комнату, здание или этаж уже зарегистрировано 5 и более компаний, то ФНС вполне могла признать место регистрации множественным и поставить метку о недостоверности.
- Указанный в ЕГРЮЛ юридический адрес явно должен иметь признаки нахождения по нему компании: офис директора и хотя бы один сотрудник, получение корреспонденции из налоговой, наличие документов фирмы и т.д.
Смотрите также:
Порядок ликвидации юридических лиц
В итоге в 2018 году многие компании, для которых место регистрации носило лишь сугубо формальный характер, оказались на грани исключения из реестра в одностороннем порядке со стороны регистрирующего органа.
Что делать, если ФНС хочет исключить компанию из ЕГРЮЛ?
Когда по факту недостоверной информации в реестре фискальный орган инициирует процедуру удаления фирмы из ЕГРЮЛ, следует придерживаться такого порядка действий:
- Устранить обстоятельства, которые повлекли простановку отметки о недостоверности сведений;
-
Направить не позднее 3 месяцев с даты публикации решения ФНС об исключении огрганизации мотивированное заявление, в котором указать об устранении всех неточностей в ЕГРЮЛ.

- Обратиться в ФНС с заявлением о внесении изменений ЕГРЛ в части сведений, которые госорган признал недостоверными.
При грамотном и оперативном исправлении недостоверных данных есть шанс избежать удаления из реестра и продолжить деятельность компании в штатном режиме. И разумеется лучше постоянно держать руку на пульсе компании, не допуская длительного нахождения указания о неверности информации в реестре.
Подробнее о том, что делать, если налоговая выставила отметку о недостоверности, мы уже писали ранее.
Примеры ситуаций, когда ФНС признает адрес недостоверным
- При направлении писем от госоргана все они возвращаются с отметкой о том, что такого получателя по указанному адресу не существует или же возвращаются ввиду истечения срока хранения.
-
При непосредственном выезде по месту регистрации общества с ограниченной ответственностью налоговики не обнаруживают ни вывески юрлица, ни офиса.

- Предприятие оформлено по адресу с указанием лишь номера офисного строения, без конкретизации – этажа, комнаты, подъезда и так далее.
Возможно как наличие одного признака, так и нескольких. Оптимальным способом избежать санкций со стороны регоргана будет либо фактическое размещение офиса по выбранному адресу или же оформление услуги почтового обслуживания, чтобы избежать внимания ФНС.
Как правило, проверки на предмет достоверности сведений инициируются лишь после первых тревожных звоночков – например, постоянного возврата документов.
Как проходит процедура исключения из ЕГРЮЛ
Процедура исключения юридического лица из ЕГРЮЛ по решению налоговой выглядит следующим образом:
-
ФНС устанавливает наличие оснований для удалениясубъекта экономической деятельности и из реестра в одностороннем порядке и выносит решение об этом.

- Решение органа подлежит обязательной публикации в «Вестнике Государственной регистрации» и в срок не позднее трех дней со дня принятия такого решения.
- В течение трех месяцев представитель юридического лица, кредиторы и прочие заинтересованные лица подают в ФНС мотивированные заявления о нарушении их прав односторонним исключением компании из ЕГРЮЛ.
- При наличии обоснованных возражений и претензий со стороны кредиторов и иных лиц административное исключение компании из ЕГРЮЛ не производится.
Однако в дальнейшем, даже если фирма не будет исключена из реестра, недостоверный юридический адрес ООО как в 2018, так и в 2019 году доставитв дальнейшем массу проблем компании в ее нормальной деятельности.
Как минимум это:
- Недоверие контрагентов и отказ от проведения любых сделок;
- Проблемы с обслуживанием в банках;
- Риск для учредителей, которые управляют еще несколькими компаниями – они так же могут попасть во внимание ФНС;
-
Постоянно сохраняющаяся угроза повторной инициации механизма удаления из реестра в административном порядке.

Если же внесению отметки о недостоверности предшествовала смена юридического адреса ООО в 2018 году, забракованный госорганом, то лучше подобрать качественный адрес для своего бизнеса и избавиться от неприятной отметки в реестре.
Последствия ликвидации и исключения ООО в административном порядке
В случае если недействующее юридическое лицо исключается из ЕГРЮЛ или же аналогичные меры применяются к компании, имеющей признаки недостоверности сведений об адресе или учредителях, для ООО наступают последствия, описанные в статье 3 ФЗ «Об ООО» №14-ФЗ с изменениями от 08 июня 2018 года.
В основном это субсидиарная ответственность учредителей и руководства предприятия, если их действия прямо или косвенно повлекли к ликвидации юрлица и нарушению прав и интересов кредиторов, а также третьих лиц. Требование о возмещении вреда подается в арбитражный суд по месту регистрации учредителей или иных лиц, в отношении которых подается иск о привлечении к субсидиарной ответственности.
Уже состоявшееся удаление из реестра юрлицо только может обжаловать в суд не позднее 1 года со дня внесения записи. Но судебная практика показывает, что обжалование таких случаев практически бесполезно, ведь 6 месяцев отметки о недействительности сведений более чем достаточно для устранения всех недостатков. И если представитель бизнеса мер к исправлению данных не принял, то и требовать признания исключения незаконным через суд он не вправе.
Могут ли исключить фирму с долгами?Вполне. При наличии отметки о недостоверности ФНС исключает предприятие без оглядки на долги. При этом если фирма задолжала государству, то такие долги могут быть списаны как безнадежные.
При этом судьба неисполненных обязательств перед кредиторами, которые пропустят публикацию решения о прекращении деятельности фирмы, никого не волную. Кредиторам в дальнейшем придется требовать взыскать сумму долга с учредителей или руководства ООО в субсидиарном порядке.
При возникновении проблем из-за недостоверной информации в ЕГРЮЛ по мнению налоговой, лучше обратиться за профессиональной помощью к опытным специалистам.
Юристы не только помогут подобрать «чистый» юридический адрес, но и помогут в дальнейшем избавиться от всех неприятных примечаний в реестре и восстановят нормальную работу компании.Автоматическая ликвидация по решению налоговой. Особенности и последствия
Если директор бросил фирму, и ее признали недействующей — ФНС имеет право самостоятельно исключить компанию из ЕГРЮЛ. Однако такой способ не заменяет официальную добровольную ликвидацию.
Подробнее:
Что такое недействующая фирма
Юридическое лицо не ведет деятельность, если в течение последних 12 месяцев:
- Не сдавалась налоговая отчетность;
- Не было операций по расчетному счету.

[ст. 21.1 ФЗ «О государственной регистрации юридических лиц и индивидуальных предпринимателей»]
ФНС учитывает нулевую отчетность. Если компания не работает, но в течение года хотя бы один раз сдала нулевую отчетность — она не считается недействующей. ФНС не ликвидирует ее в одностороннем порядке.
Задолженность перед государством не списывается. При ликвидации по инициативе налоговой компания обязана заплатить налоги и взносы в ПФР и ФСС. Закрыть фирму с долгами перед бюджетом и фондами невозможно.
Всегда ли ФНС закрывает недействующие фирмы?
Нет. Исключить из реестра брошенную фирму — право налоговой службы, однако она не обязана этого делать. ФНС может закрыть компанию через несколько лет или не закрыть совсем.
Бросить фирму без деятельности. Последствия
1. Субсидиарная ответственность для учредителей. Ликвидация по решению налоговой службы не избавляет от штрафов за несданную отчетность.
Возможно ли взыскать долг, если на балансе нет средств и имущества?
Да. Учредители обязаны оплатить задолженность в полном объеме — если на счету фирмы нет средств, наступает субсидиарная ответственность. Долги накапливаются за весь период, пока компания не сдавала отчетность.
[п. 3.1 ст. 3 ФЗ №14 «Об обществах с ограниченной ответственностью», вступ. в силу 28.06.2017]
Ликвидируем фирму за 3 месяца
Восстановим отчетность, составим ликвидационный баланс.
Бесплатная консультация: +7 812 507 65 85
2. Дисквалификация учредителей и директора. Если ФНС ликвидировала компанию без деятельности, учредитель и директор попадают под санкции. В течение 3 лет они не вправе регистрировать новые юридические лица и руководить другими фирмами.
[ст. 23 ФЗ №129 «О государственной регистрации юридических лиц и индивидуальных предпринимателей»]
Вывод
Нет смысла бросать фирму и ждать, пока налоговая ее ликвидирует.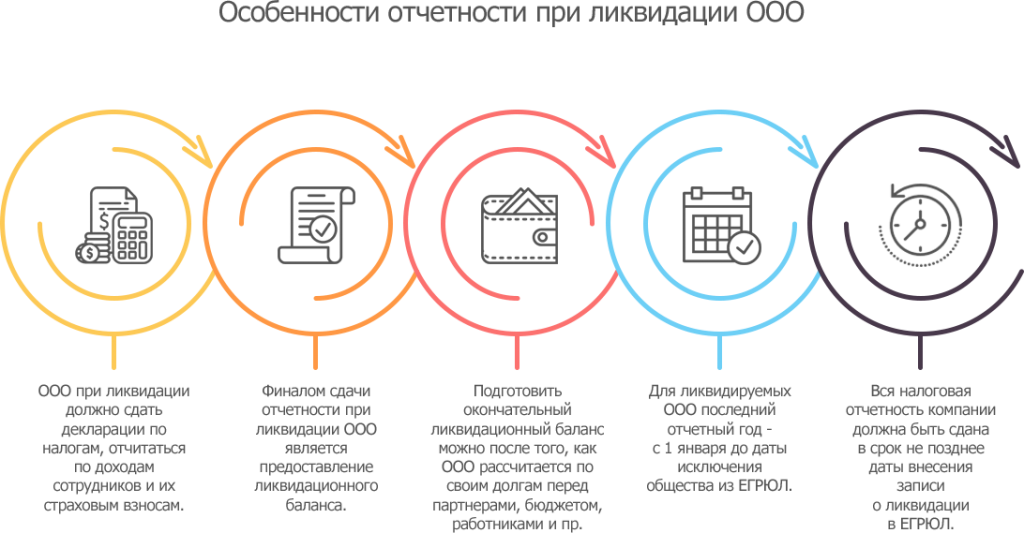 За это время учредители накопят долги и потеряют возможность открыть новый бизнес.
За это время учредители накопят долги и потеряют возможность открыть новый бизнес.
Как ликвидировать фирму без последствий
С учетом последних поправок в закон о ликвидации единственный способ — официальная ликвидация по решению учредителей.
Официальная ликвидация в компании «Кодекс»
С 2007 года мы закрыли более 1000 компаний без проверки — поэтому гарантируем:
Сроки. Через 3 месяца вы получаете свидетельство о ликвидации — указываем период в договоре.
Подачу с первого раза. Оформляем документы по требованиям ФНС — без отказов в налоговой.
Консультации. Бесплатно, в течение всей процедуры. По телефону, на выезде или в нашем офисе.
Как получить бесплатную консультацию
Заполните и отправьте заявку ниже. Юрист свяжется с вами и проконсультирует по вопросам ликвидации юридических лиц.
БЕСПЛАТНАЯ
консультация с юристом
✓ Анализ ситуации ✓ Разработка стратегии
Отправьте заявку и юристсвяжется с Вами в течение 10 минут
Ваши персональные данные нигде не
публикуются.
Ликвидация ООО через ИФНС под ключ в Москве, помощь в закрытии общества с ограниченной ответственностью по инициативе налоговой по низким ценам, стоимость услуг оформления документов для прекращения деятельности ООО в налоговой инспекции
В практике предпринимателей ликвидация ООО через и ФНС встречается не часто. Несмотря на полномочия налоговой принимать такие решения самостоятельно, есть ряд обязательных процедур, которые должны быть выполнены.
Несмотря на полномочия налоговой принимать такие решения самостоятельно, есть ряд обязательных процедур, которые должны быть выполнены.
Принудительно ликвидировать ООО можно лишь в случае, когда деятельность велась с нарушением правил, прописанных в законодательстве, либо существуют формальные признаки того, что деятельность не осуществляется.
Причины закрыть общество через ИФНС
Основаниями для ликвидации, которые может увидеть налоговый орган по закону являются:
- Отсутствие предоставленных отчетов в налоговую (нет операций по банковским счетам в течение года).
- Выявление допущенных во время регистрации общества нарушений закона.
- Отсутствие лицензий для законного ведения предпринимательства.
- Многократные нарушения компанией требований закона и некоторые другие основания.
Закрыть компанию в обход судебного порядка можно, если выявлены обстоятельства прописанная в положениях ст. 21.1 закона 129-ФЗ, все иные случаи позволяют налоговой лишь выступать инициатором для возбуждения производства дела об упразднении компании в суде.
21.1 закона 129-ФЗ, все иные случаи позволяют налоговой лишь выступать инициатором для возбуждения производства дела об упразднении компании в суде.
Внесудебный порядок
Применяя внесудебный порядок упразднения компании налоговая должна выполнить следующие процедуры:
- Принять решение о том, что фирма исключается из ЕГРЮЛ, в связи с тем, что она признана недействующей.
- Публикация сведений в ВГР. Информация публикуется в порядке, в котором принимаются заявления от кредиторов общества.
- Принятие заявлений от кредиторов и других контрагентов общества.
Судебный порядок
Если налоговая инициирует начало процедуры прекращения юр. лица через суд, это проходит в следующем порядке:
- В арбитражный суд направляется иск о ликвидации компании.
- Судом после проверки выявляются признаки, которые служат основанием присвоить компании статус недействующей.
- Создается ликвид.
 комиссия (публикуются объявления ВГР).
комиссия (публикуются объявления ВГР). - Формируется промежуточный ликвидационный баланс.
- Удовлетворяются требования кредитора и в ЕГРЮЛ заносится запись о том, что компания закрыта либо объявлена банкротом.
Как видно, принудительно ликвидировать ООО через ИФНС можно в суде либо в досудебном порядке. Закон устанавливает жесткие требования к проведению этих процедуры. Правовое сопровождение всех этапов ликвидации фирмы, инициатором которой стала налоговая необходимо во избежание нарушений прав компании.
Квалифицировано определить возможность применения налоговым органом того или другого способа закрытия фирмы может только специалист в этой сфере правоотношений. Любые предпосылки возникновения правового конфликта с налоговым органом обуславливают необходимость непосредственного участия специалиста в области права для возможности сбалансированного урегулирования спора. Профессионалы нашей компании обеспечат полное правовое сопровождение процедуры ликвидация ООО через ФНС и проконтролируют законность действий налоговой.
Ликвидация ООО: инструкция из 10 шагов
Налоговая ликвидация ООО возможна как в добровольном, так и в судебном порядке (ст. 61 ГК РФ). Чаще всего наши клиенты хотят закрыть компанию по собственной инициативе. Стоит отметить, что этот процесс требует знания юридических нюансов и отнимает много времени. Проще продать свою долю в компании третьим лицам или прибегнуть к реорганизации. Если эти варианты вам не подходят — воспользуйтесь понятной инструкцией.
1. Принимаем решение о ликвидации ООО
В зависимости от числа участников общества такое решение принимает общее собрание или единственный учредитель. По итогу составляем протокол (решение). Затем назначаем ликвидационную комиссию, в которую входит учредитель, директор, главбух и юрист, а также составляем еще один протокол (решение) — о ликвидации.
Альтернативный вариант — организовать комиссию из единственного человека — ликвидатора.Обратите внимание, что этот человек будет представлять фирму в суде, а также нести полную ответственность за долги перед ИФНС и кредиторами (ст. 62 ГК РФ).
2. Уведомляем налоговую о ликвидации ООО
В течение трех дней ликвидационная комиссия подает в ИФНС уведомление по форме Р15001 с нотариальным заверением, а также протокол собрания (решение). Еще через пять дней налоговики внесут запись в ЕГРЮЛ и выдадут копию листа о внесении данных в госреестр. Обратите внимание: ПФР и ФСС уведомлять о грядущем закрытии ООО не нужно.
3. Публикуем сообщение в СМИ
Чтобы информация о приближающейся ликвидации ООО была открытой, публикуем ее в СМИ. Для этого подойдет лишь одно издание — «Вестник государственной регистрации» (приказ ФНС России № САЭ-3-09/355@ от 16.06.2006). В нем публикуют информацию о ближайших закрытиях предприятий.
4. Сообщаем кредиторам о ликвидации ООО
Мало заказать публикацию на полосах «Вестника». Нужно уведомить кредиторов о запуске процедуры закрытия фирмы письменно. В письме указываем порядок выставления требований и сроки — не менее 60 дней. Отправляем корреспонденцию заказными письмами с уведомлением о вручении. У вас останутся доказательства получения писем контрагентами, если кто-то из них подаст в суд.
Нужно уведомить кредиторов о запуске процедуры закрытия фирмы письменно. В письме указываем порядок выставления требований и сроки — не менее 60 дней. Отправляем корреспонденцию заказными письмами с уведомлением о вручении. У вас останутся доказательства получения писем контрагентами, если кто-то из них подаст в суд.
5. Объясняем ситуацию сотрудникам и центру занятости
Не позднее, чем за два месяца до сокращения, говорим о ликвидации ООО работникам. Сделать это нужно не только устно, но и письменно через специальное уведомление с пометкой об увольнении по инициативе работодателя в связи с прекращением деятельности фирмы. Аналогичное уведомление, как в пункте 5, отправляем в центр занятости.
6. Направляем отчетность в контролирующие органы
После фактического увольнения и расчета сотрудников отправляем отчетность за сотрудников:
- в Пенсионный фонд (СЗВ-СТАЖ),
- в Фонд соцстраха (4-ФСС)
- в ФНС (Единый расчет по страховым взносам).

7. Готовимся к инспекции после ликвидации ООО
Как только ФНС получила уведомление о ликвидации, налоговики имеют право провести выездную проверку. При этом не важно, как давно была проведена крайняя проверка. Чтобы спрогнозировать вероятность такого «сюрприза» и оценить шансы на положительный результат проверки, не лишним будет консультация юриста.
8. Составляем промежуточный ликвидационный баланс
Истек срок предъявления требований кредиторов, указанный в «Вестнике» — составляем промежуточный ликвид-баланс. Оформляем документ для ликвидации ООО по общим правилам бухучета и указываем в нем:
- сведения об имуществе организации,
- информацию о требованиях, предъявленных кредиторами,
-
результаты анализа требований кредиторов.

Утверждаем составленный документ на общем собрании или единолично, оформив соответствующий протокол или решение. Затем приносим в ИФНС:
- уведомление по форме Р15001 с нотариальным заверением,
- промежуточный ликвидационный баланс,
- протокол (решение) об утверждении ПЛБ,
- документ, подтверждающий публикацию о ликвидации ООО в «Вестнике».
В течение пяти дней ФНС внесет записи в ЕГРЮЛ и даст вам копию листа, подтверждающего внесение изменений в госреестр.
9. Гасим долги и делим оставшиеся активы ООО
Выплачиваем долги в следующем порядке:
-
Гражданам, которым компания должна деньги за причиненный моральный вред, вред жизни или здоровью.

- Работникам по трудовому договору, в т.ч. деньги на зарплаты и выходные пособия.
- Бюджету и внебюджетным фондам, в т.ч. налоги, штрафы, страховые взносы.
- Другим кредиторам по оставшимся долгам.
Если денег не хватает, выставляем имущество на публичные торги. Если вырученных средств снова не хватает, ликвидатор обращается в арбитражный суд с заявлением о банкротстве. Рекомендуем сделать это еще до запуска процедуры налоговой ликвидации ООО, если вы знаете, что у компании не хватит активов для расчета со всеми очередями кредиторов.
Как только все долги погашены, ликвидатор составляет окончательный ликвидационный баланс. Он содержит сведения об активах, которые остались в собственности и будут распределены между участниками в соответствии с их долями.Не забудьте утвердить документ на общем собрании участников или единолично.
Подаем окончательные документы для ликвидации ООО
Когда все готово, в ИФНС по месту регистрации подаем окончательный пакет бумаг:
- заявление по форме Р16001 с заверением нотариуса,
- окончательный ликвид-баланс,
- протокол (решение) об утверждении ОЛБ,
- налоговую декларацию,
- квитанцию об оплате госпошлины — 800 ₽.
Справки из фондов об отсутствии долгов сдавать не надо — их запрашивает налоговый инспектор. Через пять дней ФНС ликвидирует ООО и выдаст лист, подтверждающий внесение записи о закрытии фирмы в ЕГРЮЛ по форме №Р50007. После этого закрываем счет в банке, уничтожаем печать и сдаем документы в архив.
Как быстро провести ликвидацию ООО в Москве?
Обратитесь к специалистам компании «Дельта Финанс». Наш бухгалтер оформит ликвидационные балансы и налоговую декларацию, специалист по документообороту подготовит протоколы и заявления по актуальным формам, а юрист решит все споры с ИФНС по месту регистрации бизнеса. Пишите и звоните — мы всегда поможем вам! Телефон +7 (495) 230-20-11, WhatsApp +7 (925) 301-09-56.
Перечень документов, представляемых в налоговый орган после завершения процесса ликвидации юридического лица
Перечень документов, представляемых в налоговый орган после завершения процесса ликвидации юридического лица.
Внимание! Документы представляются в налоговый орган после завершения процесса ликвидации юридического лица.1. Заявление о государственной регистрации юридического лица в связи с его ликвидацией по форме N 15016.(См. требования к оформлению формы N Р15016, образцы заполнения формы).
(См. образцы баланса, образцы протоколов об утверждении (промежуточного, окончательного) ликвидационного баланса).
Внимание! С 01.01.2019 государственная пошлина не уплачивается в случае направления в регистрирующий орган документов в форме электронных документов через сайт ФНС России, Единый портал государственных и муниципальных услуг, МФЦ или нотариуса.О применении льготы по государственной пошлине см.:
— письма
Минфина России.
4. Документ, подтверждающий представление в территориальный орган Пенсионного фонда РФ сведений в соответствии с:- пп. 1 — 8 п. 2 ст. 6 и п. 2 ст. 11 Федерального закона от 01.04.1996 N 27-ФЗ «Об индивидуальном (персонифицированном) учете в системе обязательного пенсионного страхования».Внимание! В случае, если документ, подтверждающий представление в территориальный орган ПФР сведений, не представлен заявителем, указанный документ (содержащиеся в нем сведения) предоставляется по межведомственному запросу налогового органа соответствующим территориальным органом ПФ РФ в электронной форме в порядке и сроки, которые установлены Правительством РФ;- ч.
 4 ст. 9 Федерального закона от 30.04.2008 N 56-ФЗ «О дополнительных страховых взносах на накопительную часть трудовой пенсии и государственной поддержке формирования пенсионных накоплений».5. Определение арбитражного суда о завершении конкурсного производства (при ликвидации юридического лица в случае применения процедуры банкротства).
4 ст. 9 Федерального закона от 30.04.2008 N 56-ФЗ «О дополнительных страховых взносах на накопительную часть трудовой пенсии и государственной поддержке формирования пенсионных накоплений».5. Определение арбитражного суда о завершении конкурсного производства (при ликвидации юридического лица в случае применения процедуры банкротства). Открыть полный текст документа
налоговая, порядок, этапы. Последствия принудительной ликвидации учредителя, директора
22.09.2021
Ликвидация ООО с долгами в 2021 году
Узнайте как ликвидировать ООО с долгами в 2021 году, способы и пошаговая инструкция…
Посмотреть24.08.2021
Какие отчёты сдавать при ликвидации ООО в 2021 году
Узнайте какая отчетность нужно сдавать при ликвидации ООО в 2021 году? Какие отчеты,…
Посмотреть18.08.2021
Как закрыть АО (ЗАО, ПАО) в 2021 году?
Как закрыть АО (ЗАО, ПАО) в 2021 году: виды, этапы, сроки и особенности ликвидации…
Посмотреть16. 08.2021
08.2021
Где узнать о ликвидации юридического лица
Как и где в 2021 году узнать о том, ликвидирована ли организация? Как проверить ООО…
Посмотреть28.06.2021
Как закрыть ООО без долгов: пошаговая инструкция
Как быстро закрыть ООО без долгов в 2021 году? Получите пошаговую инструкцию, образцы…
Посмотреть02.06.2021
Лицензионный договор на товарный знак
Договор на использование товарного знака: образец договора, необходимые документы.…
Посмотреть02.06.2021
Устав ООО с двумя учредителями в 2021 году
Устав ООО с двумя учредителями в 2021 году: образец стандартного устава. Какие особенности…
Посмотреть02.06.2021
Регистрация ИП без госпошлины
Регистрация ИП без госпошлины в 2021 году: как открыть ИП через МФЦ, варианты регистрации.…
Посмотреть28.04.2021
Банкротство ИП в 2021 году – процедура, сроки, порядок, последствия, стоимость, документы
Банкротство ИП с долгами по налогам, кредитам (несостоятельность). Как индивидуальному…
Как индивидуальному…
28.04.2021
Доверенность на регистрацию ООО
Доверенность на регистрацию юридического лица: можно ли открыть ооо по доверенности,…
Посмотреть28.04.2021
Как продлить товарный знак
Продление товарного знака: как продлить срок товарного знака, размер госпошлины.…
Посмотреть19.03.2021
Ликвидация фонда в 2021 году
Ликвидация фонда в 2021 году: пошаговая инструкция, причины, последствия, срок ликвидации,…
Посмотреть18.03.2021
Ликвидация бюджетного учреждения в 2021 году
Ликвидация казенного учреждения в 2021 году: пошаговая ликвидация. Основания для…
Посмотреть18.03.2021
Как получить лицензию на аптеку
Получение лицензии для аптеки: нужна ли лицензия на аптечную деятельность, какие…
Посмотреть18.03.2021
Как закрыть обособленное подразделение
Как закрыть обособленное подразделение предприятия (обособку): снятие с учета, этапы…
Посмотреть02. 03.2021
03.2021
Присоединение ООО
Реорганизация ооо в форме присоединения в 2021 году: какие бывают виды организации,…
Посмотреть02.03.2021
Ликвидационная комиссия
Ликвидационная комиссия: кто входит в состав, кто формирует, какие имеет права и…
Посмотреть02.03.2021
Документы для участия в тендерах
Как подготовиться к тендеру в 2021 году: какие документы нужны для заказчика и поставщика,…
Посмотреть19.02.2021
Ликвидация НКО в 2021
Как ликвидировать НКО в 2021 году: порядок и пошаговая инструкция, причины и способы…
Посмотреть19.02.2021
Ликвидация АНО в 2021 году
Как ликвидировать АНО в 2021 году: порядок и пошаговая инструкция, причины и способы…
Посмотреть19.02.2021
Регистрация АНО в 2021 году
Как зарегистрировать АНО в 2021 году: порядок и пошаговая инструкция. Образец заполнения…
Посмотреть16. 02.2021
02.2021
Пошаговая инструкция по ликвидации ООО в 2021 году
Пошаговая инструкция по ликвидации ООО в 2021 году 🔥 Порядок, сроки закрытия фирмы,…
Посмотреть28.01.2021
Списание долгов через банкротство
Списание долгов по кредиту через банкротство. Процедура списания долга для физических…
Посмотреть27.01.2021
Признание банкротства недействительным
Признание сделок недействительными при банкротстве, основания, как составить заявление…
Посмотреть27.01.2021
Закрытие расчетного счета при ликвидации ООО
Закрытие расчетного счета при закрытии ООО. Как составить заявление на закрытие,…
Посмотреть26.01.2021
Как ликвидировать ООО самостоятельно
Ликвидация ООО самостоятельно: инструкция, порядок действий, как провести ликвидацию…
Посмотреть14.01.2021
Мифы о банкротстве
Развенчиваем мифы о банкротстве. Положения о банкротстве гражданина. Разбор важных…
Разбор важных…
14.01.2021
Регистрация СНТ
Регистрация СНТ в 2021 году: как зарегистрировать дачный дом или земельный участок,…
Посмотреть14.01.2021
Упрощенная система налогообложения (УСН)
Упрощенная система налогообложения (УСН): как перейти на упрощенную систему, образец…
Посмотреть14.01.2021
Общая система налогообложения (ОСНО)
Общая система налогообложения в 2021 году — какие налоги платят по ОСНО, можно ли…
Посмотреть14.01.2021
ЕСХН (Единый сельскохозяйственный налог)
ЕСХН в 2021 году: какие налоги платим, какую отчетность сдаем. Доходы на налог, льготы…
Посмотреть14.01.2021
Регистрация ИП от А до Я
Как зарегистрировать ИП в 2021 году. Документы, как составить заявление, пошаговая…
Посмотреть14.01.2021
Госпошлина за регистрацию ИП
Госпошлина за регистрацию ИП в 2021 году: как оплатить. скачать квитанцию, как вернуть…
скачать квитанцию, как вернуть…
14.01.2021
Как зарегистрировать некоммерческую организацию
Регистрация НКО в 2021 году: порядок, формы регистрации некоммерческих организаций,…
Посмотреть14.01.2021
Юридическая консультация по жилищным вопросам
Юридическая консультация по жилищным вопросам. Куда можно обратиться за консультацией,…
Посмотреть14.01.2021
Как зарегистрировать ООО на домашний адрес
Можно ли зарегистрировать ООО на домашний адрес учредителя. Как поменять юридический…
Посмотреть14.01.2021
Уставной капитал при регистрации ООО
Внесение уставного капитала при регистрации ООО в 2021 году: размер, порядок, что…
Посмотреть14.01.2021
Ликвидация ООО с одним учредителем
Как ликвидировать ООО с одним учредителем в 2021 году. Образец решения о закрытии…
Посмотреть14.01.2021
Выход участника из ООО
Выход участника из ООО в 2020 году: изменения выхода участника, пошаговый выход из…
Посмотреть14. 01.2021
01.2021
Как ликвидировать ООО налоговой инспекцией
Ликвидация ООО по инициативе налоговой инспекции: принудительное закрытие общества,…
Посмотреть14.01.2021
Способы альтернативной ликвидации
Как ликвидировать ООО альтернативными способами. Цена и риски альтернативного закрытия.…
Посмотреть14.01.2021
Увольнение директора при ликвидации ООО
Увольнение директора в связи с ликвидацией ООО. Основания для ликвидации, как написать…
Посмотреть14.01.2021
Ликвидация филиала организации
Ликвидация филиала организации: процедура закрытия филиала, порядок ликвидации, причины…
Посмотреть14.01.2021
Самостоятельная регистрация ИП
Как самостоятельно зарегистрировать ИП: пошаговая инструкция для начинающих. Варианты…
Посмотреть14.01.2021
Что лучше выбрать в 2021 году: ИП или ООО
Чем отличается ИП от ООО? Какую лучше выбрать форму бизнеса в 2021 году.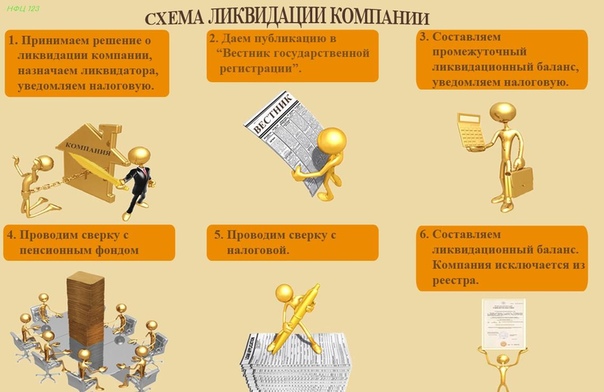 Наглядная…
Наглядная…
14.01.2021
Открытие расчетного счета для ИП и ООО
Открытие расчетного счета в банке: как оформить заявку, порядок, какие документы…
Посмотреть14.01.2021
Стоимость юридического адреса
Стоимость юридического адреса, какой существует диапазон цен, порядок регистрации,…
Посмотреть14.01.2021
Самостоятельная регистрация ООО
Как самостоятельно открыть ООО. Пошаговая инструкция, необходимые документы. Ответы…
Посмотреть14.01.2021
Поиск покупателя и переоформление фирмы
Поиск покупателя и переоформление фирмы — полезная информация от экспертов «Бизнес-Гарант».…
Посмотреть14.01.2021
Проверка и мониторинг контрагентов
Сервис проверки и анализа российских юридических лиц и предпринимателей. Только актуальные…
Посмотреть14.01.2021
Юридические консультации в Самаре и Тольятти
Консультация юристов и адвокатов в Самаре и Тольятти от Бизнес-Гарант. Гражданское,…
Гражданское,…
14.01.2021
Список документов для ликвидации ООО
Список документов для ликвидации ООО. Какие документы нужны, сколько хранить документы…
Посмотреть14.01.2021
Как открыть фирму в 2021 году
Как открыть фирму в России в 2021 году: с чего начать, процедура регистрации, необходимые…
Посмотреть14.01.2021
Зачем бизнесу юридическое сопровождение
Юридическое сопровождение бизнеса: зачем нужно, понятие правового сопровождения,…
Посмотреть14.01.2021
Как избавиться от долгов законно в 2021 году
Легальные способы избавиться от долгов в 2021 году. Как снизить долговую нагрузку…
Посмотреть14.01.2021
Как правильно закрыть компанию через банкротство
Банкротство компании. Какие могут быть плюсы и минусы, целесообразность, как можно…
Посмотреть14.01.2021
Как выжить бизнесу в кризис
Как сохранить свой бизнес в кризис: сокращение издержек, оптимизация кадровой политики,…
Посмотреть14. 01.2021
01.2021
Юридическое сопровождение в торгах и тендерах
Почему нужно доверить юридическое сопровождение в торгах и тендерах профессионалам.…
Посмотреть14.01.2021
Как ликвидировать компанию в 2021 году
Как ликвидировать компанию: пошаговая инструкция,последствия, сроки, документы, стоимость.…
Посмотреть14.01.2021
Закрыть компанию или подождать?
Продолжить работать и трансформироваться или закрыть бизнес? Как понять, что пора…
Посмотреть14.01.2021
Ликвидационный баланс при ликвидации ООО
Ликвидационный баланс в 2021 году: образец документа, составление и заполнение ликвидационного…
Посмотреть31.12.2020
Проверка регистрации ООО и ИП
Проверка регистрации ООО и ИП в 2020 году. Как узнать, зарегистрировано ли ООО или…
Посмотреть25.12.2020
Перерегистрация ИП
Как переоформить ИП в другой регион, при смене прописки, возможно ли переписать ИП…
Посмотреть22. 12.2020
12.2020
Реализация залогового имущества при банкротстве
Залоговое имущество при банкротстве физических лиц. Продажа, порядок реализации и…
Посмотреть15.12.2020
Упрощенное банкротство через МФЦ в 2021 году
Упрощенное банкротство физических лиц через МФЦ в 2021 году (внесудебное банкротство):…
Посмотреть10.12.2020
Оспаривание сделок должника при банкротстве
Оспаривание сделок должника при банкротстве физических и юридических лиц: срок исковой…
Посмотреть10.12.2020
Арбитражный управляющий при банкротстве
Арбитражный управляющий при банкротстве физических и юридических лиц. Кто назначает,…
Посмотреть24.11.2020
Банкротства АО
Процедура банкротства акционерного общества: услуга по сопровождению банкротства…
Посмотреть11.11.2020
Ликвидация ООО через продажу со сменой юридического адреса
Как ликвидировать ООО через продажу со сменой юридического адреса. Особенности и…
Особенности и…
10.11.2020
Ликвидация ООО с нулевым балансом
Ликвидация ООО с нулевым балансом — пошаговая инструкция. Ошибки, которых следует…
Посмотреть26.10.2020
Регистрация обособленного подразделения
Регистрация обособленного подразделения (ОП) в 2020 году: филиал или представительство.…
Посмотреть22.10.2020
Регистрация унитарного предприятия (УП)
Государственная регистрация унитарного предприятия — порядок регистрации, перечень…
Посмотреть13.10.2020
Алкогольная лицензия в 2021 году: документы, требования, госпошлина, порядок получения, проверки и продления
Как получить лицензию на алкоголь в 2021 году — требования к оформлению лицензии,…
Посмотреть02.10.2020
Срок регистрации ООО в 2020 году
Каковы же реальные сроки регистрации ООО? Обычно создание ООО занимает от 7 рабочих…
Посмотреть16. 09.2020
09.2020
Причины и основания для отказа в ликвидации ООО
Причины и основания для отказа в ликвидации юр лиц (ООО). Помощь юристов при отказе…
Посмотреть13.09.2020
Последствия ликвидации ООО
Последствия ликвидации юридического лица (ООО) для учредителя, директора: налоговые,…
Посмотреть08.09.2020
Причины отказа в государственной регистрации юридического лица
Причины отказа в государственной регистрации юридических лиц (ООО). Обжалование решения,…
Посмотреть19.08.2020
Защита товарного знака
Защита товарного знака, законные способы решения проблем в вопросе посягательства…
Посмотреть17.08.2020
В каких случаях ликвидацию могут оспорить
В каких случаях ликвидацию могут оспорить — полезная информация от экспертов «Бизнес-Гарант».…
Посмотреть26.06.2020
Когда ликвидация компании «внезапно» становится банкротством. И когда так лучше не делать
И когда так лучше не делать
При ликвидации компании в установленном законом порядке должно соблюдаться одно важное…
Посмотреть02.06.2020
Удастся ли сохранить активы в коронакризис. И что делать тем, кому не повезет
Коронавирусная истерия потихоньку спадает. И бизнес остается один на один с тем,…
Посмотреть26.05.2020
Мораторий на банкротство: предсмертная агония должников или реальная мера поддержки?
Нет такой компании, которая не почувствовала бы на себе последствия коронавирусной…
Посмотреть19.05.2020
Бизнес в ауте. Как выиграть на последних минутах?
Мечта об успешном бизнесе давно рухнула. Погибшее дело жизни – теперь только груда…
Посмотреть21.04.2020
У меня нет лица: 5 проблем, которые у вас возникнут при отсутствии товарного знака
«Бизнес-Гарант» о том, почему так важно защитить свой бренд В условиях кризиса…
Посмотреть21. 04.2020
04.2020
Пора снять розовые очки
Добровольная ликвидация до 1 июня принесет компании двойную выгоду — полезная информация…
Посмотреть14.04.2020
Ухожу красиво: как правильно ликвидировать фирму
Современной фотографией мы во многом обязаны компании Kodak и ее основателю Джорджу…
Посмотреть14.04.2020
Дайте бизнесу второй шанс!
Дайте бизнесу второй шанс! Полезная информация от экспертов «Бизнес-Гарант». Для…
Посмотреть25.03.2020
90% предпринимателей не смогут оправиться от вируса
Срываются поставки, контрагенты задерживают оплату. Можно ли в таком случае сослаться…
Посмотреть31.01.2020
Что требуется для открытия автошколы? Какие юридические вопросы лучше решить заранее?
Что требуется для открытия автошколы в 2021 году? Примерный финансовый расчет, этапы,…
Посмотреть24.01.2020
Альтернативная ликвидация фирмы: самый быстрый способ избавиться
Почему вообще возникает необходимость прекращения деятельности когда-то с любовью…
Посмотреть11. 12.2019
12.2019
Зачем ликвидировать предприятие: 21 причина
21 причина зачем ликвидировать ООО. Полезная информация от экспертов «Бизнес-Гарант».…
Посмотреть07.08.2019
Способы ликвидации ООО в 2021 году — узнайте как правильно закрыть фирму
Способы ликвидации ООО или как правильно закрыть фирму — полезная информация от экспертов…
Посмотреть20.09.2018
Судебные споры о банкротстве
Судебные споры о банкротстве, какие правила и требования. Сроки предъявления требований,…
Посмотреть25.05.2017
Необходимые документы для ликвидации и реорганизации предприятий
Бизнес Гарант (полезная информация) — Необходимые документы для ликвидации и реорганизации…
Посмотреть25.05.2017
У кого купить юридический адрес?
У кого купить юридический адрес, какие гарантии? Полезная информация от экспертов…
Посмотреть25.05.2017
Как правильно выбрать юридический адрес?
Как правильно выбрать юридический адрес? — полезная информация от экспертов «Бизнес-Гарант». …
…
25.05.2017
Процедура официальной ликвидации ООО
Как проходит процедура официальной ликвидации ООО — полезная информация от экспертов…
Посмотреть25.05.2017
Уведомление об открытии счета. Как избежать штрафов
Уведомление об открытии счета, как избежать штрафов — полезная информация от экспертов…
Посмотреть25.05.2017
Важные моменты регистрации юридического лица
Важные моменты регистрации юридического лица — полезная информация от экспертов «Бизнес-Гарант».…
Посмотреть25.05.2017
Что лучше – зарегистрировать ООО или купить готовую фирму?
Узнайте что лучше – зарегистрировать ООО или купить готовую фирму? Полезная информация…
Посмотреть25.05.2017
Возможна ли ликвидация без ликвидации?
Возможна ли ликвидация без ликвидации? Эксперты компании «Бизнес-Гарант» ответили…
Посмотреть25.05.2017
Ликвидация ИП по доверенности
Ликвидация ИП по доверенности — полезная информация от экспертов «Бизнес-Гарант».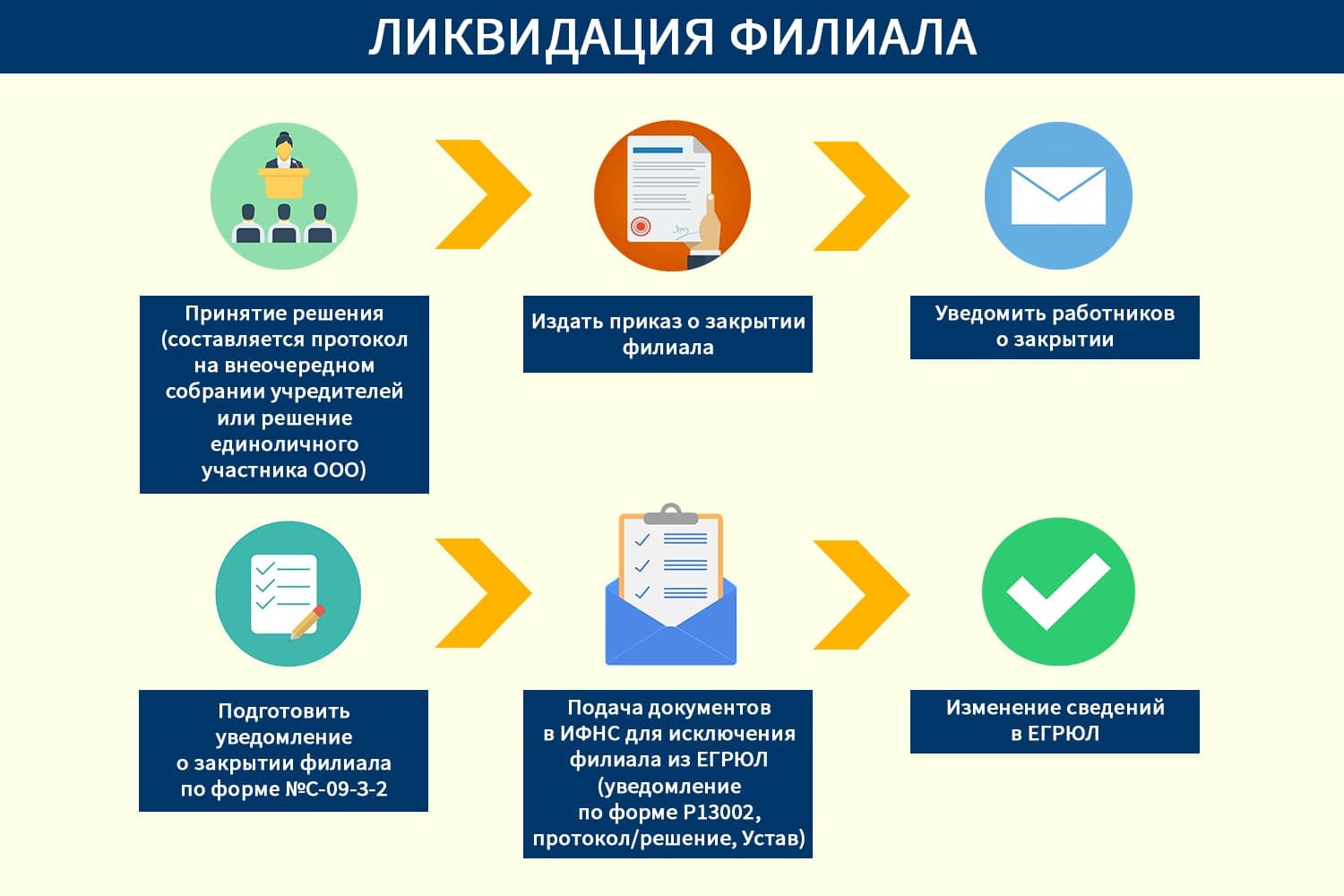 …
…
25.05.2017
Причины ликвидации ИП
Почему зарывают ИП в 2021 году, какие причины для ликвидации индивидуального предпринимателя.…
Посмотреть25.05.2017
Нужна ли перерегистрация ООО при ликвидации фирмы
Нужна ли перерегистрация ООО при ликвидации фирмы — полезная информация от экспертов…
Посмотреть25.05.2017
Очередность погашения долгов при ликвидации ООО
Какие долги нужно погасить в первую очередь при закрытии ООО. Очередность погашения…
Посмотреть25.05.2017
На что необходимо обратить внимание при ликвидации фирмы?
На что нужно обратить внимание при ликвидации фирмы? — полезная информация от экспертов…
Посмотреть25.05.2017
Сроки ликвидации ООО
Сроки ликвидации ООО в каждом из 4 способов закрытия фирмы. Полезная информация от…
Посмотреть25.05.2017
Основания для ликвидации ООО
Какие бывают основания для ликвидации ООО — полезная информация от экспертов «Бизнес-Гарант». …
…
25.05.2017
Образец для заполнения решения о ликвидации ООО
Образец для заполнения решения о ликвидации ООО — полезная информация от экспертов…
Посмотреть25.05.2017
Ликвидация ООО путем смены директора
Альтернативная ликвидация ООО путем смены директора или учредителя. Почему происходит,…
Посмотреть25.05.2017
Пошаговая инструкция по добровольной ликвидации ООО
Пошаговая инструкция по добровольной ликвидации ООО — полезная информация от экспертов…
Посмотреть25.05.2017
Стоимость регистрации ООО
Сколько стоит открыть ООО в 2021 году, на что пойдут эти деньги. Полезная информация…
Посмотреть25.05.2017
Регистрация ООО – пошаговая инструкция
Пошаговая инструкция регистрации ООО — полезная информация от экспертов «Бизнес-Гарант».…
Посмотреть25.05.2017
Порядок регистрации ООО
Порядок регистрации ООО — полезная информация от экспертов «Бизнес-Гарант». Для вас…
Для вас…
25.05.2017
Документы для регистрации ООО в 2021 году — список необходимых документов при создании ООО
Список документов для регистрации ООО — полезная информация от экспертов «Бизнес-Гарант».…
Посмотреть25.05.2017
Необходимые документы для регистрации ИП
Документы для регистрации ИП — узнайте какие документы нужны для открытия ИП. Полезная…
Посмотреть25.05.2017
Заявление на регистрацию ООО
Заявление на регистрацию ООО форма Р11011, как правильно заполнить. Полезная информация…
Посмотреть25.05.2017
Пошаговая инструкция для регистрации ИП
Пошаговая инструкция для регистрации ИП — полезная информация от экспертов «Бизнес-Гарант».…
Посмотреть25.05.2017
Регистрация ООО «под ключ»
Этапы регистрации ООО и сроки открытия фирмы. Полезная информация от экспертов «Бизнес-Гарант».…
Посмотреть25. 05.2017
05.2017
Услуги для юридических лиц
Услуги для юридических лиц — полезная информация от экспертов «Бизнес-Гарант». Для…
Посмотреть25.05.2017
Заявление на регистрацию ИП
Заявление на регистрацию ИП по форме Р21001: какие нюансы, виды деятельности ОКВЭД…
Посмотреть02.11.2016
Единый налог на вмененный доход (ЕНВД)
Единый налог на вмененный доход (ЕНВД) — полезная информация от экспертов «Бизнес-Гарант».…
ПосмотретьЛиквидация ООО
В соответствии с общими правилами распределения, V может выделить только 6000 долларов на распределенную инвентаризацию — это скорректированная база для LLC (Раздел 732 (c) (1)). Это оставляет V с оставшейся базой в размере 4000 долларов в ее интересах, но без других распределенных активов для поглощения дополнительной базы. Следовательно, ей разрешается понести капитальный убыток в размере 4000 долларов США при ликвидации L (Раздел 731 (a) (2)).
Примечание: Прибыль или убыток, признанные при ликвидации, также могут повлиять на расчет чистой прибыли участника для целей 3.Налог на чистый инвестиционный доход 8%. Если какое-либо имущество, кроме денежных средств, рыночных ценных бумаг, дебиторской задолженности и запасов, распределяется в рамках ликвидирующей операции, признание убытков откладывается до тех пор, пока распределенное имущество не будет фактически продано или обменено.
Налоговая база полученного имущества
Если при ликвидационном распределении не признаются прибыли или убытки, совокупная база участника в полученном имуществе равна базе участника в его или ее доле в ООО непосредственно перед распределением, за вычетом распределенных денежных средств и обращающихся на рынке ценных бумаг (п.732 (б)). Специальные правила применяются, когда несколько объектов собственности распределяются в рамках ликвидируемого распределения или когда общая переходящая база распределенных объектов превышает базу участников в LLC. База присваивается распределенной собственности следующим образом:
База присваивается распределенной собственности следующим образом:
Шаг 1: Вычтите сумму денежных средств и обращающихся на рынке ценных бумаг, полученных из суммы предраспределения участия члена в его или ее доле ООО.
Шаг 2: Любая оставшаяся база сначала распределяется на распределенную нереализованную дебиторскую задолженность и запасы в суммах, равных базе LLC в этих активах.
Шаг 3: Оставшаяся база затем распределяется на другие распределенные активы (кроме нереализованной дебиторской задолженности и запасов) в суммах, равных скорректированной базе LLC.
Шаг 4: Любое увеличение базы (т. Е. База распределяемого члена сверх базы LLC в распределенных активах) затем распределяется на оцененные активы (кроме нереализованной дебиторской задолженности и запасов) пропорционально соответствующей сумме каждого актива. любой нереализованной оценки.Однако не следует выделять базу сверх FMV.
Шаг 5: Если есть оставшееся увеличение базиса, которое необходимо распределить, оно распределяется на активы (кроме нереализованной дебиторской задолженности и запасов) пропорционально их FMV.
Примечание: Предлагаемые нормативные акты, выпущенные в январе 2014 года, которые вступят в силу после их выпуска в качестве окончательных нормативных положений, предусматривают особые правила, которые приводят к «корректировке базиса Раздела 704 (c) (1) (C)», когда они встроены. потерянное имущество передается ООО, классифицируемому как партнерство (Проп.Рег. П. 1.704-3 (f) (2)). Предлагаемые правила предусматривают, что если член с гл. 704 (c) (1) (C) базисная корректировка (член Раздела 704 (c) (1) (C)) получает распределение собственности (независимо от того, является ли это свойство Разделом 704 (c) (1) ( C) имущество) при ликвидации своей доли в LLC, скорректированная база LLC в распределенном имуществе непосредственно перед распределением включает в себя разд. 704 (c) (1) (C) член Секции. 704 (c) (1) (C) базовая корректировка для собственности, в которой участник отказался от доли, если таковая имеется, по причине ликвидации.LLC перераспределяет любые Sec. 704 (c) (1) (C) базисная корректировка из разд. 704 (c) (1) (C) собственность, удерживаемая LLC, в отношении распределенных объектов аналогичного характера в соответствии с принципами Regs. П. 1.755-1 (c) (i), после применения пп. 704 (c) (1) (B) и 737.
704 (c) (1) (C) член Секции. 704 (c) (1) (C) базовая корректировка для собственности, в которой участник отказался от доли, если таковая имеется, по причине ликвидации.LLC перераспределяет любые Sec. 704 (c) (1) (C) базисная корректировка из разд. 704 (c) (1) (C) собственность, удерживаемая LLC, в отношении распределенных объектов аналогичного характера в соответствии с принципами Regs. П. 1.755-1 (c) (i), после применения пп. 704 (c) (1) (B) и 737.
Если п. 704 (c) (1) (C) собственность остается за LLC, и никакая собственность подобного характера не распределяется, тогда это собственность Sec. 704 (c) (1) (C) базисная корректировка не перераспределяется в распределенную собственность, а остаток рассматривается как положительный п.734 (б) регулировка. Если распределение также порождает отрицательный разд. 734 (b), затем отрицательная корректировка и разд. 704 (c) (1) (C) перераспределение базисных корректировок зачитывается, и чистая сумма распределяется в соответствии с Рег. П. 1.755-1 (с). Если ООО не имеет гл. 754, действовавшее на момент ликвидации распределения, оно рассматривается как сделавшее разд. 754 выборы исключительно для целей вычисления любого отрицательного Раздела. 734 (b) корректировка, которая возникнет в результате распределения.
1.755-1 (с). Если ООО не имеет гл. 754, действовавшее на момент ликвидации распределения, оно рассматривается как сделавшее разд. 754 выборы исключительно для целей вычисления любого отрицательного Раздела. 734 (b) корректировка, которая возникнет в результате распределения.
Методы амортизации, доступные после ликвидации распределения
Участник, который получает ликвидационное распределение амортизируемого имущества, приобретает амортизируемую основу в этом имуществе. В той степени, в которой база принимающего члена не превышает базу предварительного распределения LLC, участник принимает на себя роль LLC и продолжает амортизировать имущество, используя оставшийся срок службы и метод, используемый LLC (Раздел 168 (i) (7)). Если база участника превышает базу предварительного распределения LLC, избыток рассматривается как вновь приобретенная собственность, которая вводится в эксплуатацию распределителем во время распределения.Эта избыточная база зависит от правил, сроков и методов амортизации, действующих на момент распределения (Раздел 168 (i) (6)).
Срок владения распределенными активами
Период владения участником в отношении имущества, полученного при распределении без налогообложения, включает период владения LLC (Разделы 735 (b) и 1223 (2)). Это правило применяется независимо от того, получает ли участник собственность в текущем распределении или в ликвидируемом распределении.
Приостановленные убытки
Если LLC распределяет активы между участниками в рамках ликвидируемого распределения, и эти активы были использованы в пассивной деятельности, участник продолжает переносить любые убытки от приостановленной пассивной деятельности (PAL) в отношении этой деятельности.Приостановленный PAL разрешен без ограничений, если участник распоряжается практически всей пассивной деятельностью (или его или ее долей в деятельности) в налогооблагаемом отчуждении несвязанной третьей стороне (Раздел 469 (g)). Соответственно, если участник получает только денежные средства при полной ликвидации его или ее доли в ООО, представляется, что любые приостановленные PAL, полученные в результате деятельности ООО, должны полностью вычитаться в год ликвидации.
Любая прибыль, признанная участником при ликвидации ООО, рассматривается как доход от деятельности ООО, подверженной риску (Проп.Рег. П. 1.465-66 (а)). Соответственно, приостановленные убытки, подверженные риску, могут быть использованы для компенсации прибыли, если таковая имеется, при ликвидации. Однако, если нет прибыли от распределения при ликвидации и участник продолжает деятельность, подверженную риску, кажется, что участник должен иметь возможность продолжить перенос приостановленных убытков для компенсации будущих доходов или до тех пор, пока у участника не появится дополнительная база риска. . Эти приостановленные убытки, подверженные риску, могут быть применены только к будущей прибыли или другой будущей основе риска от той же деятельности (разд.465 (б) (5)).
Любые убытки приостановлены из-за отсутствия оснований в соответствии с разд. 704 (d) не переносятся участником после ликвидации LLC. Поскольку убытки не уменьшили базу участника в его или ее доле LLC, приостановленные убытки фактически представляют собой дополнительную основу для участника при (1) определении прибыли или убытка, если таковые имеются, на ликвидационном распределении или (2) определении базы распределенных активов.
Планирование распределительной собственности
Участник, желающий предотвратить признание прибыли при распределении, должен убедиться, что LLC не распределяет денежные средства и рыночные ценные бумаги сверх своей базы в LLC.LLC может произвести ликвидационное распределение денежных средств и обращающихся на рынке ценных бумаг до уровня выходящего на пенсию члена, а затем распределить другое имущество на остаток необходимой суммы.
Предупреждение: IRS переквалифицировало в налогооблагаемое распределение денежных средств распределение личного места жительства партнеру при ликвидации его доли. В разделе «Консультации главного юрисконсульта 200650014» IRS рассмотрела ситуацию, когда товарищество сформировало ООО с целью приобретения дома для распределения его пенсионному партнеру в соответствии с условиями соглашения о выкупе.По условиям соглашения значительная часть покупной цены дома была предоставлена за счет ссуды от связанной стороны, которая была немедленно возвращена выходящим на пенсию партнером.
IRS атаковал предполагаемое распределение на основании того факта, что (1) распределение не было распределением собственности товарищества, поскольку дом был приобретен и удерживался за счет выходящего на пенсию партнера, (2) распределение должно быть изменено в соответствии с правило предотвращения злоупотреблений Regs.П. 1.701-2 в качестве распределения денежных средств налогоплательщику, которые затем он использовал для приобретения дома, (3) согласно доктрине поэтапной сделки приобретение дома товариществом и его распределение между выходящим на пенсию партнером не принимается во внимание, и (4) приобретение дома товариществом и его передача выходящему на пенсию партнеру не имели экономического смысла и были ненужными шагами, предпринятыми исключительно для получения налоговых льгот.
Участник может признать убыток от ликвидации его или ее доли участия в ООО, если распределение состоит исключительно из денег, нереализованной дебиторской задолженности и запасов, а база ООО в этих активах меньше, чем база участия участника в доле ликвидированной ООО. В таких ситуациях убыток, признанный участником, обычно является капитальным убытком. Однако, если LLC владеет гл. 1231, ликвидационное распределение всего или части этого имущества может преобразовать капитальные убытки выходящего на пенсию участника в обычные убытки.
В таких ситуациях убыток, признанный участником, обычно является капитальным убытком. Однако, если LLC владеет гл. 1231, ликвидационное распределение всего или части этого имущества может преобразовать капитальные убытки выходящего на пенсию участника в обычные убытки.
Пример 3. Преобразование капитальных убытков при ликвидационном распределении в обычные убытки: J , A и B являются равными членами BC LLC, которая владеет несколькими небольшими коммерческими зданиями в Уайт-Фиш, Mont. J решил покинуть LLC, а A и B согласились, что FMV его доли составляет 500 000 долларов. У ООО достаточно денежных средств, чтобы произвести один или серию ликвидационных выплат на счет J на полную стоимость его процентов. J ‘ Его процентная ставка BC составляет 600 000 долларов.
Если LLC распределит 500 000 долларов наличными J , он признает капитальный убыток в размере 100 000 долларов. J не имеет текущего или запланированного прироста капитала, поэтому его способность использовать убыток в размере 100 000 долларов США будет ограничен.
J не имеет текущего или запланированного прироста капитала, поэтому его способность использовать убыток в размере 100 000 долларов США будет ограничен.
Предположим, вместо этого, что BC распределяет J 100000 долларов наличными и одно из небольших офисных зданий с FMV 400000 долларов и налоговой базой для BC в размере 300000 долларов. J не будет признавать никаких прибылей или убытков от распределения и будет иметь базу в размере 500 000 долларов в распределенном офисном здании, что является основой его доли LLC после уменьшения на 100 000 долларов полученных денежных средств. (Обратите внимание, что распределение собственности с соответствующим возмещением амортизации может привести к признанию прибыли, если распределение является непропорциональным распределением горячих активов.) Если здание по-прежнему будет гл. 1231 собственность на J , и он продает здание за 400 000 FMV, он реализует сек. 1231 убыток в размере 100 000 долларов США, который будет обычным, если предположить, что у него нет другого Раздела. 1231 выигрыш.
1231 выигрыш.
Замечания по неналоговым налогам
Ликвидация ООО может иметь ряд юридических последствий. В соответствии с законодательством штата могут возникать вопросы относительно того, кто остается ответственным за обязательства LLC, распределенные между участниками, требуемые уведомления кредиторов о намерении LLC ликвидировать, требуемые изменения в праве собственности на распределенные активы, требуемое уведомление государства о намерении LLC ликвидировать , соблюдение применимых актов оптовых продаж (если активы ООО должны быть проданы до ликвидации) и т. д.Кроме того, могут возникнуть юридические проблемы, связанные с применением операционного соглашения или других регулирующих документов ООО к операции по ликвидации. Например, в операционном соглашении может быть неясно, какие методы следует использовать для оценки распределенной собственности, если участники не будут получать пропорциональное распределение всех активов LLC. Клиенты должны проконсультироваться с юристом перед тем, как приступить к ликвидации ООО.
Это тематическое исследование было адаптировано из Руководства PPC по компаниям с ограниченной ответственностью , 21-е издание, Майкла Э.Марес, Сара С. Макмерриан, Стивен Э. Паскарелла II и Грегори А. Поркаро. Опубликовано Thomson Reuters / Tax & Accounting, Кэрроллтон, Техас, 2015 г. (800-431-9025; tax.thomsonreuters.com).
Автор | |
| Альберт Эллентак является советником King & Nordlinger LLP в Арлингтоне, штат Вирджиния. |
Важнейшие роли IFN-β в развитии лимфоидов, миелопоэза и опухоли: связь с фактором некроза опухоли α
Реферат
Мы создали нулевых мышей по IFN-β и сообщаем о различных последствиях IFN-β как для врожденного, так и для адаптивного иммунитета.Несмотря на отсутствие нарушений в пропорциональном балансе популяций CD4 и CD8 Т-клеток в периферической крови, тимусе и селезенке мышей IFN-β — / — , активированные лимфатические узлы и Т-лимфоциты селезенки демонстрируют усиленную пролиферацию Т-клеток и снижение некроза опухоли. продуцирование фактора α по сравнению с мышами IFN-β + / + . Примечательно, что конститутивная и индуцированная экспрессия фактора некроза опухоли α снижена в макрофагах селезенки и костного мозга (BM), соответственно, мышей IFN-β — / — .Мы также наблюдаем измененную архитектуру селезенки у мышей IFN-β — / — и уменьшение количества резидентных макрофагов. Мы идентифицируем потенциальный дефект созревания В-клеток у мышей IFN-β — / — , связанный с уменьшением ВМ клеток B220 + ve / high / CD43 -ve и снижением BP-1, Экспрессия IgM и CD23. Циркулирующие IgM-, Mac-1- и Gr-1-положительные клетки также существенно снижены у мышей IFN-β — / — . Уменьшение количества циркулирующих макрофагов и гранулоцитов, вероятно, отражает дефект созревания примитивного костного мозга у мышей, что проявляется в уменьшении количества колониеобразующих единиц, гранулоцит-макрофагов.Мы приступили к оценке роста in vivo злокачественных клеток на фоне IFN-β — / — и показали, что рост опухоли, специфичной для карциномы легких Льюиса, более агрессивен у мышей IFN-β — / — .
продуцирование фактора α по сравнению с мышами IFN-β + / + . Примечательно, что конститутивная и индуцированная экспрессия фактора некроза опухоли α снижена в макрофагах селезенки и костного мозга (BM), соответственно, мышей IFN-β — / — .Мы также наблюдаем измененную архитектуру селезенки у мышей IFN-β — / — и уменьшение количества резидентных макрофагов. Мы идентифицируем потенциальный дефект созревания В-клеток у мышей IFN-β — / — , связанный с уменьшением ВМ клеток B220 + ve / high / CD43 -ve и снижением BP-1, Экспрессия IgM и CD23. Циркулирующие IgM-, Mac-1- и Gr-1-положительные клетки также существенно снижены у мышей IFN-β — / — . Уменьшение количества циркулирующих макрофагов и гранулоцитов, вероятно, отражает дефект созревания примитивного костного мозга у мышей, что проявляется в уменьшении количества колониеобразующих единиц, гранулоцит-макрофагов.Мы приступили к оценке роста in vivo злокачественных клеток на фоне IFN-β — / — и показали, что рост опухоли, специфичной для карциномы легких Льюиса, более агрессивен у мышей IFN-β — / — . Взятые вместе, наши данные предполагают, что, помимо прямого ингибирующего действия на опухолевые клетки, IFN-β необходим на разных стадиях созревания в развитии иммунной системы.
Взятые вместе, наши данные предполагают, что, помимо прямого ингибирующего действия на опухолевые клетки, IFN-β необходим на разных стадиях созревания в развитии иммунной системы.
IFN типа I представляют собой консервативное семейство секретируемых белков, которые проявляют противовирусные, ингибирующие рост и иммуномодулирующие свойства (1).Существует 14 структурных генов IFN-α и отдельные гены IFN-β, IFN-ω и IFN-κ в локусе IFN типа I человека, обнаруженном на хромосоме 9 (2, 3). Локус мыши на хромосоме 4 еще не картирован полностью; однако были клонированы один ген IFN-β и по крайней мере 12 генов IFN-α (4-6). Все IFN типа I связываются с общим видоспецифическим рецепторным комплексом клеточной поверхности, состоящим из двух трансмембранных белков, рецепторных цепей интерферона (IFNAR) 1 и 2 (7, 8). Хотя они опосредуют свои различные эффекты через один и тот же рецептор, сообщалось о дифференциальной регуляции экспрессии генов, опосредованной различными подтипами IFN-α и -β (9). Действительно, накапливаются доказательства того, что IFN-β может по-разному взаимодействовать с внеклеточной областью комплекса IFNAR, по сравнению с IFN-α, и что это вариабельное связывающее взаимодействие может влиять на конформацию активированного рецепторного комплекса, приводя к различиям в эффекторных молекулах. набраны (10).
Действительно, накапливаются доказательства того, что IFN-β может по-разному взаимодействовать с внеклеточной областью комплекса IFNAR, по сравнению с IFN-α, и что это вариабельное связывающее взаимодействие может влиять на конформацию активированного рецепторного комплекса, приводя к различиям в эффекторных молекулах. набраны (10).
Активность IFN типа I включает прямое антипролиферативное действие на многие опухолевые мишени (11). В различных сравнительных исследованиях, направленных на ингибирование роста клеток меланомы, IFN-β проявлял более выраженную ингибирующую активность, чем IFN-α2 (12, 13).Примечательно, что при использовании генной терапии IFN-β человека и мыши на мышиных моделях злокачественных новообразований человека и мыши исследования показали, что IFN-β вызывает как прямой антипролиферативный, так и апоптотический эффекты, а также системный иммунитет против опухолевых мишеней (14). IFN типа I регулируют экспрессию MHC класса I и усиление цитотоксической активности Т-лимфоцитов и функций Т-хелперных клеток. Кроме того, IFN типа I активируют естественные клетки-киллеры и индуцируют активность макрофагов (15). Вместе взятые, есть убедительные доказательства того, что IFN типа I влияют на многие иммунные ответы, и остается неясным, регулируют ли эти ответы индивидуальные подтипы IFN-α или IFN-β по-разному.
Кроме того, IFN типа I активируют естественные клетки-киллеры и индуцируют активность макрофагов (15). Вместе взятые, есть убедительные доказательства того, что IFN типа I влияют на многие иммунные ответы, и остается неясным, регулируют ли эти ответы индивидуальные подтипы IFN-α или IFN-β по-разному.
Ценные сведения о биологии системы IFN типа I были получены в исследованиях на мышах с нокаутом рецепторов (16). Однако, поскольку подтипы IFN-α и IFN-β активируют один и тот же рецепторный комплекс, различия между ними в контексте биологической активности невозможно оценить у этих мышей без рецепторов. Наш подход к различению биологических эффектов IFN-β от подтипов IFN-α заключался в создании нулевого мышиного значения IFN-β. IFN-β — / — мыши очень восприимчивы к инфекции вируса осповакцины, отчасти из-за неспособности вызвать соответствующий IFN-α ответ (17).Здесь мы сообщаем о дальнейшей характеристике мышей IFN-β — / — со ссылкой на их участие в регуляции и развитии отдельных иммунных компартментов.
Материалы и методы
Животные и культура клеток. IFN-β — / — (17) и IFN-β + / + мышей разводили и содержали в ветеринарной клинике Toronto General Hospital. Всех мышей содержали в стерильной среде, свободной от патогенов, и лечили в соответствии с рекомендациями Комитета по уходу за животными (ACC) Общего исследовательского института Торонто.Клетки карциномы легких Льюиса (LLC-1) поддерживали в 10% DMEM с добавлением 100 единиц / мл пенициллина / 100 мкг / мл стрептомицина (GIBCO / BRL, полная среда). Для получения первичных макрофагов (BMM), производных костного мозга (BMM), клетки смывали из большеберцовой и бедренной костей в полной среде, давали прилипнуть в течение 24 часов и культивировали в течение 6 дней с 10 нг / мл мышиного колониестимулирующего фактора, MCSF. (Системы НИОКР).
Прививка опухоли. Культивируемые клетки LLC-1 ресуспендировали в PBS в концентрации 10 7 на мл и вводили 100 мкл s. c. в правый бок сопоставимых по возрасту (7 недель) мышей IFN-β + / + ( n = 8) и IFN-β — / — ( n = 9). Развитие опухоли контролировали ежедневно, и объем опухоли определяли из ортогональных линейных измерений, сделанных штангенциркулем в соответствии с формулой w 2 × l × 0,52 = мм 3 . Мышей умерщвляли через 19 дней после инокуляции, когда размер опухоли у большинства мышей достиг предельного размера 15 мм в соответствии с процедурами ACC.
c. в правый бок сопоставимых по возрасту (7 недель) мышей IFN-β + / + ( n = 8) и IFN-β — / — ( n = 9). Развитие опухоли контролировали ежедневно, и объем опухоли определяли из ортогональных линейных измерений, сделанных штангенциркулем в соответствии с формулой w 2 × l × 0,52 = мм 3 . Мышей умерщвляли через 19 дней после инокуляции, когда размер опухоли у большинства мышей достиг предельного размера 15 мм в соответствии с процедурами ACC.
Иммуногистология. Наивный IFN-β + / + и IFN-β — / — мышей были убиты, и отобранные ткани были собраны, зафиксированы в 10% (об. / Об.) Формалине (Sigma), залиты парафином, разделены на 4 мкм и обработаны для иммуногистохимии. Срезы тканей окрашивали поликлональными антителами крысы против CD3 мыши (T-клетки) (A0452, DAKO) и крысами против B220 мыши (B-клетки) (клон RA3-6B2, BD Pharmingen), крысиными антимышиными Mac-3 (макрофаги ) (клон M3 / 84, BD Pharmingen) или козьи моноклональные антитела против фактора некроза опухоли мыши (TNF) α (AF-410, R&D Systems). Для двойного иммуноокрашивания B220 / CD3 срезы инкубировали с крысиным антимышиным B220, затем с биотинилированным кроличьим антителом против крысиного IgG (Vector Laboratories), а затем комплексом стрептавидина с пероксидазой хрена (HRP) (Signet Laboratories, Dedham, MA). Связанная пероксидазная активность была проявлена с помощью тетрагидрохлорида 3,3′-диаминобензидина (DAB) (Sigma). После блокирования срезы окрашивали кроличьими антителами против CD3 человека, а затем козьими антителами против кроличьих IgG (Vector labs) и инкубировали со стрептавидин-HRP, как и раньше.Связанную пероксидазную активность визуализировали с помощью Ni-DAB (Vector Laboratories). Для анализа макрофагов селезенки и TNF-α срезы окрашивали крысиными антителами против Mac-3 мыши и козьими антителами против TNF-α мыши, соответственно, с последующим введением биотин-IgG и затем стрептавидин-HRP. Связанную пероксидазную активность визуализировали с помощью Nova red (Vector Laboratories).
Для двойного иммуноокрашивания B220 / CD3 срезы инкубировали с крысиным антимышиным B220, затем с биотинилированным кроличьим антителом против крысиного IgG (Vector Laboratories), а затем комплексом стрептавидина с пероксидазой хрена (HRP) (Signet Laboratories, Dedham, MA). Связанная пероксидазная активность была проявлена с помощью тетрагидрохлорида 3,3′-диаминобензидина (DAB) (Sigma). После блокирования срезы окрашивали кроличьими антителами против CD3 человека, а затем козьими антителами против кроличьих IgG (Vector labs) и инкубировали со стрептавидин-HRP, как и раньше.Связанную пероксидазную активность визуализировали с помощью Ni-DAB (Vector Laboratories). Для анализа макрофагов селезенки и TNF-α срезы окрашивали крысиными антителами против Mac-3 мыши и козьими антителами против TNF-α мыши, соответственно, с последующим введением биотин-IgG и затем стрептавидин-HRP. Связанную пероксидазную активность визуализировали с помощью Nova red (Vector Laboratories).
Проточная цитометрия. ВМ-клеток собирали из бедренных и большеберцовых костей. Селезенки и тимус собирали и получали суспензии единичных клеток, пропуская ткани через нейлоновую сетку 70 мкм.Периферическую кровь (PB) получали из хвостовых вен. Все клетки обрабатывали ACK (8,3 г / литр хлорида аммония / 1 г / литр бикарбоната калия / 0,4 г / литр EDTA) для лизиса красных кровяных телец. Суспензии клеток промывали PBS и ресуспендировали в количестве 10 7 клеток на мл в буфере для сортировки клеток, активируемом флуоресценцией [2% (об. / Об.) FCS / PBS], перед иммуноокрашиванием. Клетки метили крысиными антимышиными антителами в течение 30 мин при 4 ° C, анализировали с помощью проточного цитометра FACSCaliber и количественно определяли с помощью программного обеспечения cellquest (оба от BD Biosciences).Используемые моноклональные антитела представляли собой FITC-конъюгированные IgM, BP-1, CD23, CD43, NK1.1, Mac-1, Gr-1, CD3 и CD4, а также конъюгированные с фикоэритрином (PE) B220 и CD8 (BD Pharmingen).
ВМ-клеток собирали из бедренных и большеберцовых костей. Селезенки и тимус собирали и получали суспензии единичных клеток, пропуская ткани через нейлоновую сетку 70 мкм.Периферическую кровь (PB) получали из хвостовых вен. Все клетки обрабатывали ACK (8,3 г / литр хлорида аммония / 1 г / литр бикарбоната калия / 0,4 г / литр EDTA) для лизиса красных кровяных телец. Суспензии клеток промывали PBS и ресуспендировали в количестве 10 7 клеток на мл в буфере для сортировки клеток, активируемом флуоресценцией [2% (об. / Об.) FCS / PBS], перед иммуноокрашиванием. Клетки метили крысиными антимышиными антителами в течение 30 мин при 4 ° C, анализировали с помощью проточного цитометра FACSCaliber и количественно определяли с помощью программного обеспечения cellquest (оба от BD Biosciences).Используемые моноклональные антитела представляли собой FITC-конъюгированные IgM, BP-1, CD23, CD43, NK1.1, Mac-1, Gr-1, CD3 и CD4, а также конъюгированные с фикоэритрином (PE) B220 и CD8 (BD Pharmingen). Клетки BMM окрашивали PE-конъюгированным Toll-подобным рецептором (TLR) 4-MD2 вместе с контролем изотипа IgG2a крысы (eBioscience, San Diego).
Клетки BMM окрашивали PE-конъюгированным Toll-подобным рецептором (TLR) 4-MD2 вместе с контролем изотипа IgG2a крысы (eBioscience, San Diego).
Анализ внутриклеточных цитокинов. Внутриклеточное окрашивание использовали для определения продукции цитокинов на уровне отдельных клеток в лимфоцитах. Спленоциты ресуспендировали в количестве 2 × 10 6 на мл в 10% α-MEM, содержащем растворимый анти-CD3 (3 мкг / мл, BD Pharmingen), и инкубировали в течение 48 часов при 37 ° C и 5% CO 2 .Лимфоциты экстрагировали (Lympholyte-M, Cedarlane Laboratories), ресуспендировали в количестве 2 × 10 6 на мл и активировали форболмиристиновой кислотой (PMA) (10 нг / мл) и иономицином (0,5 мкг / мл) в течение 4 часов в наличие 5 мкг / мл брефельдина А (Sigma). Клетки собирали, фиксировали в 2% параформальдегиде, промывали и ресуспендировали в буфере для пермеабилизации и блокирования FcR, содержащем 0,25% сапонина (Sigma), нормальную сыворотку мыши (Sigma), 0,1% NaN 3 и клон гибридомы крысы 2. 4G2 ( анти-CD16 / CD32; предоставлено R.Миллер, Институт рака Онтарио, Торонто). Проницаемые клетки инкубировали в присутствии сапонина с моноклональным антителом (мышиное анти-CD4 или -CD8) и подобранными по изотипу контролями или цитокиновыми антителами в течение 30 мин. Используемые антитела представляли собой конъюгированные с Cy-хромом антимышиные CD4 и CD8 (BD Pharmingen), FITC против мышиного IFN-γ и TNF-α, PE против мышиного IL-2 и FITC крысиный IgG (eBioscience). Десять тысяч событий были проанализированы в воротах лимфоцитов, как определено профилями прямого и бокового рассеяния, на проточном цитометре FACSCalibur (BD Biosciences Immunocytometry Systems) и количественно оценены с помощью программного обеспечения cellquest.
4G2 ( анти-CD16 / CD32; предоставлено R.Миллер, Институт рака Онтарио, Торонто). Проницаемые клетки инкубировали в присутствии сапонина с моноклональным антителом (мышиное анти-CD4 или -CD8) и подобранными по изотипу контролями или цитокиновыми антителами в течение 30 мин. Используемые антитела представляли собой конъюгированные с Cy-хромом антимышиные CD4 и CD8 (BD Pharmingen), FITC против мышиного IFN-γ и TNF-α, PE против мышиного IL-2 и FITC крысиный IgG (eBioscience). Десять тысяч событий были проанализированы в воротах лимфоцитов, как определено профилями прямого и бокового рассеяния, на проточном цитометре FACSCalibur (BD Biosciences Immunocytometry Systems) и количественно оценены с помощью программного обеспечения cellquest.
Анализ BMM. Первичные BMM засевали в 96-луночные планшеты (10 5 на лунку в 100 мкл), инкубировали в течение ночи и обрабатывали липополисахаридом (LPS, Sigma). Мышиный rIFN-β (Biogen) добавляли в конечных дозах 10 или 100 единиц / мл во время обработки LPS.
Супернатанты собирали через 24 часа и анализировали на TNF-α в трех повторностях (Quantikine, R&D Systems).
Анализ пролиферации Т-клеток. Был проведен модифицированный анализ пролиферации Т-клеток (18).Клетки лимфатических узлов (2 × 10 5 ; поверхностные, шейные, лицевые, плечевые, подмышечные и паховые) инкубировали при 37 ° C и 5% CO 2 в 200 мкл культуральной среды в отдельных лунках 96-луночного планшета. микротитрационные планшеты и стимулировали растворимыми анти-CD3 (3 мкг / мл) и анти-CD28 (1 мкг / мл) антителами при 37 ° C в течение до 96 часов. Мышиный rIFN-β (Biogen) добавляли в конечных дозах 10, 10 2 или 10 3 единиц / мл во время стимуляции. Клетки пульсировали в течение 18 часов с 1 мкКи (1 Ки = 37 ГБк) [ метил — 3 H] тимидином (удельная активность 2.0 Ки / ммоль, ICN) в течение 96-часового периода времени, и включение тимидина, осаждаемого TCA, измеряли с помощью сцинтилляционного счетчика (LS1801, Beckman).
Анализ гемопоэтических клеток-предшественников. Мононуклеарные клетки BM из IFN-β + / + и IFN-β — / — мышей разделяли с помощью седиментации Ficoll / Hypaque и культивировали в смеси метилцеллюлозы, как описано (19), содержащей факторы гемопоэтического роста мыши (Methocult GF3434, StemCell Technologies, Ванкувер).Колониеобразующие единицы, гранулоцит-макрофаг (CFU-GM), взрывообразующие единицы, эритроид (BFU-E) и колонии смешанного происхождения [CFU, гранулоциты, эритроиды, макрофаги, мегакариоциты (GEMM)] оценивались на 12-й день. культуры с помощью инвертированного микроскопа.
Результаты
IFN- β — / — У мышей снижены уровни циркулирующих зрелых В и миелоидных клеток. Было предпринято иммунофенотипирование PB, полученных из мышей IFN-β + / + и IFN-β — / — , уделяя особое внимание В-клеткам (B220 и IgM), Т-клеткам (CD3, CD4 и CD8) и клетки миелоидного происхождения (Mac-1 и Gr-1) (таблица 1). Мы постоянно наблюдаем снижение циркулирующих уровней клеток миелоидного клона в PB, полученных из IFN-β — / — , по сравнению с мышами IFN-β + / + . В частности, количество позитивно окрашиваемых Mac-1 клеток снижается с уровня циркулирующих 13,1 ± 0,8% в PB мышей IFN-β + / + до 7,3 ± 0,8% у мышей IFN-β — / — ( Р = 0,0001). Более того, количество Gr-1-положительных клеток (нейтрофилов) снижается с 22,9 ± 0,9% в крови у мышей IFN-β + / + до 14.6 ± 1,0% у мышей IFN-β — / — ( P = 0,001). Профили В- и Т-клеток практически идентичны для мышей IFN-β + / + и IFN-β — / — , за исключением циркулирующих IgM-экспрессирующих клеток, которые уменьшены с 7,05 ± 2,7 в IFN-β . + / + до 4,88 ± 1,2 у мышей IFN-β — / — ( P = 0,05).
Мы постоянно наблюдаем снижение циркулирующих уровней клеток миелоидного клона в PB, полученных из IFN-β — / — , по сравнению с мышами IFN-β + / + . В частности, количество позитивно окрашиваемых Mac-1 клеток снижается с уровня циркулирующих 13,1 ± 0,8% в PB мышей IFN-β + / + до 7,3 ± 0,8% у мышей IFN-β — / — ( Р = 0,0001). Более того, количество Gr-1-положительных клеток (нейтрофилов) снижается с 22,9 ± 0,9% в крови у мышей IFN-β + / + до 14.6 ± 1,0% у мышей IFN-β — / — ( P = 0,001). Профили В- и Т-клеток практически идентичны для мышей IFN-β + / + и IFN-β — / — , за исключением циркулирующих IgM-экспрессирующих клеток, которые уменьшены с 7,05 ± 2,7 в IFN-β . + / + до 4,88 ± 1,2 у мышей IFN-β — / — ( P = 0,05).
IFN- β необходим для созревания В-клеток и миелопоэза в костном мозге. Различные стадии созревания В-клеток разработаны в соответствии со специфическими маркерами клеточной поверхности: про-В (B220 + ve , CD43 + ve ), пре-B (B220 + ve / low , CD43 + / -ve , BP-1 + ve , IgM -ve ), незрелые (B220 + ve / high , IgM + ve , CD23 -ve ) и зрелые (B220 + ve / высокий , IgM + ve , CD23 + ve ). CD43 экспрессируется на ранних предшественниках B-клеток во время развития лимфоидных клеток и быстро теряется, когда эти клетки проходят через стадии пре-B и B-клеток.Профили проточной цитометрии на фиг. 1 представляют клетки ВМ, одновременно окрашенные на B220 и один из следующих: CD43, BP-1, IgM или CD23. Популяция B220 / CD43 может быть далее разделена на подгруппы B220 + ve / CD43 + ve , B220 + ve / low / CD43 -ve и B220 + ve / high / CD43 — ve , соответствующие pro-B, pre-B и зрелым B-клеткам соответственно.
Различные стадии созревания В-клеток разработаны в соответствии со специфическими маркерами клеточной поверхности: про-В (B220 + ve , CD43 + ve ), пре-B (B220 + ve / low , CD43 + / -ve , BP-1 + ve , IgM -ve ), незрелые (B220 + ve / high , IgM + ve , CD23 -ve ) и зрелые (B220 + ve / высокий , IgM + ve , CD23 + ve ). CD43 экспрессируется на ранних предшественниках B-клеток во время развития лимфоидных клеток и быстро теряется, когда эти клетки проходят через стадии пре-B и B-клеток.Профили проточной цитометрии на фиг. 1 представляют клетки ВМ, одновременно окрашенные на B220 и один из следующих: CD43, BP-1, IgM или CD23. Популяция B220 / CD43 может быть далее разделена на подгруппы B220 + ve / CD43 + ve , B220 + ve / low / CD43 -ve и B220 + ve / high / CD43 — ve , соответствующие pro-B, pre-B и зрелым B-клеткам соответственно. Эти подмножества показаны в рамке на рис. 1 A как I, II и III соответственно.Мы наблюдаем снижение во всех фракциях, I-III, IFN-β — / — по сравнению с IFNβ + / + клетками. В частности, снижение статистически значимо во фракциях I и III. Вследствие этого мы идентифицируем понижающую регуляцию в клетках B220 + ve / BP-1 + ve (рис. 1 B ). BP-1 — это маркер, ограниченный популяцией ранней B-линии. Хотя большинство клеток B220 + ve / BP-1 + ve считаются CD43 -ve , было показано, что небольшой процент, 30%, экспрессирует CD43 (20).Профили на фиг. 1 C и D показывают значительное снижение экспрессии на клеточной поверхности IgM и CD23 в популяции B220 + ve , полученной от мышей IFN-β — / — . Взятые вместе, эти данные указывают на дефект на очень ранней стадии созревания В-клеток, связанный с отсутствием IFN-β.
Эти подмножества показаны в рамке на рис. 1 A как I, II и III соответственно.Мы наблюдаем снижение во всех фракциях, I-III, IFN-β — / — по сравнению с IFNβ + / + клетками. В частности, снижение статистически значимо во фракциях I и III. Вследствие этого мы идентифицируем понижающую регуляцию в клетках B220 + ve / BP-1 + ve (рис. 1 B ). BP-1 — это маркер, ограниченный популяцией ранней B-линии. Хотя большинство клеток B220 + ve / BP-1 + ve считаются CD43 -ve , было показано, что небольшой процент, 30%, экспрессирует CD43 (20).Профили на фиг. 1 C и D показывают значительное снижение экспрессии на клеточной поверхности IgM и CD23 в популяции B220 + ve , полученной от мышей IFN-β — / — . Взятые вместе, эти данные указывают на дефект на очень ранней стадии созревания В-клеток, связанный с отсутствием IFN-β.
Дефект созревания В-клеток костного мозга у мышей IFN-β — / — . Клетки ВМ, собранные у мышей IFN-β + / + и IFN-β — / — , были лишены эритроцитов и проанализированы проточной цитометрией после мечения указанными Abs.( A ) Клетки линий B220 и CD43. B220-положительные клетки разделены на фракции I (B220 + ve / CD43 + ve ), II (B220 + ve / low / CD43 -ve ) и III (B220 + ve / high. / CD43 -ve ). ( B — D ) Клоны B220 и BP-1, IgM и CD23. Где указано, числа представляют популяцию закрытых клеток в процентах от общей популяции клеток. Данные представляют собой среднее значение для групп из пяти мышей. * , P <0.05; ** , P <0,01; *** , P <0,001. + / +, IFN-β + / + ; — / -, IFN-β — / — .
Клетки ВМ, собранные у мышей IFN-β + / + и IFN-β — / — , были лишены эритроцитов и проанализированы проточной цитометрией после мечения указанными Abs.( A ) Клетки линий B220 и CD43. B220-положительные клетки разделены на фракции I (B220 + ve / CD43 + ve ), II (B220 + ve / low / CD43 -ve ) и III (B220 + ve / high. / CD43 -ve ). ( B — D ) Клоны B220 и BP-1, IgM и CD23. Где указано, числа представляют популяцию закрытых клеток в процентах от общей популяции клеток. Данные представляют собой среднее значение для групп из пяти мышей. * , P <0.05; ** , P <0,01; *** , P <0,001. + / +, IFN-β + / + ; — / -, IFN-β — / — .
Чтобы определить, является ли уменьшение количества циркулирующих гранулоцитов и моноцитов в PB мышей IFN-β — / — результатом дефектов роста / созревания примитивных гематопоэтических предшественников, клеток BM из IFN-β + / + и IFN-β — / — мышей культивировали в системе анализа клоногенной метилцеллюлозы (19). Было оценено образование колоний для миелоидных / моноцитарных (CFU-GM), взрывообразующих единиц, эритроидных (BFU-E) и смешанных линий [КОЕ, гранулоциты, эритроиды, макрофаги, мегакариоциты (GEMM)] предшественников. Мы идентифицировали существенное снижение образования колоний для предшественников CFU-GM из BM мышей IFN-β — / — по сравнению с мышами IFN-β + / + (рис. Mac-1- и Gr-1-положительных клеток в PB этих мышей являются результатом дефектного миелопоэза BM.
Было оценено образование колоний для миелоидных / моноцитарных (CFU-GM), взрывообразующих единиц, эритроидных (BFU-E) и смешанных линий [КОЕ, гранулоциты, эритроиды, макрофаги, мегакариоциты (GEMM)] предшественников. Мы идентифицировали существенное снижение образования колоний для предшественников CFU-GM из BM мышей IFN-β — / — по сравнению с мышами IFN-β + / + (рис. Mac-1- и Gr-1-положительных клеток в PB этих мышей являются результатом дефектного миелопоэза BM.
Дефектное созревание гемопоэтических предшественников CFU-GM в BM мышей IFN-β — / — . Мононуклеарные клетки BM от мышей IFN-β + / + и IFN-β — / — высевали в систему для анализа метилцеллюлозы. Данные выражены как среднее общее количество КОЕ ± SEM из трех независимых экспериментов. CFU-GM, взрывообразующие единицы (BFU-E) и колонии смешанного происхождения (CFUGEMM). * , P = 0,049; ** , P = 0. 01.
01.
Нарушенная продукция TNF- α в стимулированных ЛПС IFN- β -дефицитных BMM. Макрофаги являются источником как конститутивного, так и индуцибельного IFN-β (21, 22). Чтобы исследовать функцию макрофагов в отсутствие IFN-β, IFN-β — / — BMM стимулировали LPS и оценивали на продукцию TNF-α, ключевого индикатора активации макрофагов. Как показано на фиг. 3, продукция TNF-α была заметно снижена в BMM IFN-β — / — по сравнению с BMM дикого типа при стимуляции 10 или 100 нг / мл LPS.Примечательно, что продукция TNF-α восстанавливалась, когда IFN-β — / — BMM одновременно обрабатывали LPS и IFN-β. Эти результаты предполагают, что IFN-β необходим для эффективной активации BMM.
Рис.3. Нарушение индуцированной ЛПС продукции TNF-α из IFN-β — / — BMM. BMM от мышей IFN-β + / + и IFN-β — / — культивировали в течение 24 часов после стимуляции LPS (10 и 100 нг / мл) в присутствии или в отсутствие rIFN-β. Супернатанты анализировали на TNF-α в трех повторностях с помощью ELISA.Данные представляют собой среднее значение ± SEM двух независимых анализов. (IFN-β + / + n = 5; IFN-β — / — n = 5). ND — не обнаружено; *** , P ≤ 0,0001.
Супернатанты анализировали на TNF-α в трех повторностях с помощью ELISA.Данные представляют собой среднее значение ± SEM двух независимых анализов. (IFN-β + / + n = 5; IFN-β — / — n = 5). ND — не обнаружено; *** , P ≤ 0,0001.
Гистологический анализ тканей: измененная архитектура селезенки. Участие TNF-α во вторичном лимфоидном развитии широко задокументировано (23, 24). Выявив снижение уровней индуцибельного TNF-α в активированных BMM IFN-β — / — , мы исследовали микроархитектуру селезенки у IFN-β — / — мышей.Белая пульпа селезенки разделена на центральную богатую Т-клетками зону, называемую периартериолярными лимфоидными оболочками (БАБЛ), окруженную первичными фолликулами, богатыми В-клетками. Белую и красную пульпу отделяет маргинальная зона, которая также содержит наивные В-клетки. Общий гистологический анализ селезенки мышей IFN-β + / + и IFN-β — / — не выявил существенных различий. Однако более тщательное изучение организации первичных B-клеточных фолликулов и их пространственного расположения относительно PALS позволяет выявить потерю определенных фолликулов и неопределенный интерфейс B / T-клеток в селезенках IFN-β — / — (рис.4 A — D ). Об этом фенотипе сообщалось у мышей с дефицитом TNF-α (25, 26). Действительно, при дальнейшем исследовании мы обнаруживаем сниженные уровни экспрессии TNF-α в селезенке у мышей IFN-β — / — (фиг. 4 E и F ). Кроме того, мы наблюдаем уменьшение количества макрофагов красной пульпы селезенки у мышей IFN-β — / — , идентифицированное как уменьшение количества окрашенных Mac-3 + ve клеток (рис. 4 G и H ). .
Однако более тщательное изучение организации первичных B-клеточных фолликулов и их пространственного расположения относительно PALS позволяет выявить потерю определенных фолликулов и неопределенный интерфейс B / T-клеток в селезенках IFN-β — / — (рис.4 A — D ). Об этом фенотипе сообщалось у мышей с дефицитом TNF-α (25, 26). Действительно, при дальнейшем исследовании мы обнаруживаем сниженные уровни экспрессии TNF-α в селезенке у мышей IFN-β — / — (фиг. 4 E и F ). Кроме того, мы наблюдаем уменьшение количества макрофагов красной пульпы селезенки у мышей IFN-β — / — , идентифицированное как уменьшение количества окрашенных Mac-3 + ve клеток (рис. 4 G и H ). .
Сравнительный анализ тканей селезенки от наивных мышей IFN-β + / + и IFN-β — / — .Залитые парафином срезы селезенки окрашивали анти-B220 (коричневый) и анти-CD3 (синий) ( A — D ), анти-TNF-α (красный) ( E и F ) или anti-Mac-3 (коричневый) ( G и H ) Абс. wp, белая мякоть; рп, красная мякоть; б — фолликулы В-клеток; t, PALS; ca, центральные артериолы. + / +, IFN-β + / + ; — / -, IFN-β — / — . (Исходное увеличение: A, B и E — H , × 10; C и D , × 40.)
wp, белая мякоть; рп, красная мякоть; б — фолликулы В-клеток; t, PALS; ca, центральные артериолы. + / +, IFN-β + / + ; — / -, IFN-β — / — . (Исходное увеличение: A, B и E — H , × 10; C и D , × 40.)
In vitro Характеристики активированных Т-клеток из IFN- β — / — Мыши: гиперпролиферация и низкая продукция TNF- α . В соответствии с данными PB, профили CD4 и CD8 в тимусе и селезенке практически неотличимы от IFN-β + / + и IFN-β — / — мышей (см. Вспомогательные методы и рис. 8, которые публикуются в качестве вспомогательной информации на веб-сайте PNAS).Однако, когда клетки лимфатических узлов стимулируются анти-CD3 / анти-CD28 во время исследований, мы постоянно наблюдаем усиленную пролиферацию Т-клеток лимфатических узлов IFN-β — / — по сравнению с IFN-β + / + населения ( P = 0,002; рис. 5 A ). В экспериментах «доза-ответ» мы показали, что обработка IFN-β ослабляет этот гиперпролиферативный ответ на стимуляцию анти-CD3 / анти-CD28 (фиг. 5 B — D ).
5 A ). В экспериментах «доза-ответ» мы показали, что обработка IFN-β ослабляет этот гиперпролиферативный ответ на стимуляцию анти-CD3 / анти-CD28 (фиг. 5 B — D ).
Повышенная пролиферация Т-клеток в отсутствие IFN-β.Клетки лимфатических узлов мышей IFN-β + / + (○) и IFN-β — / — (•) стимулировали мышиными рекомбинантными анти-CD3 (3 мкг / мл) / анти-CD28 (1 мкг / мл). мл), в присутствии ( B — D ) или в отсутствие ( A ) мышиного rIFN-β (10, 100 или 1000 единиц / мл), затем пульсировали в течение 18 ч с [ метил — 3 H] тимидин. [ 3 H] Поглощение тимидина измеряли в течение 96 часов. Данные представляют собой среднее значение ± стандартная ошибка среднего из трех независимых экспериментов ( P = 0.002).
PMA и иономицин широко активируют лимфоциты и могут использоваться для оценки общего потенциала различных субпопуляций лимфоцитов экспрессировать выбранные цитокины. Когда Т-лимфоциты селезенки стимулируются PMA и иономицином, и профили экспрессии цитокинов разрабатываются в их популяциях CD4 + и CD8 + , внутриклеточные уровни IFN-γ и IL-2 неотличимы от IFN-β + / + и IFN-β — / — мышей (рис.6 B, F, D и H ). Этот анализ представляет собой типичный ответ Т-клеток на ФМА и иономицин. Напротив, мы постоянно наблюдаем снижение ФМА и индуцируемого иономицином TNF-α в T-клетках селезенки CD4 + и CD8 + , полученных из IFN-β — / — мышей по сравнению с индуцибельным TNF-α в IFN. -β + / + CD4 + ( P = 0,008) и CD8 + ( P = 0,001) клеток (рис.6 C и G ).Отсутствие конститутивной экспрессии IFN-β, участвующей в регуляции нормального роста клеток, и недостаток индуцибельного TNF-α, который также связан с негативной регуляцией роста клеток, может способствовать усиленной пролиферации, которую мы наблюдали в IFN-β — / — Т-клетки.
Когда Т-лимфоциты селезенки стимулируются PMA и иономицином, и профили экспрессии цитокинов разрабатываются в их популяциях CD4 + и CD8 + , внутриклеточные уровни IFN-γ и IL-2 неотличимы от IFN-β + / + и IFN-β — / — мышей (рис.6 B, F, D и H ). Этот анализ представляет собой типичный ответ Т-клеток на ФМА и иономицин. Напротив, мы постоянно наблюдаем снижение ФМА и индуцируемого иономицином TNF-α в T-клетках селезенки CD4 + и CD8 + , полученных из IFN-β — / — мышей по сравнению с индуцибельным TNF-α в IFN. -β + / + CD4 + ( P = 0,008) и CD8 + ( P = 0,001) клеток (рис.6 C и G ).Отсутствие конститутивной экспрессии IFN-β, участвующей в регуляции нормального роста клеток, и недостаток индуцибельного TNF-α, который также связан с негативной регуляцией роста клеток, может способствовать усиленной пролиферации, которую мы наблюдали в IFN-β — / — Т-клетки.
Пониженные уровни TNF-α в активированных IFN-β — / — Т-клеток. Спленоциты стимулировали рекомбинантным мышиным анти-CD3 в течение 48 часов, а затем PMA и иономицином в течение 4 часов. Затем клетки одновременно метили Ат на клеточной поверхности для CD4 ( A — D ) или CD8 ( E — H ) и окрашивали либо на неспецифические антитела с тем же изотипом ( A, и E). ) или внутриклеточные цитокиновые антитела, как указано.Показанные значения представляют собой популяцию лимфоцитов в процентах от общей популяции селезенки. Числа в скобках представляют собой процентное содержание CD4- или CD8-позитивных цитокин-секретирующих клеток. Статистический анализ выполнен с помощью теста Стьюдента t ; ** , P = 0,008; *** , P = 0,001. + / +, IFN-β + / + ; — / -, IFN-β — / — . Данные являются репрезентативными для мышей IFN-β + / + ( n = 5) и IFN-β — / — ( n = 5).
Агрессивный рост опухоли у IFN- β — / — Мыши. Учитывая эффекты, которые мы наблюдали в различных иммунных компартментах у мышей IFN-β — / — , была оценена роль IFN-β в ограничении прогрессирования опухоли. IFN-β + / + мыши, инокулированные подкожно. с линией мышиной карциномы LLC-1 проявляли пальпируемые признаки роста опухоли (в среднем 10,8 мм 3 ) на 10 день после инокуляции (восемь из восьми).Примечательно, что у восьми из девяти мышей IFN-β — / — обнаруживались пальпируемые опухоли (в среднем 2,2 мм 3 ) к 7 дню (фиг. 7). Более того, размер опухоли был значительно больше у мышей IFN-β — / — по сравнению с мышами IFN-β + / + при измерении на 18 и 19 дни после инокуляции до завершения эксперимента: 518 ± 64 мм 3 против 372 ± 133 мм 3 и 807 ± 231 мм 3 против 466 ± 166 мм 3 соответственно. Гистологическое исследование опухолей показало отсутствие серьезных различий между мышами IFN-β + / + и IFN-β — / — , а также отсутствие различий в степени Т-клеток (CD3 + ve -окрашенные клетки) или макрофагов ( Mac-3 + ve -окрашивающие клетки) инфильтрации, которая была минимальной (данные не показаны).
Гистологическое исследование опухолей показало отсутствие серьезных различий между мышами IFN-β + / + и IFN-β — / — , а также отсутствие различий в степени Т-клеток (CD3 + ve -окрашенные клетки) или макрофагов ( Mac-3 + ve -окрашивающие клетки) инфильтрации, которая была минимальной (данные не показаны).
Нарушение опухолевого ответа против LLC-1 у мышей IFN-β — / — . Мышам IFN-β + / + (○) и IFN-β — / — (•) прививали подкожно. с 10 6 клеток LLC-1 и ежедневно контролировали рост опухоли, как указано. Каждая точка представляет средний размер опухоли для группы ± SEM. * , P ≤ 0,05; ** , P ≤ 0,01.
Обсуждение
Мы получили мышей с нулевой мутацией в гене IFN-β.Хотя эти мыши не проявляют явного фенотипа, они очень восприимчивы к инфекции вируса осповакцины (17). Мы провели обширное иммунофенотипирование этих мышей, и наши данные выявили аномалии в отдельных популяциях клеток. Исследование B-клеток, происходящих из BM, выявило аномальный сдвиг в популяции B220 + ve / CD43 -ve у IFN-β — / — по сравнению с IFN-β + / + мышей в сторону более незрелых мышей. фенотип препро-В-клеток. Более ранние исследования показали, что отбор репертуара В-клеток может модулироваться интерфероном, продуцируемым локально в костном мозге (28).Наблюдая сокращение популяции ранних препро-В-клеток и последующих стадий развития, остается неясным, на какой стадии развития В-клеток IFN-β проявляет свои эффекты. Однако переход от пролиферации к стадии покоя во время реаранжировки сегмента гена вариабельной области (VDJ) является критическим шагом в обязательстве B-линии, и наши данные предполагают, что конститутивная экспрессия IFN-β может потребоваться для остановки ранних предшественников B-клеток в G 0 / G 1 до фиксации B-линии.Действительно, было показано, что IFN-β снижает экспрессию c-Myc, важного регулятора прогрессии клеточного цикла, во время гемопоэтической дифференцировки (29-31).
Исследование B-клеток, происходящих из BM, выявило аномальный сдвиг в популяции B220 + ve / CD43 -ve у IFN-β — / — по сравнению с IFN-β + / + мышей в сторону более незрелых мышей. фенотип препро-В-клеток. Более ранние исследования показали, что отбор репертуара В-клеток может модулироваться интерфероном, продуцируемым локально в костном мозге (28).Наблюдая сокращение популяции ранних препро-В-клеток и последующих стадий развития, остается неясным, на какой стадии развития В-клеток IFN-β проявляет свои эффекты. Однако переход от пролиферации к стадии покоя во время реаранжировки сегмента гена вариабельной области (VDJ) является критическим шагом в обязательстве B-линии, и наши данные предполагают, что конститутивная экспрессия IFN-β может потребоваться для остановки ранних предшественников B-клеток в G 0 / G 1 до фиксации B-линии.Действительно, было показано, что IFN-β снижает экспрессию c-Myc, важного регулятора прогрессии клеточного цикла, во время гемопоэтической дифференцировки (29-31). В соответствии с обнаружением блокады клональной прогрессии B-клеток в BM, мы наблюдаем снижение IgM-положительных клеток в селезенке (данные не показаны) и PB мышей IFN-β — / — по сравнению с дикими мышами. -типа мышей. Мы постоянно обнаруживаем снижение количества Mac-1- и Gr-1-поверхностных маркеров клеток в PB мышей IFN-β — / — .Интересно, что этот результат отличается от того, что наблюдается у мышей с нулевым уровнем рецепторной цепи интерферона (IFNAR) 1, где сообщалось об увеличении количества Mac-1- и Gr-1-положительных клеток (16). Более ранние исследования показали, что незначительные количества IFN-β секретируются конститутивно (32, 33), служа для примирования клеток для последующего производства IFN аутокринным способом. Фактор роста мышиный колониестимулирующий фактор способствует эндогенной продукции IFN, исключительно для увеличения дифференцировки и созревания макрофагов (34, 35).Мы предполагаем, что в отсутствие IFN-β этот стимулирующий рост механизм, вероятно, нарушен, что влияет на абсолютное количество циркулирующих моноцитов.
В соответствии с обнаружением блокады клональной прогрессии B-клеток в BM, мы наблюдаем снижение IgM-положительных клеток в селезенке (данные не показаны) и PB мышей IFN-β — / — по сравнению с дикими мышами. -типа мышей. Мы постоянно обнаруживаем снижение количества Mac-1- и Gr-1-поверхностных маркеров клеток в PB мышей IFN-β — / — .Интересно, что этот результат отличается от того, что наблюдается у мышей с нулевым уровнем рецепторной цепи интерферона (IFNAR) 1, где сообщалось об увеличении количества Mac-1- и Gr-1-положительных клеток (16). Более ранние исследования показали, что незначительные количества IFN-β секретируются конститутивно (32, 33), служа для примирования клеток для последующего производства IFN аутокринным способом. Фактор роста мышиный колониестимулирующий фактор способствует эндогенной продукции IFN, исключительно для увеличения дифференцировки и созревания макрофагов (34, 35).Мы предполагаем, что в отсутствие IFN-β этот стимулирующий рост механизм, вероятно, нарушен, что влияет на абсолютное количество циркулирующих моноцитов.
Очевидно, что недостаток IFN-β также ведет к снижению количества примитивных миелоидных гематопоэтических предшественников в BM этих мышей. Этот дефект кроветворения, по-видимому, специфичен для миелоидного / моноцитарного происхождения, потому что предшественники эритроидного происхождения существенно не затрагиваются. Возможно, дефект на уровне иерархического созревания CFU-GM отражает дефектную экспрессию стимулирующих рост миелоид-специфических цитокинов, регуляция которых зависит от продукции базального IFN-β в BM.Таким образом, несмотря на то, что IFN типа I подавляют миелопоэз при экзогенном добавлении к культурам BM в высоких концентрациях (19, 36), вероятно, что низкие уровни IFN-β, конститутивно продуцируемые в BM, оказывают положительный регуляторный эффект на миелопоэз. . Однако справедливость такой гипотезы еще предстоит изучить. Альтернативно, дефект может отражать отсутствие прямого действия цитокина, индуцирующего дифференцировку, на предшественников. В поддержку второй возможности имеются данные о том, что IFN-β может взаимодействовать с IL-1 и TNF-α, вызывая дифференцировку, и что IFN-β является аутокринным дифференцирующим фактором (37). Однако остается выяснить, зависит ли его положительный регуляторный эффект от продукции этих цитокинов в BM in vivo или от прямых эффектов.
Однако остается выяснить, зависит ли его положительный регуляторный эффект от продукции этих цитокинов в BM in vivo или от прямых эффектов.
Дальнейшее исследование BMM IFN-β — / — выявило заметное снижение уровней TNF-α, продуцируемых после стимуляции LPS. LPS вызывает ответ TNF-α, в частности, через активацию TLR4 (38). Эта активация TLR4 приводит к быстрой индукции экспрессии гена IFN-β (39), необходимой для последующей экспрессии LPS-индуцируемого гена (40).Примечательно, что IFN-β и IFN-κ, но не IFN-α2, будут регулировать LPS-индуцируемую продукцию TNF-α в моноцитах. Исследование экспрессии TLR4 на клеточной поверхности как на BMM IFN-β — / — , так и на IFN-β + / + выявило сравнимое количество рецепторов (данные не показаны), что позволяет предположить, что экспрессия TLR4 не ограничивалась в IFN-β . — / — BMMs и не может объяснить дефект в производстве TNF-α. Таким образом, наши данные подтверждают роль IFN-β в LPS-индуцируемом производстве TNF-α. Кроме того, наши результаты предполагают положительную регуляторную роль IFN-β в миелопоэзе, который может включать созревание BMM.Соответственно, сниженный ответ TNF-α может отражать накопление незрелых, невосприимчивых моноцитов BM.
Мы наблюдаем поразительное фенотипическое сходство между мышами IFN-β — / — и мышами TNF-α — / — : ( i ) явное отсутствие организации белой пульпы селезенки и ( ii ) отчетливое сходство в профилях экспрессии B220 (25, 26). Кроме того, мы предоставляем доказательства снижения уровней конститутивного и индуцибельного TNF-α в спленоцитах IFN-β — / — .Примечательно, что TNF-α необходим для экспрессии хемокинов в стромальных клетках, участвующих в рекрутировании селезенки Т- и В-клеток (41). В отсутствие прямых доказательств обязательной роли IFN-β в продукции TNF-α, накопленные данные позволяют предположить, что IFN типа I влияют на регуляцию экспрессии генов для различных членов семейства TNF. В частности, связанный с TNF-α лиганд, индуцирующий апоптоз (TRAIL), является IFN-β-индуцибельным (42), как и ряд других генов, связанных с TNF-α (E.N.F., неопубликованные данные). Кроме того, X-связанный IFN-индуцибельный ген, X-связанный ингибитор фактора 1, связанного с апоптозом (XAF-1), усиливает индуцированный TRAIL апоптоз клеток меланомы (43).Индуцируемая мелфаланом повышающая регуляция TNF-α, наблюдаемая как в селезенке, так и в опухолях мышей с опухолями, опосредуется IFN-β и зависит от активации рецептора IFN (44). Дополнительные подтверждающие доказательства того, что IFN-β регулирует продукцию TNF-α, получены из наблюдения, что мыши IFN-β — / — имеют пониженные уровни макрофагов селезенки по сравнению с их аналогами IFN-β + / + . TNF-α является главным регулятором движения лейкоцитов (45). Воспалительный белок макрофагов (MIP) 3β (CCL 19), хемокин, критический для доставки предшественников BM, индуцируется TNF-α.Ограниченная продукция TNF-α у мышей IFN-β — / — может ограничивать выход предшественников, в частности Mac-1- и Gr-1-положительных клеток, у мышей IFN-β — / — .
Недавно Picaud et al. (46) предоставили доказательства усиленного развития опухоли у мышей, лишенных функционального рецептора IFN типа I. Точно так же мы идентифицировали агрессивное прогрессирование опухоли у мышей IFN-β — / — . Измеримая опухолевая нагрузка была очевидна уже на 7-й день у мышей IFN-β — / — .Кроме того, средний размер опухоли был больше у мышей IFN-β — / — по сравнению с мышами IFN-β + / + . В элиминацию опухоли вовлечены различные эффекторные клетки, включая Т- и В-лимфоциты, естественные клетки-киллеры, макрофаги и гранулоциты. Независимо от измененных цитолитических / цитотоксических эффекторных функций этих инфильтрирующих Т-клеток и макрофагов, уменьшение их абсолютных количеств эффективно ограничивает их способность очищать опухолевую нагрузку. Более того, в отсутствие прямых антипролиферативных эффектов IFN-β в опухолевых клетках можно ожидать, что прогрессирование опухоли будет происходить более агрессивно.Повышенный пролиферативный потенциал Т-клеток лимфатических узлов и ограниченный TNF-α ответ Т-клеток селезенки на ФМА и иономицин подразумевают функциональные нарушения в Т-клетках мышей IFN-β — / — . Несомненно, прямые цитотоксические эффекты TNF-α в сочетании с критической ролью TNF-α в опосредованном CD8 T-клетками элиминации опухолевых клеток (47) вносят значительный вклад в клиренс опухоли. Таким образом, ограниченные уровни TNF-α у мышей IFN-β — / — могут способствовать прогрессированию опухоли.
Добавление IFN-β к Т-клеткам, стимулированным анти-CD3 / анти-CD28, от мышей IFN-β — / — восстанавливает пролиферативный ответ до сопоставимых уровней, наблюдаемых с клетками IFN-β + / + .Эти данные подтверждают, что гиперпролиферативный ответ, наблюдаемый в клетках IFN-β — / — , не является дефектом развития, и демонстрируют физиологическое значение эндогенного IFN-β для функции Т-клеток. Неспособность регулировать пролиферативный ответ на активирующий стимул может изменить кинетику прогрессирующего иммунного ответа с участием различных популяций иммунных эффекторных клеток. Усиленный пролиферативный ответ Т-клеток может задерживать дифференцировку связанных эффекторных функций.Интересно предположить, что, как и в случае с макрофагами, IFN-β может регулировать экспрессию поверхностных маркеров на Т-клетках, связанных с переносом и инфильтрацией опухолей. Смысл в том, что тонкие различия в врожденном и адаптивном иммунном ответе между мышами, не содержащими IFN-β, и их аналогами дикого типа могут объяснять повышенную восприимчивость к агрессивному прогрессированию опухоли у мышей IFN-β — / — . Взятые вместе, эти данные предполагают взаимосвязь между IFN-β и TNF-α, критическую для множества иммунорегуляторных функций.
Благодарности
Благодарим Б. Рабиновича за техническую помощь, а также Г. Ву и Л. Лу за советы и знания. Эта работа была поддержана грантом MOP 15094 канадских институтов здравоохранения (для E.N.F.), грантами Национальных институтов здравоохранения CA77816 и CA94079 (для L.C.P.) и грантом на рассмотрение заслуг ветеранов (для L.C.P.).
Сноски
↵∥ Кому корреспонденцию следует направлять по адресу: Toronto General Research Institute, University Health Network, 67 College Street, Room 424, Toronto, ON, Canada M5G 2M1.Эл. Почта: en.fish {at} utoronto.ca.
Этот документ был отправлен напрямую (Трек II) в офис PNAS.
Сокращения: BM — костный мозг; BMM, макрофаги, происходящие из BM; КОЕ-ГМ, колониеобразующая единица, гранулоцит-макрофаг; LLC, карцинома легкого Льюиса; ЛПС, липополисахарид; ПБ — периферическая кровь; PMA, форбол миристиновая кислота; TLR, Toll-подобный рецептор; TNF, фактор некроза опухоли.
- Поступила 24.01.2003.
- Авторские права © 2003, Национальная академия наук
Совместное действие IFN-α и IFN-λ индуцирует местный иммунитет NK-клеток и останавливает рост рака
ВВЕДЕНИЕ
Гепатоцеллюлярная карцинома (ГЦК) является одним из основных видов рака во всем мире. ежегодно диагностируется более 660 тыс. человек [1]. Возможны потенциально лечебные методы лечения, такие как хирургическая резекция или трансплантация печени, однако после резекции часто возникают рецидивы опухоли и метастазы, что ограничивает общую выживаемость [2, 3].Послеоперационная терапия IFN-α, по-видимому, уменьшает рецидивы после абляционной терапии, такой как радиочастотная абляция (RFA) HCV-related HCC [4]. Многие исследования документально подтвердили, что IFN значительно подавляет начало ГЦК у пациентов с хроническим гепатитом или циррозом печени. Таким образом, терапия IFN-α при инфекциях HBV и HCV подавляет канцерогенез и улучшает функцию печени [5, 6]. Более того, терапия IFN устраняет мРНК HCV и снижает вероятность возникновения HCC у пациентов с нормализованными уровнями трансаминаз [7].Хотя терапия IFN-α подавляла ГЦК, полная ликвидация опухоли достигается редко. В настоящее время прилагаются огромные усилия для улучшения терапии ИФН для эффективного лечения ГЦК и устранения рецидива опухоли, что остается главной проблемой после резекции печени [5, 6, 8]. В соответствии с клиническими исследованиями мы подтвердили на модели гепатомы BNL, что IFN-α проявляет сильную противоопухолевую активность, не вызывая полной ремиссии опухоли [9]. Аналогичная эффективность была получена с IFN-λ. IFN-λ индуцирует высокую активацию NK-клеток и, в отличие от IFN-α, не вызывает изменения Т-регуляторных (Treg) клеток [9].Поскольку противоопухолевые механизмы IFN-α и IFN-λ были совершенно разными, мы предположили, что комбинированное действие IFN-α и IFN-λ будет более эффективным, чем монотерапия IFN. По этой причине мы проанализировали эффективность комбинации IFN-α / λ в терапии рака.
В настоящее время IFN вводят пациентам системно и часто приводят к низкой противоопухолевой эффективности и значительным побочным эффектам из-за отсутствия нацеливания [10, 11]. По этой причине мы исследовали роль IFN в микросреде опухоли.В настоящем исследовании мы обнаружили, что местное введение IFN в очаг опухоли на модели гепатомы BNL значительно улучшает терапию IFN. Мы достигли полной ремиссии опухоли, когда как IFN-α, так и IFN-λ вводили мышам с помощью подхода генной терапии или путем местной инъекции IFN в место опухоли после хирургического вмешательства. Мы продемонстрировали, что такая высокая противоопухолевая эффективность комбинации IFN-α / IFN-λ связана с усиленной инфильтрацией опухоли NK-клетками и повышенной опухолевой активностью NK-клеток.Таким образом, наши результаты убедительно указывают на использование комбинации IFN-α / IFN-λ в качестве нового терапевтического подхода для лечения HCC и искоренения рецидива опухоли.
РЕЗУЛЬТАТЫ
Эффект лечения комбинацией IFN-α и IFN-λ на модели гепатомы BNL
Наша главная цель заключалась в оценке противоопухолевой эффективности комбинации IFN-α / IFN-λ и изучении роли IFN при местно внедряется в микросреду опухоли. Мы использовали классический подход генной терапии для локальной доставки IFN в очаг опухоли, а также протестировали прямую инъекцию IFN в область опухоли.
Используя подход генной терапии, мы ранее продемонстрировали, что IFN-λ и IFN-α проявляют противоопухолевую активность на мышиной модели HCC, задерживая рост опухоли in vivo клеток гепатомы BNL [9]. Однако ни IFN-λ, ни IFN-α полностью не подавляли рост опухоли; наблюдалась только задержка начала развития опухоли и более медленный рост опухоли. В настоящих исследованиях мы определили, является ли комбинация IFN-λ и IFN-α более эффективной в ингибировании развития опухоли, чем любой агент по отдельности.У всех мышей, которым вводили родительские клетки BNL, клетки BNL.vector и клетки BNL.IFN-λ или BNL.IFN-α, развились опухоли (рис. 1A). Однако задержка роста опухоли наблюдалась у мышей, которым инъецировали клетки BNL.IFN-α или BNL.IFN-λ; тем не менее опухоли появились у 100% мышей (рис. 1А). Напротив, только у 50% мышей развились опухоли после инъекции комбинации клеток BNL.IFN-α и BNL.IFN-λ (BNL.IFN-α / λ), что свидетельствует о согласованном местном действии IFN-α и IFN- λ в эрадикации опухоли.
Фиг. 1. Синергетические эффекты IFN-α и IFN-λ на рост опухоли in vivo BNL.( A ) Сингенным мышам BALB / c ( n = 8) вводили подкожно. на фланге с 10 6 BNL, BNL.vector, BNL.IFN-λ, BNL.IFN-α клеток или комбинацией 50:50 обоих IFN-продуцирующих клеток. Данные кривых выживаемости Каплана-Мейера показаны как процент мышей, свободных от опухоли. BNL.IFN-α или BNL.IFN-λ по сравнению с клетками BNL.IFN-α / λ (*) p <0,05 (односторонний дисперсионный анализ). ( B ) Мышам ( n = 5 на группу) инокулировали 10 6 родительских клеток BNL сзади.После роста опухоли (1 см 3 ) было выполнено частичное удаление опухоли (0,3 см 3 слева). Затем мышей лечили 10 нг IFN-α или IFN-λ отдельно или комбинацией IFN-α и IFN-λ (50% от каждой дозы) в месте хирургического вмешательства, начиная с двух дней после операции, трех дни в неделю в течение двух недель; и наблюдали за ростом опухоли. Данные представлены в виде среднего объема опухоли ± стандартная ошибка ( n = 5). ( C ) Типичный пример, показывающий мышь, получавшую комбинацию IFN-α и IFN-λ (слева) и контроль (справа).Стрелки указывают место опухоли и область лечения комбинацией IFN-α и IFN-λ или контролем (Mock). ( D и E ) Мышам ( n = 5 на группу) инокулировали 10 6 родительских клеток BNL на шее. Когда опухоль достигла отметки около 1 см 3 , было выполнено частичное удаление опухоли. Затем мышей лечили локально в месте инокуляции опухоли на шее или системно (i. P) либо 10 нг (d), либо 50 нг (e) комбинации IFN-α и IFN-λ (50% каждого IFN доза) три дня в неделю в течение двух недель, начиная с двух дней после операции.Эксперименты повторяют 3 раза, и данные представлены в виде среднего объема опухоли ± стандартная ошибка. (*) p <0,05. p значение, определенное тестом Манна-Уитни U .
Чтобы оценить потенциальную пользу комбинации IFN-α / λ в качестве эффективной терапии рецидива рака, мышей лечили IFN после частичного удаления опухоли. Рецидив рака очень актуален в клинике, и необходимы новые методы лечения. Даже когда опухоли предположительно удалены или пораженный орган заменен, остаточные раковые клетки вызывают рецидив рака.После хирургического вмешательства по поводу рака (частичное удаление опухоли) мышей подвергали комбинированной терапии IFN-α / λ. Как показано на рисунке 1B и проиллюстрировано на рисунке 1C, мыши, получавшие локально в месте опухоли комбинацией IFN-α и IFN-λ, продемонстрировали полную ремиссию опухоли, тогда как инъекция только IFN-α или IFN-λ имела умеренную опухоль. репрессивный эффект.
Положительные противоопухолевые результаты, полученные с комбинацией IFN-α и IFN-λ, побудили нас сравнить эффекты локального, на опухолевом участке, с действием.системные внутрибрюшинные инъекции комбинации IFN-α / λ мышам с опухолью после частичного удаления опухоли. В отличие от системного введения IFN (рис. 1D и 1E), местное введение оказалось высокоэффективным у мышей после частичного удаления опухоли с использованием двух доз комбинации IFN, более низкой дозы (10 нг) и более высокой дозы. (50 нг) (рис. 1D и 1E). В высокой дозе местное введение ИФН вызывало заметное подавление опухоли (рис. 1Е). Однако более высокая доза ИФН была менее эффективной, чем более низкая доза ИФН при использовании в качестве местного лечения опухоли.Более низкая доза комбинированных IFN, вводимых местно, вызвала полную ремиссию опухоли (рис. 1C и 1D). Это указывает на то, что присутствие низких концентраций как IFN-α, так и IFN-λ в микроокружении опухоли особенно эффективно для уничтожения опухолей, оставшихся после резекции. Следовательно, местное введение низкой дозы IFN-α / λ в очаг опухоли может быть очень полезным в клинике для лечения первичных опухолей и предотвращения рецидива опухоли.
Противоопухолевый иммунитет, индуцированный комбинированной обработкой IFN-α / λ
Для того, чтобы определить, генерировали ли мыши, пережившие заражение опухолью после комбинированной обработки IFN, длительный иммунитет, мышам повторно вводили родительские клетки BNL.Через 3 месяца у большинства (75–80%) мышей развились опухоли. Только 25% и 20% повторно зараженных мышей, полученных соответственно в результате генной терапии и частичного удаления опухоли, не имели опухолей (рис. 2A и 2B), что свидетельствует об отсутствии ответа памяти, несмотря на потенциальный начальный ответ Т-клеток. Поскольку NK-клетки участвуют в противоопухолевой активности IFN-α и IFN-λ [9, 14], мы особенно сосредоточили наше исследование на роли NK-клеток в выраженной противоопухолевой активности комбинации IFN-α / λ.Сначала мы проанализировали количество и активность NK-клеток в крови мышей. Как показано на фиг. 2С, у мышей, зараженных опухолевыми клетками, наблюдалось заметное снижение циркулирующих NK-клеток по сравнению с наивными мышами. Точно так же количество циркулирующих NK-клеток все еще снижалось у мышей, несущих опухоли, экспрессирующих каждый тип IFN по отдельности или в комбинации. Кроме того, эффект IFN был связан со сниженной активацией NK-клеток в периферической крови, что оценивалось по экспрессии NKG2D (фигура 2D), предполагая, что противоопухолевая активность IFN не коррелировала со статусом активации системных NK-клеток.Однако в соответствии с высоким противоопухолевым действием IFN, доставляемых в опухоль (рис. 1B и 1C), местное рекрутирование NK-клеток может стимулироваться IFN. Действительно, иммуногистологический анализ опухоли показал высокую инфильтрацию NK-клеток, особенно в присутствии IFN-λ (рис. 2E). Тот факт, что инфильтрация опухоли NK-клетками была снижена у мышей, которым вводили комбинацию клеток BNL.IFN-α / λ, по сравнению с BNL.IFN-λ, может свидетельствовать о снижении продукции IFN-λ опухолями, которые развивались у мышей.Чтобы проверить эту гипотезу, мы проанализировали образцы опухолей ex-vivo на продукцию IFN и действительно наблюдали значительное снижение секреции IFN-λ (данные не показаны), предполагая, что в контексте смешанных клеток BNL.IFN-α / λ рост клеток BNL.IFN-λ в опухоли подавлялся. Следовательно, комбинация IFN-α / λ может действовать локально, увеличивая нацеливание на опухоль NK-клеток.
Рисунок 2: Противоопухолевый иммунитет, индуцированный комбинацией IFN-α / λ. ( A и B ) Выживших мышей в экспериментах, представленных на рисунке 1A ( n = 4) и рисунке 1C ( n = 5), соответственно, повторно заражали s.c. инъекция в исходное место инокуляции опухоли (левый фланг) 10 6 родительских клеток BNL. За мышами наблюдали в течение 3 месяцев и определяли процент мышей без опухолей. ( C и D .) Кровь выделяли у наивных мышей или мышей через 15 дней после инъекции 10 6 родительских BNL или сконструированных клеток BNL, BNL.IFN-α, BNL.IFN-λ и комбинации клеток BNL.IFN-α и BNL.IFN-λ (BNL.IFN-α / λ) (по 50% каждой). Количество циркулирующих NK-клеток CD49B + (c), CD49B + / NKG2D + NK-клеток (d) определяли с помощью проточной цитометрии в каждой группе мышей.Относительное количество клеток (%) показано как среднее значение ± стандартная ошибка ( n = 3 мыши на точку данных). Относительное количество клеток (%) показано как среднее значение ± стандартная ошибка ( n = 3 опухоли на точку данных). ( E ) Иммуногистохимическое окрашивание с зеленой флуоресценцией NK-клеток (CD49B +), проникающих в родительские или сконструированные опухоли гепатомы BNL. Изображения получали на конфокальном флуоресцентном микроскопе (x250). ( F — I ) Оценка циркулирующих популяций CD45R + / CD86 + (f), CD45R + / CD54 + (g), CD11b + / CD86 + (h) и CD11b + / CD54 + (i) в крови мышей.Кровь выделяли у наивных мышей или мышей через 15 дней после инъекции 10 6 родительских BNL или сконструированных клеток BNL, BNL.IFN-α, BNL.IFN-λ и комбинации BNL.IFN-α и BNL.IFN. -λ (BNL.IFN-α / λ) клеток (по 50% каждой). Количество клеток определяли в каждой группе мышей и представляли как относительное количество клеток (%) и отображали как среднее значение ± стандартная ошибка ( n = 3 мыши на точку данных). Значения P рассчитываются с использованием критерия Манна-Уитни U . (*) с <0.05.
Затем мы исследовали, связана ли противоопухолевая активность комбинации IFN-α / λ с системным снижением в крови других клеточных популяций, что продемонстрировано для NK-клеток. По сравнению с наивными мышами, мы наблюдали значительное увеличение популяций клеток B (CD45R +; рис. 2F и 2G) и макрофагов / дендритных (CD11b +; рис. 2H и 2I) клеток, положительных по экспрессии маркеров активации CD86 и CD54 в крови инъецированных мышей. с родительскими клетками BNL. В отличие от родительских клеток BNL, сконструированные клетки BNL не вызывали значительных изменений в этих популяциях клеток по сравнению с наивным контролем.Более значительное снижение популяции клеток CD86 + или CD54 + до нормального уровня было обнаружено у мышей, подвергнутых инъекции клеток BNL.IFN-α / λ, что свидетельствует о связи между противоопухолевой эффективностью комбинации IFN-α / λ и снижением количество активированных клеток периферической крови у мышей с опухолью.
Сенсибилизация опухолевых клеток BNL к уничтожению NK-клеток комбинацией IFN-α / λ
Комбинированная терапия IFN-α / λ индуцировала заметную противоопухолевую активность. Очевидно, этот противоопухолевый эффект зависел от согласованного действия IFN-α и IFN-λ в микроокружении опухоли.Наш иммуногистологический анализ опухолей убедительно свидетельствует об участии NK-клеток, что согласуется с предыдущими сообщениями, демонстрируя, что как IFN-α, так и IFN-λ способствуют противоопухолевой активности NK-клеток [9, 15, 16]. Чтобы выяснить роль NK-клеток в противоопухолевой активности, вызванной комбинированным лечением IFN-α / λ, мы оценили цитотоксичность опухоли, опосредованную NK-клетками. Очищенные NK-клетки из селезенки наивных мышей тестировали на их цитотоксичность опухоли на родительских клетках BNL и сконструированных клетках BNL, конститутивно продуцирующих IFN-α и IFN-λ.Как показано на фиг. 3A, наиболее сильное уничтожение клеток (цитотоксичность опухоли) наблюдалось в клетках BNL, продуцирующих как IFN-α, так и IFN-λ. Следовательно, согласованное действие IFN-α и IFN-λ имеет решающее значение для сенсибилизации опухолевых клеток к цитотоксичности опухоли, опосредованной NK-клетками. Чтобы выяснить, включает ли опосредованная NK-клетками цитотоксичность опухоли прямое взаимодействие между NK-клетками и опухолевыми клетками BNL, мы оценили участие системы NKG2D, которая, как известно, играет центральную роль в индукции опухолевых функций NK-клеток. Чтобы проверить это, наивные NK-клетки предварительно инкубировали с блокирующим антителом против NKG2D, и опосредованную NK-клетками цитотоксичность опухоли оценивали с использованием родительских и IFN-α / λ-секретирующих клеток BNL.Как показано на фиг. 3В, в клетках BNL, секретирующих IFN-α / λ, наблюдалось значительное снижение гибели клеток, что убедительно свидетельствует о том, что участие NKG2D было необходимо для опосредованной NK-клетками цитотоксичности против этих опухолевых клеток. Однако предварительное воздействие на NK-клетки IFN-α / λ умеренно влияло на их цитотоксическую активность в отношении родительских BNL-клеток (рис. 3C). Следовательно, противоопухолевые эффекты, возникающие в результате IFN-α / λ, по-видимому, зависят главным образом от сенсибилизации клеток BNL к нацеливанию на NK-клетки и лизису. Следовательно, присутствие как IFN-α, так и IFN-λ в микроокружении опухоли, по-видимому, имеет решающее значение для сенсибилизации опухоли к противоопухолевой активности, опосредованной NK-клетками, и избавления хозяина от рака (рис. 4).
Фиг. 3: NK-клетки индуцировали иммунотоксичность опухоли. ( A ) NK-клетки оценивали на их опухолевую токсичность по отношению к клеткам-мишеням, родительским клеткам BNL или сконструированным клеткам BNL, клеткам BNL.IFN-α, BNL.IFN-λ и BNL.IFN-α / λ. После совместного культивирования NK-клеток (очищенных из селезенки наивных мышей) с клетками-мишенями клетки собирали, окрашивали PI и количество гибели клеток оценивали с помощью FACS, как показано на дополнительном рисунке 1. Мертвые клетки (%) показаны как среднее ± стандартная ошибка ( n = 3 по данным).( B ) Эффект блокирующего антитела против NKG2D (C7) на повышение токсичности опухоли с использованием IFN-α / λ-секретирующих клеток BNL. После одного часа инкубации антитела против NKG2D или контрольного антитела изотипа с NK-клетками оценивали цитотоксичность опухоли. ( C ) Влияние предварительной обработки NK-клеток IFN на индукцию цитотоксичности NK-клеток в отношении родительских опухолей BNL. Мертвые клетки (%) показаны как среднее ± SE ( n = 3 по точкам данных, (**) p <0,01, (*) p <0.05). Значения P рассчитываются с использованием критерия Манна-Уитни U .
Фиг. 4. Роль NK-клеток в повышении противораковой эффективности комбинации IFN-α / λ. Внутри опухолевого участка IFN-α / λ индуцировал активацию NK-клеток, в основном за счет сенсибилизации опухолевых клеток к NK-клеткам. Согласованное действие IFN-α и IFN-λ способствует нацеливанию на опухоль NK-клеток и индуцирует эрадикацию опухоли. IFN-α / λ высвобождается в очаге опухоли путем прямой инъекции или путем секреции IFN дендритными клетками (ДК) либо обычными, либо плазмацитоидными ДК.Активация системы NKG2D с помощью IFN-α / λ, по-видимому, имеет решающее значение в микроокружении опухоли для стимулирования местного наблюдения за опухолью NK-клетками.
ОБСУЖДЕНИЕ
Хотя предыдущие исследования продемонстрировали, что один IFN-α или IFN-λ вызывает значительное подавление опухоли в модели гепатомы BNL, наблюдалась только задержка роста опухоли без увеличения выживаемости [9]. В настоящем исследовании мы оценили комбинацию IFN-α и IFN-λ как потенциальную новую противоопухолевую терапию.Примечательно, что комбинация IFN-α и IFN-λ была высокоэффективной в подавлении роста опухоли у мышей. Это наблюдалось либо с использованием подхода генной терапии (рис. 1A), либо путем прямого введения мышам с опухолью IFN-α и IFN-λ (рис. 1B и 1C). В соответствии с адъювантной терапией IFN, которая в основном используется в клинике после хирургического вмешательства [10], комбинация IFN-α и IFN-λ была более успешной, чем монотерапия IFN в искоренении опухоли и предотвращении ее рецидива (рис. 1B и 1C).В отличие от системного введения, местное введение IFN-α и IFN-λ было более эффективным в устранении опухоли, особенно при введении более низких доз IFN (рис. 1C и 1D). Более высокие количества IFN-α и IFN-λ были менее эффективны в подавлении роста опухоли. Поскольку низкие дозы IFN-α и IFN-λ были высокоэффективными в подавлении роста опухоли, у пациентов можно было ожидать ограниченных побочных эффектов, связанных с комбинированной терапией IFN-α / λ. Присутствие подходящего уровня IFN-α и IFN-λ в микроокружении опухоли кажется необходимым для оптимальной эрадикации опухоли.В клинике значительная лимфотоксичность была связана с высокими дозами IFN-α, что позволяет предположить, что чрезмерная доза IFN может поставить под угрозу полезный иммунный ответ против опухолевых клеток. [10, 11]. Наши результаты показывают, что согласованное действие IFN-α и IFN-λ имеет решающее значение для обеспечения сильного противоопухолевого иммунитета NK-клеток, в основном за счет сенсибилизации опухоли к NK-клеткам (Рисунок 3A), а не за счет прямой модуляции функций NK-клеток (Рисунок 3D). ). В отличие от IFN-α, мы не наблюдали прямого ответа NK-клеток на IFN-λ (рис. 3D), что согласуется с нашим предыдущим отчетом [9] и другими исследованиями, демонстрирующими, что IFN-λ не действует напрямую на NK. клетки [17, 18].Следовательно, вероятно, что активации NK-клеток в большей степени способствует прямое действие IFN-α, тогда как одновременное действие IFN-λ и IFN-α на опухолевые клетки делает их лучшей мишенью для цитотоксичности, опосредованной NK-клетками. Мы продемонстрировали, что нацеливание на опухоль NK-клеток происходит через активатор рецептора NKG2D [19–21]. Повышенная регуляция лиганда NKG2D, H60 с помощью IFN-λ, была предложена в модели меланомы B16 [22]. Однако согласованное действие IFN-α и IFN-λ на опухолевые клетки может иметь большее влияние на баланс экспрессии рецепторов активатора и ингибитора NK-клеток, которые контролируют опухолевые функции NK-клеток [20, 21].
Наше исследование поддерживает использование адоптивного переноса NK-клеток в качестве терапевтической стратегии лечения ГЦК в соответствии с недавними сообщениями [23, 24]. Однако это предполагает, что альтернативные стратегии, не основанные на прямой активации NK-клеток, как обычно сообщается, также могут быть использованы для стимулирования терапии NK-клетками [25]. Наши результаты показывают, что для создания успешной терапии NK-клетками против HCC и, возможно, других видов рака решающее значение имеет сенсибилизация опухолевых клеток к опосредованной NK-клетками цитотоксичности опухоли.Введение IFN-α и IFN-λ в микроокружение опухоли будет иметь центральное значение в стимулировании сенсибилизации опухоли к NK-клеткам. Соответствующее производство IFN-α и IFN-λ в микроокружении опухоли может происходить естественным образом через потенциальные пути сенсорного контроля опухоли, такие как STING [26, 27]. Дефицит этих путей может нарушить выработку IFN и усилить развитие опухоли. Введение IFN-α и IFN-λ в микроокружение опухоли может быть полезным для исправления потенциальных недостатков сенсорных путей опухоли и привело к индукции противоопухолевых ответов.
Также следует отметить, что недавние исследования выявили связь между набором связанных полиморфизмов в локусе IFN-λ и успехом лечения на основе IFN-α у пациентов, хронически инфицированных HCV [28]. Эти полиморфизмы могут модулировать экспрессию или активность IFN-λ [29, 30] или IFN-λR1 [31] и, в свою очередь, влиять на терапию IFN-α. Сообщалось, что полиморфизм IFN-λ также связан с измененными функциями NK-клеток [32, 33]. Кроме того, обработка клеток IFN-λ индуцирует несколько негативных регуляторов передачи сигналов IFN и снижает чувствительность клеток к IFN-α [34–36].Все эти исследования предполагают существование многоуровневого перекрестного взаимодействия между IFN-λ и IFN-α, которое лежит в основе синергетической противоопухолевой активности этих IFN, наблюдаемой в текущем исследовании.
В заключение, наше исследование демонстрирует, что IFN-α и IFN-λ обладают неизбыточной противоопухолевой активностью, и подчеркивает согласованную роль IFN-α и IFN-λ в обеспечении нацеливания на опухоль NK-клеток. Аддитивные и дополнительные противоопухолевые механизмы IFN типа I и типа III, наблюдавшиеся в текущих и предыдущих исследованиях [9, 15, 37, 38], предполагают, что комбинаторная терапия с использованием IFN-α и IFN-λ должна быть дополнительно изучена для улучшения основанных на IFN иммунотерапия рака.
МАТЕРИАЛЫ И МЕТОДЫ
Клетки, трансфекции и экспрессионные плазмиды
Клетки BNL мышиной гепатоцеллюлярной карциномы, полученные из BALB / c, поддерживали в среде DMEM с 10% FBS. Экспрессионные плазмиды pEF-mIFN-λ2 и pEF-mIFN-α7 были описаны ранее [9, 12]. Плазмиды pEF-mIFN-λ2 и pEF-mIFN-α7 стабильно трансфицировали в 10 6 клеток BNL с использованием реагента транзитного LT1 (Mirus, Madison, WI). G418-устойчивые клетки отбирали с использованием 500 мкг / мл Geneticin (Invitrogen, Carlsbad, CA), как описано ранее [9, 12].
Анализ проточной цитометрии
Для оценки влияния комбинации IFN-α / IFN-λ на активацию популяций мононуклеарных клеток периферической крови (PBMC) у мышей, несущих опухоли, у мышей (после анестезии) извлекали цельную кровь через 14 дней после инъекция опухоли родительскими клетками или клетками BNL, экспрессирующими IFN-α и IFN-λ. Кровь собирали в пробирки, содержащие цитрат натрия для предотвращения коагуляции. Перед анализом проточной цитометрии кровь очищали от красных кровяных телец с использованием буфера для лизиса, как рекомендовано производителем (Sigma, Saint Louis, MO, USA).Использовали аналогичный объем PBMC (100 мкл). Чтобы определить абсолютное количество клеток в каждом образце, мы использовали подсчет ярких шариков перед получением проточной цитометрии. Кровь из каждой группы (3-5 мышей) анализировали индивидуально и определяли% от общей или относительной популяции клеток.
Активированные PBMC, B-клетки (CD45R + / CD86 +, CD45R + / CD54 +), моноциты (CD11b + / CD86 +, CD11b + / CD54 +) и NK-клетки (CD49B + / NKG2D +) были дважды окрашены крысиными моноклональными антителами против CD45R APC, CDT11b PE Laboratories, Burlingame, CA) или CD49B FITC (Pan NK-клетки) (BioLegend, Сан-Диего, Калифорния, США), вместе с CD54 FITC, CD86 FITC и NKG2D PE (BioLegend, Сан-Диего, Калифорния, США).Окрашенные клетки (10 4 ) анализировали проточной цитометрией, как описано ранее [9, 12], с использованием проточной цитометрии Beckman Coulter Gallios (компенсация выполнялась с помощью программного обеспечения Gallios во время сбора образцов).
Трансплантация опухоли и лечение IFN
Иммунокомпетентные самки мышей BALB / c (в возрасте 6–8 недель) были получены из лаборатории Джексона (Бар-Харбор, штат Мэн, США) и содержались в помещении, свободном от патогенов. Мышам BALB / c вводили подкожно (п / к) в бок или спину 10 6 клеток BNL (родительских или трансфицированных пустой плазмидой), BNL.Клетки IFN-α, клетки BNL.IFN-λ или комбинация 50:50 клеток BNL.IFN-α и BNL.IFN-λ в 0,1 мл PBS. Рост опухоли оценивали путем пальпации места инъекции каждые 2 дня. После того, как у мышей развиваются опухоли (~ 0,5 см 3 ), более низкая доза (10 нг) или более высокая доза (50 нг) IFN-α или IFN-λ по отдельности или в комбинации (50% каждого), разведенная в 0,1 мл PBS вводили локально в место опухоли или внутрибрюшинно каждые 3 дня в течение 2 недель. За мышами наблюдали на предмет развития опухоли в течение дополнительных 3 недель.В других группах аналогичные дозы IFN вводили мышам после частичного хирургического удаления опухоли (~ 0,3 см 3 оставшаяся опухоль из опухоли ~ 1 см 3 ). Лечение интерфероном начинали через 2 дня после операции и поддерживали каждые 3 дня в течение 2 недель. Объем опухоли измеряли штангенциркулем Вернье. Объем опухоли (кубический миллиметр) рассчитывали по формуле ab 2 /2, где a = наибольший диаметр и b = наименьший диаметр. Животных с избыточной опухолевой массой (≥ 1 см 3 ) умерщвляли.Мышам, у которых отторгались опухоли, повторно вводили 10 6 родительских клеток BNL и наблюдали за потенциальным повторным развитием опухоли в течение 3 месяцев.
Цитотоксичность NK-клеток, иммуногистохимия и блокирование NKG2D
Цитотоксичность NK-клеток оценивали с помощью FACS и окрашивания пропидиум йодидом (PI). 5 × 10 3 клеток-мишеней (родительские клетки BNL и клетки BNL, экспрессирующие IFN-α и / или IFN-λ) и 2,5 × 10 4 NK-клеток были совместно инкубированы в течение 4 часов при 37 ° ° C и 5 % CO 2 .NK-клетки предварительно обрабатывали или не обрабатывали в течение 12 часов предварительным анализом иммунотоксичности IFN [10 нг IFN-α или IFN-λ по отдельности или в комбинации (50% каждого)]. Клетки собирали и ресуспендировали в 500 мкл PBS. К клеткам добавляли 5 мкл PI, и жизнеспособность / смертность клеток анализировали с помощью FACS (прямое и разбросанное), как показано на дополнительном рисунке 1.
Иммуногистохимия опухолей для инфильтрации NK-клеток выполнялась, как описано ранее [9, 13] . Для блокирования NKG2D мы использовали моноклональное антитело C7, которое реагирует с мышиным NKG2D (eBioscience, Сан-Диего, Калифорния, США).Был включен контроль изотипа IgG армянского хомяка (клон: eBio299Arm, eBioscience, Сан-Диего, Калифорния, США). 2,5 × 10 4 NK-клеток предварительно инкубировали с блокирующим антителом против NKG2D или изотипическим контролем в течение 1 часа (37 ° C 5% CO 2 ) при 20 мкг / мл перед анализом иммунотоксичности. Анализ иммунотоксичности с NK-клетками проводили аналогично тому, как описано выше, путем совместной инкубации 5 × 10 3 клеток-мишеней (родительских клеток BNL и клеток BNL, экспрессирующих IFN-α и / или IFN-λ) с 2.5 × 10 4 NK ячеек. Перед исследованием иммунотоксичности NK-клетки обрабатывали или не обрабатывали IFN-α / λ (10 нг / мл IFN-α или IFN-λ в течение 2–10 часов). Выделение NK-клеток из суспензий одиночных клеток селезенки мышей выполняли с использованием набора для выделения NK-клеток II (Miltenyi Biotech, Auburn CA, USA).
Анализ данных
Оценщик Каплана-Мейера использовали для расчета среднего времени выживания (появления опухоли) и построения кривых появления опухоли (выживаемости). Статистический анализ проводился с использованием однофакторного дисперсионного анализа и критерия Манна-Уитни U .Различия считались статистически значимыми при p <0,05.
БЛАГОДАРНОСТИ
Мы благодарим Wenjin Chen (Институт рака Рутгерса, Нью-Джерси, Нью-Брансуик, штат Нью-Джерси) за графическую помощь.
КОНФЛИКТЫ ИНТЕРЕСОВ
Авторы не раскрывают никаких потенциальных конфликтов интересов.
ПОДДЕРЖКА ГРАНТА
Это исследование было поддержано премией CINJ, P30 ES005022 от Национального института науки о гигиене окружающей среды и RO1 AI057468 от Национального института аллергии и инфекционных заболеваний.
СПИСОК ЛИТЕРАТУРЫ
1. Шерман М. Гепатоцеллюлярная карцинома: эпидемиология, наблюдение и диагностика. Семинары по заболеваниям печени. 2010; 30: 3–16.
2. Георгиадес С., Гешвинд Дж. Ф., Харрисон Н., Хайнс-Перальта А., Лиапи Е., Хонг К., Ву З., Камель И., Франгакис К. Отсутствие реакции после начальной химиоэмболии при гепатоцеллюлярной карциноме: предсказывает ли она неудачу последующего лечения ? Радиология. 2012.
3. Меллоул Э, Лезуртель М, Карр Б.И., Клавьен, Пенсильвания. Разработки в области трансплантации печени при гепатоцеллюлярной карциноме.Семинары по онкологии. 2012; 39: 510–521.
4. Шимомура С., Икеда Н., Сайто М., Исии А., Такашима Т., Сакаи Ю., Йошикава С., Айзава Н., Танака Х., Ивата Й, Эномото Х, Иманиши Х, Ямамото Т. и др. Длительная терапия интерфероном после радиочастотной абляции эффективна при лечении пациентов с гепатоцеллюлярной карциномой, ассоциированной с HCV. Hepatol Int. 2010; 5: 559–566.
5. Лин С.М., Ю М.Л., Ли С.М., Чиен Р.Н., Шин И.С., Чу С.М., Лиав Ю.Ф. Терапия интерфероном при HBeAg-положительном хроническом гепатите снижает прогрессирование до цирроза и гепатоцеллюлярной карциномы.J Hepatol. 2007; 46: 45–52.
6. Ю М.Л., Линь С.М., Чуанг В.Л., Дай С.Й., Ван Дж.Х., Лу С.Н., Шин И.С., Чанг В.Й., Ли С.М., Лиав Ю.Ф. Устойчивый вирусологический ответ на интерферон или интерферон / рибавирин снижает гепатоцеллюлярную карциному и улучшает выживаемость при хроническом гепатите C: общенациональное многоцентровое исследование на Тайване. Антивир Тер. 2006; 11: 985–994.
7. Исикава Т. Вторичная профилактика рецидивов с помощью терапии интерфероном после абляционной терапии гепатоцеллюлярной карциномы у пациентов с хроническим гепатитом С.Всемирный гастроэнтерологический журнал. 2008; 14: 6140–6144.
8. Исикава Т., Хигучи К., Кубота Т., Секи К., Хонма Т., Йошида Т., Камимура Т. Комбинированная терапия пег-интерфероном a-2b / рибавирином после лечения гепатоцеллюлярной карциномы, ассоциированной с вирусом гепатита С, способна улучшить состояние печени. Функциональный резерв и выживание. Гепатогастроэнтерология. 2012; 59: 529–532.
9. Абушахба В., Балан М., Кастанеда И., Юань Ю., Ройл К., Равеш Е., де ла Торре А., Ласфар А., Котенко С.В. Противоопухолевая активность интерферонов I и III типа на модели гепатомы BNL.Cancer Immunol Immunother. 2010; 59: 1059–1071.
10. Йонаш Э., Халуска Ф.Г. Интерферон в онкологической практике: обзор биологии интерферона, его клинического применения и токсичности. Онколог. 2001; 6: 34–55.
11. Pestka S, Krause CD, Walter MR. Интерфероны, интерфероноподобные цитокины и их рецепторы. Immunol Rev.2004; 202: 8–32.
12. Ласфар А., Льюис-Антес А., Смирнов С.В., Ананта С., Абушахба В., Тиан Б., Рейл К., Диккеншитс Х., Шейх Ф., Доннелли Р.П., Равече Е., Котенко С.В.Характеристика системы IFN-лямбда-лиганд-рецептор мыши: IFN-лямбды проявляют противоопухолевую активность в отношении меланомы B16. Исследования рака. 2006; 66: 4468–4477.
13. Виллемен Ю., Ван ден Берг Дж. М., Лион Э., Ангиль С., Руландтс В. А., Ван Акер Х. Х., Хейндерикс С. Д., Стейн Б. М., Петерс М., Фигдор К. Г., Ван Тендело В. Ф., де Фрис И. Дж., Адема Дж. Дж. И др. . Конструирование дендритных клеток, полученных из моноцитов, для секреции интерферона-альфа, усиливает их способность стимулировать адаптивные и врожденные эффекторные противоопухолевые иммунные функции.Cancer Immunol Immunother. 2015; 64: 831–842.
14. Сато А., Оцуки М., Хата М., Кобаяши Е., Мураками Т. Противоопухолевая активность IFN-лямбда в моделях опухолей мышей. J Immunol. 2006; 176: 7686–7694.
15. Соуза-Фонсека-Гимарайнш Ф., Янг А., Миттал Д., Мартинет Л., Брюдигам С., Такеда К., Андониу С.Э., Дели-Эспости М.А., Хилл Г.Р. и Смит М.Дж. NK-клетки нуждаются в IL-28R для оптимальной активности in vivo . Proc Natl Acad Sci U S A 2015.
16. Зитвогель Л., Галлуцци Л., Кепп О., Смит М.Дж., Кремер Г.Интерфероны I типа в противоопухолевом иммунитете. Nat Rev Immunol. 2015; 15: 405–414.
17. de Groen RA, Boltjes A, Hou J, Liu BS, McPhee F, Fribourg J, Janssen HL, Boonstra A. Опосредованная IFN-лямбда продукция IL-12 в макрофагах индуцирует продукцию IFN-гамма в человеческих NK-клетках. Eur J Immunol. 2015; 45: 250–259.
18. Моррисон М.Х., Кин С., Куинн Л.М., Келли А., О’Фаррелли С., Бергин С., Гардинер С.М. Цитокины IFNL не модулируют функции NK-клеток человека или мыши. Hum Immunol. 2014; 75: 996–1000.
19. Лангерс И., Рену В.М., Тири М., Делвенн П., Якобс Н. Естественные клетки-киллеры: роль в локальном росте опухоли и метастазировании. Биопрепараты: мишени и терапия. 2012; 6: 73–82.
20. Lanier LL. Вверх по канату: активация и ингибирование естественных клеток-киллеров. Nat Immunol. 2008; 9: 495–502.
21. Вивье Э., Раулет Д.Х., Моретта А., Калиджури М.А., Зитвогель Л., Ланье Л.Л., Йокояма В.М., Уголини С. Врожденный или адаптивный иммунитет? Пример естественных клеток-киллеров. Наука. 2011; 331: 44–49.
22. Wongthida P, Diaz RM, Galivo F, Kottke T., Thompson J, Pulido J, Pavelko K, Pease L, Melcher A, Vile R. Интерлейкин-28 типа III опосредует противоопухолевую эффективность онколитического вируса VSV в иммунной системе. -компетентные мышиные модели рака. Исследования рака. 2010; 70: 4539–4549.
23. Нишида С., Леви Д.М., Цакис А.Г. Инокулят естественных киллеров печени для трансплантации печени с гепатоцеллюлярной карциномой. Curr Opin Трансплантация органов. 2013; 18: 690–694.
24. Охира М., Нисида С., Трифонопулос П., Текин А., Селваджи Дж., Мун Дж., Леви Д., Рикорди К., Исияма К., Танака Ю., Охдан Х., Цакис А.Г.Выделение в клиническом масштабе стимулированных интерлейкином-2 естественных клеток-киллеров печени для лечения трансплантации печени с гепатоцеллюлярной карциномой. Трансплантация клеток. 2012; 21: 1397–1406.
25. Чайлдс Р.В., Карлстен М. Терапевтические подходы к усилению цитотоксичности естественных клеток-киллеров против рака: сила пробуждается. Nat Rev Drug Discov. 2015; 14: 487–498.
26. Ан Дж., Ся Т., Конно Х., Конно К., Руис П., Барбер Г. Н.. Канцерогенез, вызванный воспалением, опосредуется STING. Nat Commun.2014; 5: 5166.
27. Woo SR, Fuertes MB, Corrales L, Spranger S, Furdyna MJ, Leung MY, Duggan R, Wang Y, Barber GN, Fitzgerald KA, Alegre ML, Gajewski TF. Зависимость от СИНГ-зависимой цитозольной ДНК опосредует распознавание иммуногенными опухолями врожденным иммунитетом. Иммунитет. 2014; 41: 830–842.
28. Суппиа В., Молдован М., Аленстиэль Дж., Берг Т., Велтман М., Абате М.Л., Бассендин М., Спенглер Ю., Дор Дж. Дж., Пауэлл Е., Риордан С., Шеридан Д., Смедиле А. и др. IL28B связан с ответом на терапию интерфероном-альфа и рибавирином при хроническом гепатите С.Нат Жене. 2009; 41: 1100–1104.
29. McFarland AP, Horner SM, Jarret A, Joslyn RC, Bindewald E, Shapiro BA, Delker DA, Hagedorn CH, Carrington M, Gale M Jr, Savan R. Благоприятный генотип IFNL3 избегает распада мРНК, опосредованного AU-богатыми элементы и микроРНК, индуцированные вирусом гепатита С. Nat Immunol. 2014; 15: 72–79.
30. Terczynska-Dyla E, Bibert S, Duong FH, Krol I, Jorgensen S, Collinet E, Kutalik Z, Aubert V, Cerny A, Kaiser L, Malinverni R, Mangia A, Moradpour D, et al. Снижение активности IFNlambda4 связано с улучшенным клиренсом HCV и снижением экспрессии генов, стимулированных интерфероном.Nat Commun. 2014; 5: 5699.
31. Дуонг Ф.Х., Тринчуччи Г., Болданова Т., Калабрезе Д., Кампана Б., Крол I, Дюран С.К., Хейдманн Л., Цейзель М.Б., Баумерт Т.Ф., Хайм М.Х. Экспрессия рецептора 1 IFN-лямбда индуцируется при хроническом гепатите C и коррелирует с генотипом IFN-lambda3 и с невосприимчивостью к терапии IFN-альфа. J Exp Med. 2014; 211: 857-868.
32. Голден-Мейсон Л., Бамбха К.М., Ченг Л., Хауэлл С.Д., Тейлор М.В., Кларк П.Дж., Афдал Н., Розен Х.Р. Экспрессия рецепторов, ингибирующих естественные киллеры, связанная с неэффективностью лечения и генотипом интерлейкина-28B у пациентов с хроническим гепатитом С.Гепатология. 2011; 54: 1559–1569.
33. Мэн К., Рани М.Р., Сугальски Д.М., судья С.Дж., Фат С., Родригес Б., Блэнтон Р.Э., Энтони Д.Д. Естественная цитотоксичность, зависящая от рецептора, цитолитическая активность природных киллеров, направленная на вирус гепатита C (HCV), связана с воспалением печени, афроамериканской расой, генотипом IL28B и ответом на терапию пегилированным интерфероном / рибавирином при хронической инфекции HCV. J Infect Dis. 2014; 209: 1591–1601.
34. Буркарт К., Аримото К., Тан Т., Конг Х, Сяо Н., Лю Ю.С., Котенко С.В., Эллис Л.Г., Чжан Д.Э.Эпителиальные клетки молочной железы с дефицитом Usp18 создают противоопухолевую среду, управляемую гиперчувствительностью к IFN-лямбда и повышенной секрецией Cxcl10. EMBO Mol Med. 2013; 5: 967-982.
35. Francois-Newton V, Magno de Freitas Almeida G, Payelle-Brogard B, Monneron D, Pichard-Garcia L, Piehler J, Pellegrini S, Uze G. Контроль отрицательной обратной связи на основе USP18 индуцируется типом I и типом III интерфероны и, в частности, инактивирует ответ интерферона альфа. ПлоС один. 2011; 6: e22200.
36.Маковска Z, Duong FH, Trincucci G, Tough DF Heim MH. На передачу сигналов интерферона-бета и интерферона-лямбда не влияет индуцированная интерфероном рефрактерность к интерферон-альфа in vivo . Гепатология. 2011; 53: 1154–1163.
37. Fujie H, Tanaka T, Tagawa M, Kaijun N, Watanabe M, Suzuki T, Nakayama K, Numasaki M. Противоопухолевое действие интерферона типа III отдельно или в комбинации с интерфероном типа I против немелкоклеточного рака легкого человека . Cancer Sci. 2011; 102: 1977–1990.
38.Stiff A, Carson III W. Исследования интерферона-лямбда для лечения рака. J. Врожденный иммунитет. 2015; 7: 243–250.
Устранение N-гликозилирования путем сайт-мутации дополнительно увеличивает период полужизни слитых белков IFN-α / Fc, экспрессируемых в Pichia pastoris | Фабрики микробных клеток
Штаммы, плазмиды, антитела и оборудование
Pichia pastoris штамм GS115, Escherichia coli штамм DH5α и вектор экспрессии pPIC9 были приобретены у Invitrogen (Life Technologies).Клетки MDBK и Daudi были получены от Wuhan Boster. Плазмида pPIC9K-Kex-IFNα2b-Fcγ1 с кодирующим геном слитого человеческого IFN-α2b и Fc-фрагмента человеческого IgG1 дикого типа была сконструирована и сохранена в нашей лаборатории [13]. Клетки WISH, обычный IFN-α и моноклональное антитело против IFN-α были получены от Anke Biotechnology Group. Конъюгированные с HPR антимышиные антитела были приобретены в Cell Signaling. Ферментер на 14 л (New Brunswick BioFlo115), используемый в экспериментальной ферментации, был получен от Eppendorf.Система с гибким штативом с фильтрующими картриджами с половолоконной мембраной 0,45 мкм и система AKTA Avant с колонками MabSelect и S-200 HR были получены от GE Healthcare.
Молекулярный дизайн и клонирование
Слитый белок IFN-α / Fc-WT секретировался в культуральную среду в виде активной формы дисульфидно-связанного гомодимера с одной модификацией N-гликозилирования в Fc-области IgG1 в каждой молекуле. ПЦР с удлинением перекрывания использовали для сайт-специфического мутагенеза сайта гликозилирования на Fc-фрагменте IgG1 и для вставки гибкого GS-линкера между С-концом IFN-α и N-концом Fc-фрагмента IgG1.
Пары праймеров (см. Дополнительный файл 1: Таблица S1) α-Fw и SC-Rv, SC-Fw и M-Rv, и M-Fw и Fc-Rv использовали для амплификации трех частей слитой кодирующей последовательности мономер IFN-α / Fc-SC на матричной плазмиде pPIC9K-Kex-IFNα2b-Fcγ1 (pIFN-α / Fc-WT), которую использовали для экспрессии слитого белка IFN-α / Fc-WT. Процедура ПЦР была следующей: 94 ° C в течение 5 мин; 32 цикла: 94 ° C в течение 30 с, 55 ° C в течение 40 с и 72 ° C в течение 60 с; и 72 ° C в течение 10 мин. Пару праймеров α-Fw и Fc-Rv использовали для сплайсинга трех амплифицированных частей для получения полного слитого IFN-α2b и гена IgG1.Процедура ПЦР была следующей: 94 ° C в течение 5 мин; 32 цикла: 94 ° C в течение 30 с, 55 ° C в течение 40 с и 72 ° C в течение 120 с; и 72 ° C в течение 10 мин. Этот недавно амплифицированный ген, кодирующий одноцепочечный IFN-α2b и слитый с Fc-фрагментом IgG1 белок, содержал мутированный сайт гликозилирования на Fc-фрагменте IgG1 (297 N к Q) со вставкой линкера GS между IFN-α2b и IgG1. Фрагмент Fc. Амплифицированный ген расщепляли рестрикционными ферментами Bam H I и Eco R I и вставляли в тот же расщепленный вектор pPIC9.Этот рекомбинантный вектор экспрессии обозначается как pIFN-α / Fc-SC.
Пары праймеров α-Fw и MD-Rv и MD-Fw и Fc-Rv использовали для амплификации двух частей слитых кодирующих последовательностей гомодимера IFN-α / Fc-MD на матричной плазмиде pIFN-α / Fc. -SC. Процедура ПЦР была следующей: 94 ° C в течение 5 мин; 32 цикла: 94 ° C в течение 30 с, 55 ° C в течение 40 с и 72 ° C в течение 60 с; и 72 ° C в течение 10 мин. Пару праймеров α-Fw и Fc-Rv использовали для сращивания двух амплифицированных частей для получения полного слитого IFN-α2b и гена IgG1.Процедура ПЦР была следующей: 94 ° C в течение 5 мин; 32 цикла: 94 ° C в течение 30 с, 55 ° C в течение 40 с и 72 ° C в течение 120 с; и 72 ° C в течение 10 мин. Этот недавно амплифицированный ген, кодирующий гомодимеризованный IFN-α2b и слитый с Fc-фрагментом IgG1 белок, также содержал мутированный сайт гликозилирования на Fc-фрагменте IgG1 со вставкой белкового линкера между IFN-α2b и Fc-фрагментом IgG1. Этот вновь амплифицированный ген переваривали рестрикционными ферментами Bam H I и Eco R I и вставляли в тот же расщепленный вектор pPIC9.Этот рекомбинантный вектор экспрессии был обозначен как pIFN-α / Fc-MD.
Скрининг экспрессии
Рекомбинантные векторы экспрессии pIFN-α / Fc-WT, pIFN-α / Fc-MD и pIFN-α / Fc-SC были линеаризованы рестрикционным ферментом Sal I. Линеаризованные векторы трансформировали в штамм GS115 P. pastoris . Положительные трансформанты подвергали скринингу на планшетах MD и исследовали с помощью вестерн-блоттинга с использованием конъюгатов антител против человеческого IgG-HRP в соответствии с предыдущим отчетом [14].
Ферментация и очистка
Процесс периодической ферментации с подпиткой выполняли в 14-литровом ферментере (NBS BioFlo 115) с 6-литровой средой BMGY, содержащей 4% глицерина, согласно предыдущим сообщениям с необходимыми изменениями [15].В частности, температуру культивирования поддерживали на уровне 25 ° C, а pH регулировали на уровне 6,0 с помощью гидроксида аммония. Более того, после индукции 100% метанолом с добавлением 12 мл / л раствора PTM1, DO был установлен примерно на 30% насыщения воздухом, и ферментация продолжалась менее 18 часов для уменьшения разложения целевых продуктов. В конце ферментации pH ферментационного бульона доводили до 8,0 с помощью 5 M NaOH, а затем центрифугировали в течение 20 минут при 10,000 g .После центрифугирования супернатант фильтровали через мембраны из полых волокон 0,45 мкм с использованием настольной системы FlexStand. Колонку для аффинной хроматографии HiTrap MabSelect использовали для захвата рекомбинантных IFN-α / Fc-слитых белков из осветленных супернатантов. Захваченные белки дополнительно очищали с помощью эксклюзионной хроматографии HiPrep Sephacryl S-200 HR и хранили при -80 ° C.
Характеристика слитых белков
SDS-PAGE в восстановленных и невосстановленных условиях выполняли для анализа очищенных белков.Загружали приблизительно 10 мкг каждого слитого белка IFN-α / Fc и разделяли с помощью 10% SDS-PAGE; гель окрашивали бриллиантовым синим кумасси. Вестерн-блоттинг также выполняли с использованием моноклонального антитела против IFN-α или конъюгатов против человеческого IgG-HRP. Образцы белка разделяли с помощью 10% SDS-PAGE в восстановленных условиях и затем переносили на PVDF-мембрану на 30 минут при 18 В. Мембрану блокировали 5% обезжиренным молоком в течение 1 часа, а затем инкубировали с указанными антителами. Мембрану трижды промывали TBST и затем инкубировали с конъюгированными с мышиной HRP вторичными антителами.Белок детектировали с помощью набора для определения хемилюминесценции после трехкратной промывки мембраны TBST. Набор для окрашивания периодической кислотой-Шиффом (PAS) (№ по каталогу DG0005, Beijing Leagene Biotechnology) использовали в соответствии с инструкциями производителя для характеристики гликозилированной модификации слитых белков. Рекомбинантные белки также анализировали методом жидкостной хроматографии-масс-спектрометрии (ЖХ-МС), как описано ранее [16].
Анализ противовирусной активности
Клетки WISH или MDBK разбавляли DMEM, содержащей 10% фетальной телячьей сыворотки (FBS), до 2.5 × 10 5 –3,5 × 10 5 клеток / мл. В каждую лунку 96-луночного планшета засевали 100 мкл этих разведенных клеток. Примерно через 6 часов среду заменили на DMEM, содержащую 7% FBS и серийно разведенные образцы. Через 24 ч среду заменяли на DMEM, содержащую 3% FBS и 100 TCID 50 VSV. Еще через 24 часа жизнеспособность клеток измеряли с помощью анализа МТТ. Активность различных образцов рассчитывалась с помощью программы Origin 8. Эксперименты проводили в трех повторностях.
Анализ антипролиферации
Клетки Дауди разбавляли DMEM, содержащей 10% FBS, до 5 × 10 5 клеток / мл. В каждую лунку 96-луночного планшета засевали 50 мкл разведенных клеток. Затем добавляли 50 мкл DMEM, содержащей 10% FBS, и серийно разбавляли образцы. Через 72 часа жизнеспособность клеток измеряли с помощью теста МТТ. Значения EC 50 для различных образцов были рассчитаны с использованием программного обеспечения Origin 8. Эксперименты проводили в трех повторностях.
Анализ мРНК 2 ‘, 5’-олигоаденилатсинтетазы (OAS)
PBMC человека выделяли из периферической крови здоровых взрослых добровольцев с помощью центрифугирования в градиенте плотности Ficoll и разбавляли средой RPMI 1640, содержащей 10% FBS, до 1.5 × 10 5 –2,0 × 10 5 клеток / мл. В каждую лунку 6-микролуночного планшета засевали 2 мл разведенных клеток. После 12 ч инкубации указанные образцы добавляли в каждую лунку до конечной концентрации 10 нг / мл. Через 20 ч инкубации суммарную РНК культивируемых клеток выделяли с помощью экстракции TRIzol. Количественная ОТ-ПЦР в реальном времени использовалась для обнаружения экспрессии целевых генов в соответствии с предыдущим отчетом [1].
Фармакокинетическое исследование
Пятнадцать крыс Sprague – Dawley (SD) с массой от 180 до 220 г были случайным образом и поровну разделены на пять групп.Для анестезии животных использовали 20% раствор этилкарбамата в дозе 5 мл / кг. После анестезии указанные образцы вводили внутривенно соответствующим группам животных однократной дозой 30 мкг / кг. Образцы крови обработанной группы собирали до введения дозы и в следующие моменты времени после введения дозы: 0,2, 8, 24, 48, 72, 96, 120 и 144 часа. Гепарин натрия использовали для антикоагуляции, а затем образцы крови центрифугировали для сбора плазмы. Уровни интерферона в образцах крови анализировали с использованием набора цитометрических шариков (CBA) в соответствии с инструкциями производителя.Фармакокинетические параметры рассчитывали с помощью программного обеспечения PKsolver с некомпартментной моделью [17].
Статистический анализ
Различия между группами анализировали, применяя односторонний дисперсионный анализ (ANOVA) с тестом Тьюки (P <0,05 как значимый, P <0,01 как высокий уровень значимости, P <0,001 как очень высокий уровень значимости).
Эффективная противоопухолевая эффективность нового рекомбинантного интерферона типа I in vivo
% PDF-1.7 % 161 0 объект > эндобдж 160 0 объект > поток Издатель расширенной печати Arbortext 9.1.406 / W Unicode2021-09-29T23: 33: 47-07: 002017-02-06T09: 01: 13 + 05: 302021-09-29T23: 33: 47-07: 00application / pdf
Универсальный белок IFN типа I (11200-1): Novus Biologicals
Резюме по универсальному белку IFN типа I
| Дополнительная информация | (Рекомбинантный человеческий IFN-альфа A / D [BglII]) |
| Тип белка / пептида | Рекомбинантные белки |
| Джин | IFNA2 |
Применения / разбавления
Упаковка, хранение и составы
| Хранение | Храните закрытый продукт при температуре от -20 до -70 ° C.Используйте морозильную камеру для ручного размораживания и избегайте повторяющихся циклов замораживания-оттаивания. Не используйте просроченный срок годности. |
Банкноты
Этот продукт производится и поставляется компанией R&D Systems, Inc., торговой маркой Bio-Techne.
Альтернативные названия универсального белка IFN типа I
- IFNA
- IFNA2
- IFNA2b
- IFNalpha
- IFN-alpha
- IFN-alphaA
- INFA2
- интерферон альфа 2
- LeIF D
Фон
Интерферон-альфа (IFN-альфа), также известный как лейкоцитарный интерферон, представляет собой группу родственных, но различных белков, которые имеют более 95% гомологии аминокислотных последовательностей.Они являются членами семейства интерферонов типа I, которые имеют общий рецептор клеточной поверхности, состоящий из двух субъединиц: лиганд-связывающей субъединицы 100 кДа (IFN-альфа R2) и 125-кДа лигандсвязывающей субъединицы и субъединицы передачи сигнала (IFN-альфа R1). который участвует как в связывании лиганда, так и в передаче сигнала. IFN-альфа обладает как противовирусной, так и иммуномодулирующей активностью в отношении клеток-мишеней.
Покупатели, которые просматривали этот товар, также просматривали …
Виды: Hu, Mu, Rt
Применения: WB, Flow, ICC / IF, IHC, IHC-P
Виды: Mu, Rt
Приложения: WB, ELISA, ICC / IF, IHC, IHC-Fr, IHC-P
Виды: Hu, Mu, Rt, Ye, Xp (-)
Приложения: WB, ELISA, Flow, ICC / IF, IHC, IHC-Fr, IHC-P, IP, CyTOF-ready, Flow -IC
Породы: Hu, Mu, Rt, Ze
Применения: WB, Flow, ICC / IF, IHC, IHC-P, IP
Виды: Hu
Приложения: WB, ELISA, S-ELISA
Виды: Hu, Mu, Rt
Применения: WB, Flow, ICC / IF, IHC, IHC-P
Виды: Hu, Mu, Rt
Применения: WB, Flow, IHC, IHC-P
Виды: Hu, Mu, Rt
Применения: WB, Simple Western
Породы: Hu, Mu, Rt
Применения: WB, Flow, ICC / IF, IHC, IHC-P, IP
Виды: Hu
Приложения: WB, ELISA, Flow, ICC / IF, IHC, IHC-P, Flow-IC
Виды: All-NA
Приложения: WB, Simple Western, ELISA, ICC / IF, IHC, IHC-P, IP
Часто задаваемые вопросы по IFN-альфа (11200-1) (0)
Другие доступные форматы
Дополнительные продукты IFN-альфа
Инструмент биоинформатики для IFN-альфа (11200-1)
Откройте для себя пути, заболевания и гены, связанные с IFN-альфа (11200-1).Нужна помощь? Прочтите Руководство по использованию инструмента биоинформатики для получения инструкций по использованию этого инструмента.Блоги по IFN-альфа.
Обзор Интерферона-CUSABIO
Интерфероны названы из-за их способности «мешать» репликации вирусов, защищая клетки от вирусных инфекций. Как важный класс коллекции цитокиновых белков CUSABIO, у нас есть несколько вопросов от исследователей, проводящих соответствующие исследования.Объединив их вопросы и наши исследования, мы пишем эту статью.
1. Что такое интерферон
Интерферон, также известный как IFN, представляет собой разновидность цитокинов, которые играют важную роль в вирусной защите, ингибировании опухолей и лечении заболеваний с помощью цитотоксических Т-клеток, NK-клеток, DC-клеток и т. Д. Интерферон, продуцируемый в основном моноцитами и макрофагами и расположенный в разных точках. поверхность клеток, регулирует рост клеток, дифференцировку клеток, иммуноредактирование.CUSABIO производит различные продукты, связанные с интерфероном, включая белки, антитела и наборы Elisa.
(источник: https://en.wikipedia.org/wiki/Interferon)
2. Классификация интерферона.
Семейство IFN состоит из трех основных классов цитокинов: IFN типа I, IFN типа II и IFN типа III. Среди них IFN типа I и IFN типа II хорошо изучены.
Интерферон I типа
Интерферон I типа включает интерферон α (который можно разделить на 13 различных подтипов (IFN-α1, -α2, -α4, -α5, -α6, -α7, -α8, -α10, -α13, -α14, -α16 , -α17 и -α21), β, ε, к и ω у человека.Все IFN типа I связываются с одним и тем же общим рецептором клеточной поверхности, который известен как рецептор IFN типа I. Рецептор интерферонов типа I имеет многоцепочечную структуру, которая состоит по крайней мере из двух различных субмитов, IFNAR1 и IFNAR2. Множество результатов исследований демонстрируют, что IFN типа I играют ключевую роль в микробной инфекции. Однако каждый член IFN типа I также выполняет свои уникальные биологические функции. Например, хотя и IFN-α, и IFN-β вызываются инфекцией Cl-13, потеря передачи сигналов IFN-β является основным фактором, который инициирует раннее избавление от персистирующей инфекции LCMV путем блокирования IFNAR.на стадии раннего клиренса вируса результат блокирования IFN-β подобен тому, который наблюдается при блокировании IFNAR, несмотря на присутствие высоких уровней IFN-α; Исследование Ng, C.T et al . сообщает, что блокада по крайней мере шести форм IFN-α не может ускорить клиренс вируса [1] . Однако IFN-α был ключом к контролю распространения вируса, поскольку только блокада IFN-α изменяла раннее распространение вируса, показывая, что роли IFN-β по сравнению с IFN-α в борьбе с вирусной инфекцией различны [2] .
Интерферон II типа
Интерферон типа II, включающий только гамма-интерферон, также известный как IFN-γ, является цитокином, который имеет решающее значение для врожденного и адаптивного иммунитета против вирусных, некоторых протозойных и бактериальных инфекций. По сравнению с интерфероном I типа, у белка не существует выраженной структурной гомологии. Рецептор интерферонов типа II также имеет многоцепочечные структуры, состоящие из двух разных субмитов, IFNGR1 и IFNGR2.IFN-γ продуцируется лимфоцитами, активируется специфическими антигенами или митогенами, обладает противовирусной активностью и важными иммунорегуляторными функциями. Это мощный активатор макрофагов и оказывает антипролиферативное действие на трансформированные клетки. IFN-γ является важным медиатором иммунитета и воспаления, который использует сигнальный путь JAK-STAT для активации фактора транскрипции STAT1. Кроме того, новые данные показывают, что он может усиливать противовирусные и противоопухолевые эффекты интерферонов типа I.
Интерферон III типа
Интерферон III типа включает интерферон λ, который можно разделить на 4 различных подтипа: IFNλ1, IFNλ2, IFNλ3 и IFNλ4 у человека. Однако IFNλ1-λ4 являются псевдогенами у мышей, что препятствует исследованию функции этих цитокинов на этой животной модели [3] [4] .
Члены семейства интерферонов представлены в таблице 1.
Таблица 1 Член семейства IFN
| Члены гена | Uniprot ID | Название белка | Рецептор и описание |
|---|---|---|---|
| IFNα1 | P01562 | Интерферон альфа-1 | IFNAR1: рецептор 1 интерферона альфа / бета является компонентом рецептора интерферонов типа I.Его функция в целом как гетеродимер с IFNAR2. Связывание интерферона типа I активирует сигнальный каскад JAK-STAT и запускает фосфорилирование тирозина ряда белков, включая белки JAK, TYK2, STAT и сами альфа- и бета-субъединицы IFNR. Может сам образовывать активный рецептор IFNB1 и активировать сигнальный каскад, который не включает активацию пути JAK-STAT. IFNAR2: рецептор 2 интерферона альфа / бета, связанный с IFNAR1 с образованием рецептора интерферона типа I, является рецептором интерферонов альфа и бета.Он участвует в IFN-опосредованной активации STAT1, STAT2 и STAT3. Изоформа 1 и изоформа 2 непосредственно участвуют в передаче сигнала из-за их ассоциации с киназой TYR, JAK1. Изоформа 3 является мощным ингибитором активности рецептора IFN I типа. |
| IFNα2 | P01563 | Интерферон альфа-2 | |
| IFNα4 | P05014 | Интерферон альфа-4 | |
| IFNα5 | P01569 | Интерферон альфа-5 | |
| IFNα6 | P05013 | Интерферон альфа-6 | |
| IFNα7 | P01567 | Интерферон альфа-7 | |
| IFNα8 | P32881 | Интерферон альфа-8 | |
| IFNα10 | P01566 | Интерферон альфа-10 | |
| IFNα13 | P01562 | Интерфероны альфа-13 | |
| IFNα14 | P01570 | Интерферон альфа-14 | |
| IFNα16 | P05015 | Интерферон альфа-16 | |
| IFNα17 | P01571 | Интерферон альфа-17 | |
| IFNα21 | P01568 | Интерферон альфа-21 | |
| IFNβ | P01574 | Интерферон бета | |
| IFNε | Q86WN2 | Интерферон эпсилон | |
| IFNκ | Q9P0W0 | Интерферон каппа | |
| IFNω | P05000 | Интерферон омега | |
| IFNγ | P01579 | Интерферон гамма | IFNGR1: рецептор 1 гамма-интерферона связывается с IFNGR2 с образованием рецептора для цитокинового гамма-интерферона. IFNGR2: рецептор 2 гамма-интерферона связывается с IFNGR1 с образованием рецептора для цитокинового гамма-интерферона. Связывание лиганда стимулирует активацию сигнального пути JAK / STAT. |
| IFNλ1 | Q8IU54 | Интерферон лямбда-1 | IFNLR1: лямбда-рецептор интерферона 1 также известен как IFNLR1.Димер IFNLR1 / IL10RB является рецептором цитокиновых лигандов IFNL2 и IFNL3 и опосредует их противовирусную активность. IL10RB: субъединица бета рецептора интерлейкина-10 представляет собой общий рецептор клеточной поверхности, необходимый для активации пяти цитокинов класса 2: IL10, IL22, IL26, IL28 и IFNL1. Димер IFNLR1 / IL10RB является рецептором цитокиновых лигандов IFNL2 и IFNL3 и опосредует их противовирусную активность. |
| IFNλ2 | Q8IZJ0 | Интерферон лямбда-2 | |
| IFNλ3 | Q8IZI9 | Интерферон лямбда-3 | |
| IFNλ4 | К9М1У5 | Интерферон лямбда-4 |
3.Путь передачи сигналов интерферона
За последние два десятилетия накопление доказательств раскрыло механизм пути передачи сигналов интерферона. С момента первоначального открытия классического сигнального пути JAK-STAT стало ясно, что соединение и взаимодействие нескольких отдельных сигнальных каскадов необходимы для генерации ответов на интерфероны, включая каскад митоген-активируемой протеинкиназы p38 и фосфатидилинозитол 3. -киназный каскад.В этой части мы сосредоточимся на наиболее фундаментальном классическом сигнальном пути [5] . В зависимости от типа интерферона и соответствующих рецепторов мы вводим соответствующий сигнальный путь, соответственно.
Путь передачи сигналов IFN типа I
Почти все типы клеток, особенно плазматические дендритные клетки (pDC), при распознавании вируса могут продуцировать интерферон I типа. Рецепторы интерферона I типа состоят из IFNAR1 и IFNAR2.Они стимулируют путь JAK-STAT, что приводит к экспрессии IFN-стимулированных генов (ISG), которые связаны с противовирусной защитой хозяина. Важным транскрипционным комплексом, индуцируемым IFN типа I, является комплекс фактора 3 ISG (ISGF3). Зрелый комплекс ISGF3 состоит из фосфорилированных STAT1 и STAT2 и соединен с IRF9, который не подвергается фосфорилированию тирозина. Этот комплекс является единственным комплексом, который связывает определенные элементы (известные как IFN-стимулированные ответные элементы (ISRE)), которые присутствуют в промоторах определенных ISG, а затем инициируют их транскрипцию.В целом, IFNα можно использовать для лечения инфекций гепатита B и C, а IFNβ можно использовать для лечения рассеянного склероза. Рецепторы интерферона III типа отличаются от первого, но имеют общий сигнальный путь. Интерферон типа III играет решающую роль в противовирусной защите хозяина, преимущественно в эпителиальных тканях.
Рисунок 1 Путь передачи сигналов IFN типа I
Сигнальный путь IFN типа II
Интерферон типа II (интерферон гамма) продуцируется путем активации Т-клеток, естественных клеток-киллеров и макрофагов et al .на стимулы цитокинов, таких как интерлейкин 12. Рецепторы интерферона типа II состоят из IFNGR1 и IFNGR2. Транскрипция IFN-зависимых генов типа II (IFN-γ) регулируется элементами GAS, и STAT1 является наиболее важным IFN-γ-активированным фактором транскрипции для регуляции этих транскрипционных ответов. После связывания с рецептором IFN типа II с помощью IFNγ, JAK1 и JAK2 активируются и затем фосфорилируют STAT1 по остатку тирозина. Затем фосфорилированный STAT1 соединяется с другим и образует гомодимеры STAT1-STAT1, которые перемещаются в ядро и связываются с элементами GAS, чтобы инициировать транскрипцию.По сравнению с IFN типа I, IFNγ не индуцирует образование комплексов ISGF3 и, таким образом, не может индуцировать транскрипцию генов, которые имеют только ISRE в своем промоторе. Помимо противовирусной активности, интерферон типа II выполняет важные иммунорегуляторные функции, поскольку он является мощным активатором макрофагов и Т-хелперных клеток 1, в то же время он обладает антипролиферативным, противовирусным и противоопухолевым действием.
Рисунок 2 Путь передачи сигналов IFN типа II
4.Интерферон и болезни
Интерферон настолько важен, что он связан со многими заболеваниями, и его применение следует особо отметить.
Интерферон гамма и опухоль
Фазы иммуноредактирования опухоли — это элиминация опухоли, покой опухоли и выход опухоли. IFNγ принимает участие во всех фазах распространения информации. IFNγ способствует индукции апоптоза или рецидива и прогрессирования опухоли.
IFNγ может прямо или косвенно вызывать апоптоз и неапоптоз. IFNγ может активировать экспрессию IRF1, супрессора опухоли, в свою очередь, он активирует экспрессию Bak и снижает экспрессию BCL2. Эти материалы стимулируют цитохром с и активируют каспазу, что приводит к апоптозу опухолевых клеток. IFNγ имитирует количество химических веществ, таких как ROS и RNI, склонных к апоптозу. IFNγ также может вызывать аутофагию в клетках человека. IFNγ может усиливать p53-опосредованный апоптоз и TRAIL или FAS-опосредованный апоптоз посредством пути передачи сигналов STAT.
IFNγ может вызывать состояние покоя, приводящее к остановке роста рака, прямо или косвенно в зависимости от сигнального пути STAT. Выявлено, что некоторые гены рака молочной железы, такие как HER2, у некоторых пациентов длительное время бездействуют.
IFNγ способствует прогрессированию и рецидиву опухоли из-за его воспалительных свойств. Меланомы связаны с макрофагами, которые продуцируют IFNγ. В свою очередь, ингибирование IFNγ воздействием ультрафиолета может устранить меланомы.Высокая концентрация IFNγ может привести к НАЖБП с последующим НАСГ и ГЦК [6] .
Интерферон альфа и ВИЧ
Семейство IFNα состоит из 13 членов, расположенных на хромосоме 9 человека. Различные подтипы имеют большое сходство в идентичности длины последовательности, поскольку имеют одного и того же предка. В то время как сродство к их рецептору, уровень экспрессии и нижестоящий сигнальный каскад отличаются от каждого подтипа в разном микроокружении.Широко признано, что IFN обладает противовирусной функцией. Когда он индуцируется вирусом, активируется сигнальный путь JAK-STAT, активируются ISG (стимулированные IFN гены), чтобы противостоять вирусу. Однако некоторые вирусы могут уклоняться от иммунорегуляции IFN, и механизм не очень ясен, поэтому важно тщательно изучить его для лечения.
До сих пор все отчеты о ВИЧ или SIV-инфекции показали разные результаты в экспрессии гена подтипа IFNα, которая сильно зависела от анализируемого типа ткани, клетки или стимула.Различные подтипы IFNα вызывают разные паттерны экспрессии ISG. Некоторые подтипы IFNα (IFNα1, IFNα2, IFNα6, IFNα14, IFNα17 и IFNα21) сильно усиливали экспрессию мРНК факторов рестрикции ВИЧ (Mx2, SAMHD1, Tetherin и Trim22), тогда как все другие подтипы IFNα лишь незначительно увеличивали экспрессию ISG по сравнению с необработанными контролями. in vitro. Они наблюдали, что некоторые подтипы IFNα (IFNα14, IFNα6, IFNα17 и IFNα21) сильно снижали репликацию вируса, о чем свидетельствуют клеточные уровни p24 и инфекционность супернатантов клеточных культур.Интересно, что клинически используемый подтип IFNα2 (для терапии HBV) лишь незначительно подавлял репликацию ВИЧ in vivo. Более того, структурные улучшения IFN могут стать важным вариантом для будущих схем иммунотерапии вирусных инфекций. Хорошо известно, что интерферон I типа эффективно индуцирует противовирусные факторы рестрикции. Накапливающиеся данные свидетельствуют о том, что другие типы IFN, специфические цитокины и другие активаторы клетки также способны повышать экспрессию факторов рестрикции и, следовательно, устанавливать противовирусное состояние клетки [7] .
Было показано, что типичный ответ на терапию IFNα для пациентов, инфицированных HCV, характеризуется двумя фазами вирусной нагрузки: быстрым снижением за счет экспрессии антивирусного ISG и более медленным снижением, опосредованным иммунными клетками. Таким образом, иммунорегуляторная активность IFN может потребоваться для успешного лечения хронической вирусной инфекции. Однако интерферон I типа, индуцирующий активацию иммунной системы, может быть как полезным, так и вредным при ВИЧ-инфекции, поскольку IFNγ, а не IFNα, опосредует стойкое заболевание LCVM [2] .
Интерферон гамма и туберкулез
Туберкулез — серьезное инфекционное заболевание в нашем мире. Защита зависит от клеточного иммунного ответа, опосредованного Т-клетками. IFNγ продуцируется Т-клетками, NK-клетками и макрофагами с антипролиферацией трансформированных клеток, противоопухолевым и потенцирующим противовирусные эффекты интерферона I типа. Мы выяснили, что мыши с дефицитом gko не могут продуцировать IFNγ и хорошо выживают без патогена.После заражения туберкулезом мыши с дефицитом gko живут всего 15 ± 1 день и имеют от 10 × до 100 × вируса по сравнению с контролем. У мышей с нокаутом gko наблюдается некроз селезенки, печени и легких. После инъекции экзогенного IFNγ можно усилить защиту и продлить свое выживание без полного выздоровления. Доказано, что активация макрофагов IFNγ решает туберкулез. Ранее они сообщали, что NO и связанный с ним ген RNI ответственны за разрушение вирулентных туберкулезных микобактерий мышиными макрофагами, ответ, который требует лечения in vitro как IFNγ, так и TNFα.Таким образом, производство RNI, по крайней мере, на мышиной модели, может быть необходимым механизмом для борьбы с инфекцией туберкулеза. Более того, результаты модели gko могут иметь отношение к туберкулезу при СПИДе [8] .
Гамма IFN и толерантность
IFNγ является одним из наиболее важных провоспалительных факторов, поскольку он может индуцировать выработку Th2, который инициирует и поддерживает воспалительный процесс в пораженных органах.На сегодняшний день имеется множество сообщений, которые связывают IFNγ с индукцией иммунной толерантности как in vitro, так и in vivo. Похоже, что эти эффекты, провоспалительные или толерогенные, в значительной степени зависят от конкретных иммунологических условий и сроков иммунного ответа. Дендритные клетки (ДК) осуществляют отбор образцов атигена и доставку сообщений к отвечающим Т-клеткам первоначально. IFNγ может продуцироваться DC, а IFNγ может вызывать активацию DC и толерантность в некоторых сценариях. Обработка DC высокими дозами IFNγ индуцирует экспрессию IDO, которая обладает иммунорепрессивной функцией, ведущей к ингибированию эффекторных Т-клеток, и показано, что ее долгосрочное поддержание поддерживается путем кинуренин-арилуглеводородного (AhR) пути.IFNγ кажется парадоксальным, но IFNγ иногда усугубляет тяжесть аутоиммунного заболевания и ослабляет его у других [9] .
Интерферон и факторы ограничения антиретровирусной терапии
Факторы антивирусной рестрикции являются авангардом линии защиты, но они конститутивно слабо экспрессируются во многих типах клеток, которые должны усиливаться при контакте с патогенами. IFN и некоторые интерлейкины выполняют эту работу и устанавливают антивирусное состояние.Определение ограничивающих факторов нечеткое, поскольку оно разнообразно с твердой функцией. Факторы ограничения, такие как SERINC3 и SERINC5, обладают противовирусной функцией без общего воспаления и побочных эффектов. Факторы рестрикции, такие как PRR и TLR, являются рецепторами, ограничивающими распознавание паттерна патогена. Высокие уровни IFN временно подавляют репликацию вируса во время хронической фазы ВИЧ-1-инфекции, и индукция факторов рестрикции способствует этому эффекту [4] .
Интерферон и рассеянный склероз
Рассеянный склероз (РС) — это хроническое заболевание с нарушением регуляции центральной нервной системы.IFNβ является первым одобренным и до сих пор наиболее широко используемым для лечения рассеянного склероза. При производстве в больших количествах, как это обычно наблюдается при острых вирусных инфекциях, IFNβ активирует противовоспалительные цитокины и подавляет провоспалительные. IFNα имеет аналогичные эффекты IFNβ. Напротив, IFNγ имеет противоположные эффекты: он дополнительно индуцирует иммунный ответ Th2, приводящий к развитию и рецидиву MS [10] .
Интерферон и преждевременные роды
У детей до 5 лет беременность вызывает множество серьезных проблем со здоровьем из-за инфекции и воспаления.Воспаление опосредовано дополнительным интерлейкином, фактором некроза опухоли и IFNγ, вероятно, вызовет повреждение мембраны плода, сокращение матки и биохимические и структурные изменения шейки матки. Более того, у новорожденных слабая и поврежденная врожденная и адаптивная иммунная система с меньшим количеством IgG [11] .
В то время как введение IFNβ на ранних сроках беременности кажется фармакологически безопасным, и накопление реальных данных свидетельствует о том, что терапия IFNβ не связана с серьезными проблемами при беременности.Принимая во внимание эти вопросы, терапия IFNβ может быть продолжена у женщин с высоким риском активности заболевания при попытке забеременеть. Кроме того, IFNβ не всасывается через желудочно-кишечный тракт, и имеющиеся данные свидетельствуют о том, что уровни IFNβ в молоке, достижимые при обычных дозах, очень низкие, поэтому введение IFNβ кажется безопасным для ребенка [12] [13] [14] .
Интерферон и гепатит С
Хронический гепатит, вызванный инфицированием вирусом гепатита С (ВГС), также известный как хронический гепатит С (ХГС), передается парентерально и в основном при переливании небезопасной крови, использовании инъекционных препаратов и терапевтических инъекций.У людей единственным естественным хозяином для ВГС являются гепатоциты, где вирус инфицирует и реплицируется [15] .
IFN типа 1 включают интерферон α, β, ε, к и ω человека. Все IFN типа I обладают противовирусным, антипролиферативным и иммуномодулирующим действием, но их относительная эффективность не отличается. Большинство форм ИФН типа I обладают активностью против ВГС, но лишь немногие из них прошли клиническую оценку [16]. В настоящее время коммерчески доступные формы IFNα, используемые для лечения гепатита C (α2a, α2b и консенсусный IFN), обладают несколько иной эффективностью in vitro, но, по-видимому, дают аналогичные показатели ответа у леченных пациентов.IFN типа 1 могут иметь схожую клиническую активность, потому что они имеют одни и те же, по крайней мере частично, рецепторы на поверхности клетки и внутриклеточные пути действия. Как решающий медиатор врожденного противовирусного иммунного ответа, интерферон альфа (IFNα) был естественным выбором для лечения [17] .
5. Последние исследования Интерферона.
В этой части мы перечисляем некоторые последние исследования интерферона.
# 1 Исследование Элицы С.Тел и др. . предположили, что необходимый переход к анализу QFT-Plus будет связан с минимальной разницей в характеристиках анализа, сравнив тесты QuantiFERON-TB Gold Plus и QuantiFERON-TB Gold In-Tube с элиазой интерферона-γ у пациентов с риском туберкулеза. и у медицинских работников. Щелкните здесь, чтобы получить статью.
№ 2 Ли Ф и др. . продемонстрировали, что мыши, дефицитные по гену лигазы E3 Hectd3, значительно повышают защиту хозяина от инфекции внутриклеточными бактериями F.novicida, Mycobacterium и Listeria, ограничивая распространение бактерий. В отсутствие HECTD3 IFN-ответ типа I нарушался во время бактериальной инфекции как in vivo, так и in vitro. Эти результаты показали, что HECTD3 опосредует полиубиквитинирование TRAF3 и индукцию интерферона I типа во время бактериальной инфекции. Щелкните здесь, чтобы получить статью.
# 3 Pulmonary, исследователь из отделения интенсивной терапии и медицины сна медицинского факультета Университета штата Нью-Йорк, обнаружил, что макрофаги могут быть эффективно иммуностимулированы с помощью аэрозольной терапии путем перепрофилирования IFN γ в виде вдыхаемого аэрозоля и его попадания непосредственно в легкие. лечить множество заболеваний, вызванных нарушением регуляции иммунитета.Щелкните здесь, чтобы получить статью.
использованная литература
[1] Нг, К.Т., Салливан, Б.М., и др. . Блокировка интерферона бета, но не интерферона альфа, сигнализирует о стойкой вирусной инфекции [J]. Cell Host Microbe, 2015, 17, 653-661.
[2] Чери Т. Нг, 1 Хуан Л. Мендоса, и др. . Передача сигналов интерферона альфа и бета типа 1: прохождение для различных биологических результатов [J].Клетка. 2016, 164, 349-352.
[3] Nan Y, Wu C, et al. . Интерферон-независимая неканоническая активация STAT и вирус-индуцированное воспаление [J]. Вирусы, 2018 (4): апр.
[4] Катрин С., Джулия Д., и др. . Подтипы интерферона α при ВИЧ-инфекции [J]. Cytokines Growth Factor Rev, 2018 Февраль.
[5] Леонид К. Платаниас. Механизмы передачи сигналов, опосредованной интерфероном I и II типа [J].Нат Рев Иммунол, 2005 5 (5): 375-86.
[6] Aqbi HF, Wallace M, и др. . IFN-γ управляет элиминацией опухоли, покоем опухоли, ускользанием опухоли и прогрессированием [J]. J Leukoc Biol, 2018 фев.
[7] Хоттер Д., Кирхгоф Ф. Интерфероны и не только: индукция антиретровирусных факторов ограничения [J]. Журнал J Leukoc Biol, 2018 (3): 465-477.
[8] Флинн Дж. Л., Чан Дж., и др. . Существенная роль интерферона γ в устойчивости к инфекции Mycobacterium tuberculosis [J].J Exp Med, 1993 (6): 2249-2254.
[9] Розман П., Свайгер У. Толерогенная роль IFN-γ [J]. Cytokines Growth Factor Rev, 2018 апр.
[10] Думитреску Л., Константинеску К.С., и др. . Последние разработки в области терапии рассеянного склероза на основе интерферона [J]. Эксперт Opin Biol Ther, 2018 апр.
[11] Helmo FR, Alves EAR, и др. . Внутриутробная инфекция, иммунная система и преждевременные роды [J].J Matern Fetal Neonatal Med, 2018 (9): 1227-1233.
[12] Амато М.П., Портаччо Э. Фертильность, беременность и роды у пациентов с рассеянным склерозом: влияние лекарств, модифицирующих болезнь [J]. Препараты ЦНС, 2015 (3): 207-220.

 ФНС вправе посчитать такое учреждение недействующим и исключить из реестра.
ФНС вправе посчитать такое учреждение недействующим и исключить из реестра.





 комиссия (публикуются объявления ВГР).
комиссия (публикуются объявления ВГР). Обратите внимание, что этот человек будет представлять фирму в суде, а также нести полную ответственность за долги перед ИФНС и кредиторами (ст. 62 ГК РФ).
Обратите внимание, что этот человек будет представлять фирму в суде, а также нести полную ответственность за долги перед ИФНС и кредиторами (ст. 62 ГК РФ).



 Не забудьте утвердить документ на общем собрании участников или единолично.
Не забудьте утвердить документ на общем собрании участников или единолично.