Есть ли у ИП КПП?
Нередко в реквизитах компаний встречается код признака подчиненности или сокращенно – КПП. Опытный бухгалтер всегда сможет определить значение этого кода по ИНН фирмы. А есть ли КПП у ИП (индивидуальных предпринимателей)? Ответ на вопрос – далее.
Что такое КПП в реквизитах у ИП?
Обязательный КПП присваивается при регистрации налогоплательщика в ИФНС одновременно с ИНН и ОГРН. Проще говоря, этот код поясняет, по какой причине организация встала на учет. Поскольку корректное отражение реквизитов важно не только при заполнении отчетности, но и при уплате налогов, а также в иных случаях, многих предпринимателей интересует вопрос: КПП у ИП есть или нет? И если да, то как узнать свой КПП для ИП?
Порядок присвоения ИНН и КПП регулируется ФНС в приказе № ММВ-7-6/435 от 29.06.12 г. Здесь, в разд. III, определено кому и когда присваиваются коды. Так должно ли быть у ИП КПП, или все-таки нет? В соответствии с п. 7 Приказа, КПП присваивается ИФНС только юрлицам во время процедуры по постановке на налоговый учет.
Предприниматели в указанном нормативном документе не поименованы. Следовательно, ответ на вопрос «Есть ли у ИП КПП?» — отрицательный. Не ищите этот реквизит в регистрационных документах – его там нет.
Почему у ИП нет КПП?
Образно говоря, у предпринимателей не может быть КПП потому, что для них предусмотрена особая правовая форма регистрации бизнеса. Постановка на учет ИП выполняется контрольными налоговыми органами по месту прописки физлица. При этом заниматься коммерцией человек может по всей территории страны без дополнительной регистрации.
Иное дело – юрлица. Они обязаны регистрироваться по юридическому адресу, а также по месту открытия всех своих ОП (обособленные подразделения), если филиалы располагаются в местностях, подведомственных разным ИФНС. Соответственно, у ИП не бывает КПП, а у юридического лица их может быть несколько.
Нужен ли КПП для ИП?
Так как у предпринимателей нет КПП, этот код им не нужен. Если приходится заполнять документы с графами для КПП, необходимо проставить в них прочерки или «0». В банковских платежках обычно ставят «000000000».
Если приходится заполнять документы с графами для КПП, необходимо проставить в них прочерки или «0». В банковских платежках обычно ставят «000000000».
Исходя из сказанного, можно сделать вывод, что предпринимателям нет нужды беспокоиться, какой КПП у ИП, и где найти КПП индивидуального предпринимателя. Официальные разъяснения Минфина в письме № 03-02-08/14 от 28.02.13 г. помогут бизнесменам обосновать свою позицию по этому вопросу при возникновении споров с заинтересованными лицами.
Есть ли КПП у ИП (индивидуального предпринимателя)?
На практике нередки ситуации, когда контрагенты присылают документы для заполнения, где требуется указать реквизиты предпринимателя, при этом есть там и такой раздел как КПП, т.е. код причины постановки на учет. У многих предпринимателей, данная графа вызывает определенные затруднения, т.к. нигде в своих документах они не могут найти данный реквизит.
Что такое КПП и для чего оно необходимо?
Как было уже сказано, данная аббревиатура обозначает код причины постановки на учет в налоговом органе. По своей структуре он состоит из девяти цифр, обозначающих категорию налогоплательщика, налоговый орган, причину постановки.
По своей структуре он состоит из девяти цифр, обозначающих категорию налогоплательщика, налоговый орган, причину постановки.
Данный код присваивается только юридическим лицам, при их регистрации, поэтому КПП у ИП быть не может.
Значение данный реквизит имеет только при заполнении отдельных платежных или отчетных документов, а также при заполнении иных бланков. И если у юр.лиц сложностей не возникает, то некоторые предприниматели попадают в затруднительное положение. Дело в том, довольно часто контрагенты требуют обязательного указания КПП, при этом далеко не все осознают, что КПП у ИП не может быть в принципе, т.к. он не предусмотрен для индивидуальных предпринимателей.
Что делать если КПП требуется указать?
Сразу отметим, что в официальных документах, например, в отчетах в ФНС, внебюджетные фонды в данной графе проставляется прочерк и никаких вопросов не возникает. Также нет трудностей при заполнении платежных поручений и прочих банковских документов. А вот иные документы, которые направляют друг другу контрагенты, иногда становятся причинами разногласий.
А вот иные документы, которые направляют друг другу контрагенты, иногда становятся причинами разногласий.
В такой ситуации можно только порекомендовать своим деловым партнерам изучать Налоговый кодекс РФ и порядок регистрации юридических лиц и индивидуальных предпринимателей. Если же переубедить не получается, то некоторые предприниматели советуют прибегнуть к небольшой хитрости – составить КПП самостоятельно. Для этого необходимо указать код региона, код налоговой инспекции по месту регистрации, а также код, применяемый в отношении юридических лиц при постановке на налоговый учет – 01001. Но следует помнить, что это исключительно для случаев особой «упертости» контрагентов, в официальных документах указывать его нельзя!
КПП индивидуального предпринимателя не может быть в силу особенностей регистрации данной организационно-правовой формы. А требование о его указании ИП основано на незнании требований законодательства и не может быть исполнено предпринимателем. Поэтому указывать его ИП не требуется, в том числе и при заключении любых видов договоров.
ipinform.ru
есть или нет, КПП у индивидуальных предпринимателей
Заполняя деловые бумаги, предприниматель через раз сталкивается с такой графой, как КПП. По обычаю, бизнесмены ищут необходимые реквизиты в официальных документах, выданных при регистрации. Но такого там нет, и это вызывает недоумение. На самом деле все просто. Узнать, есть ли КПП у ИП, можно в соответствующем Приказе ФНС № ММВ-7-6/435, где черным по белому написано, кому, как и когда присваивается этот код.
Что такое КПП
КПП — это сгенерированный налоговой службой шифр, поясняющий причину, из-за которой налогоплательщик числится в базе. Другими словами, это код причины постановки на учет, который выдают юридическим лицам, прошедшим регистрацию, как дополнение к ИНН и ОГРН.
Эти реквизиты юридическое лицо может взять из свидетельства о постановке на учет в налоговой.Они очень важны для организаций. Их указывают в декларациях по налогам, бухгалтерских отчетах, платежных формах, при заполнении документов для регистрации недвижимости, филиалов и других материальных объектов, при заключении сделок с контрагентами. Кроме этих данных, учреждения обязательно указывают ОКПО.
КПП состоит из 9 цифр, сгруппированных в четыре блока:
| Порядковый номер цифры | Значение |
|---|---|
| 1 и 2 | Код региона |
| 3 и 4 | Код налогового органа |
| 5 и 6 | Сама причина взятия на учет |
| 7, 8 и 9 | Присвоенный порядковый номер |
К примеру, шифр 770701001 расшифровывается так:
- 77 — г. Москва;
- 07 — номер налогового органа, который взял учреждение под контроль;
- 01 — налогоплательщик состоит на учете по месту деятельности;
- 001 — порядковый номер в ИФНС.
Присваивают ли КПП предпринимателю
У ИП нет КПП и не может быть, поскольку специфика регистрации предпринимательской деятельности в корне отличается от порядка регистрации организаций. У бизнесмена есть ровно одна причина, по которой его должны поставить на учет, а регистрация деятельности осуществляется только по месту прописки. Даже если открыть 10 разных фирм, все 10 будут числиться в одной ИФНС — по месту проживания.
У бизнесмена есть ровно одна причина, по которой его должны поставить на учет, а регистрация деятельности осуществляется только по месту прописки. Даже если открыть 10 разных фирм, все 10 будут числиться в одной ИФНС — по месту проживания.
Можно сделать вывод, что предпринимателю не присваивают КПП, поскольку в этом нет ни нужды, ни пользы. В случае необходимости бизнесмен может узнать собственный ИНН, которого хватит, чтобы провести любые операции в ходе работы. Посмотреть ИНН можно в свидетельстве или в сервисе ФНС.
Бланки заявлений, декларации и другие документы содержат графу с КПП, так как рассчитаны и на предпринимателей, и на юридические лица. Но заполнять ее должны только организации, предпринимателю следует поставить прочерк.
Какие реквизиты нужны ИП
Обязательными реквизитами для бизнесмена являются:
- ИНН — идентификационный номер налогоплательщика;
- ОГРНИП — основной государственный регистрационный номер;
- ОКАТО — индекс местонахождения;
- ОКПО — российский классификатор предприятий;
- Общие сведения о себе как о физлице.

Иногда бывает, что в банке индивидуального предпринимателя просят указать КПП, чтобы графа не оставалась незаполненной. Не нужно ничего выдумывать, просто поставьте прочерк. Также нужно делать и в договорах для контрагентов.
По Приказу № 148н от 23.09.2015, который действует с 2016 года, проставление нулевых обозначений в документах не допускается. Поэтому ни в коем случае не ставьте ноль. Единственный правильный знак, из-за которого у вас точно не будет проблем, —это прочерк.
Как доказать отсутствие КПП у предпринимателя
Если в банках, инспекциях и других учреждениях никаких вопросов к ИП, указавшему в поле с кодом прочерк, не возникнет, то с контрагентами все немного сложнее. Особенно если это юридические лица, которые часто требуют, чтобы индивидуальный предприниматель все-таки написал КПП.
Причина такого упрямства — обыкновенная правовая безграмотность. Если ИП столкнулся со схожей ситуацией, ему следует ознакомить партнера с одним из нормативных актов:
- ФЗ №129, освещающий порядок регистрации ИП.
 В этом правовом акте черным по белому написано, что КПП имеется только в ЕГРЮЛ. А раз в ЕГРИП его нет, то и у предпринимателя быть не может.
В этом правовом акте черным по белому написано, что КПП имеется только в ЕГРЮЛ. А раз в ЕГРИП его нет, то и у предпринимателя быть не может. - Приказ ФНС №ММВ-7-6/435, в котором отражена вся информация о КПП, и указано, что индивидуальные предприниматели его не получают.
- Письмо Минфина №03-02-08/14, в котором дан однозначный ответ на вопрос, выдается ли код причины постановки ИП. Если партнер продолжит упрямиться, предложите ему посмотреть ссылки на нормы законодательства, приведенные в документе к каждому аргументу.
Код все равно требуют: что делать
Чтобы угодить своему деловому партнеру и вписать злополучный код в договор, некоторые бизнесмены идут на хитрость и формируют его самостоятельно. Для этого нужно указать следующий набор цифр в таком же порядке:
- Код региона, в котором вы зарегистрированы;
- Вашей ИФНС;
- И комбинацию 01001, которую обычно присваивают организациям.
Если вы стоите на учете в Москве, то ваш код примет вид 77ХХ01001, где ХХ — это номер ИФНС.
Нужно учитывать, что ИП рискует, составляя собственный КПП индивидуального предпринимателя, поскольку может получить штраф за предоставление недостоверных сведений. Так указано в статье 14.25 ФЗ от 2001. Если вы не хотите иметь проблем с законом, указывайте в отведенном для кода месте прочерки.
К тому же, самостоятельно сгенерированный шифр является недействительным, и, если вписать его в официальный документ, тот также утратит юридическую силу. Прибегнуть к такой хитрости можно только ради удовлетворения требований партнера.
КПП для ИП не предусмотрен законодательством, и требовать его никто не вправе. А вот сам предприниматель может проверить юрлицо, запросив информацию о причине постановки на учет и обезопасив предстоящую сделку.
Код причины постановки на учет: что об этом должен знать ИП
Предприниматели, признайтесь: не каждый из вас в курсе, что, помимо ИНН, налоговики присваивают КПП — код причины постановки на учет. Разбираем тайные шифры налоговой службы. Бонусом — важная информация для ИП.
Разбираем тайные шифры налоговой службы. Бонусом — важная информация для ИП.
Начнем с матчасти: что такое КПП? Код причины постановки на учет (КПП) дополнительно присваивается к ИНН. Его налоговая служба придумала для того, чтобы проверять и идентифицировать налогоплательщиков.
С одним ИНН бизнесу иногда приходится регистрироваться в разных территориальных подразделениях ФНС (например, по юридическому адресу и по фактическому месту положения своих объектов недвижимости). Именно КПП позволяет налоговикам объединить в базе все данные об одном ИНН: сколько раз налогоплательщик вставал на учет, в каких именно территориальных подразделениях «засветился».
КПП состоит из 9 цифр, расшифровать которые могут только инспекторы ФНС. Для этого у них есть специальный справочник. Первые несколько цифр — данные органа, который поставил налогоплательщика на учет. Также в код «вшиваются» информация о гражданстве налогоплательщика, причины постановки на налоговый учет и основание присвоения КПП.
Юридические лица прекрасно знают о необходимости использования КПП. Это обязательный реквизит для бухгалтерской отчетности, платежных поручений, участия в госзакупках и даже заключения контрактов.
А нужен ли КПП индивидуальным предпринимателям? Ответ прост. Не нужен. Точнее, у ИП такого кода просто нет, так как свою деятельность они регистрируют исключительно по месту жительства (месту регистрации). И платят налоги через то территориальное подразделение УФНС, в котором и свершился факт регистрации.
Отсутствие КПП останавливает многих ИП от участия в госзакупках. Напрасно. Закон позволяет индивидуальным предпринимателям заявляться на торги. Для этого достаточно предоставить заверенные у нотариуса документы, подтверждающие регистрацию, бухгалтерский отчет, список сотрудников (если они есть) и выписку о наличии банковского счета.
Иногда и некоторые потенциальные контрагенты отказываются сотрудничать с ИП, ссылаясь на отсутствие кода причины постановки на учет. В этом случае вам можно аргументированно убедить партнеров со ссылкой на российское законодательство.
В этом случае вам можно аргументированно убедить партнеров со ссылкой на российское законодательство.
Так, факт отсутствия необходимости КПП у ИП гарантирует ФЗ-129 «О государственной регистрации юридических лиц и индивидуальных предпринимателей». Порядок присвоения ИНН также не содержит требования о присвоении КПП индивидуальным предпринимателям. Поможет вам и письмо Минфина № 03-02-08/14 за 2013 год, в котором черным по белому написано: физлицам КПП не присваивается, только ИНН.
У ИП есть КПП или нет
Предпринимателям, делающим первые шаги в бизнесе, приходится сталкиваться с десятками новых наименований и непонятных сокращений. Почти все они исключительно важны для отчётности перед государством или для грамотной организации отношений с контрагентами. Один из них — КПП или код причины постановки на учёт. Рассказываем: у ИП есть КПП или нет?
Что такое КПП
Начнём с того, что такое КПП у ИП и где его посмотреть. Людям, не знающим деталей налогового дела, это значение может показаться случайным набором цифр. Это не так. В действительности оно расшифровывается и раскрывает много информации об обладателе.
Это не так. В действительности оно расшифровывается и раскрывает много информации об обладателе.
Аббревиатура расшифровывается как «код причины постановки на учёт». Его используют в бухгалтерской и налоговой документации. С его помощью налоговики узнают много полезной информации: от места расположения до особенностей организации, вставшей на учёт. Например, российская она или иностранная, владеет ли недвижимостью, транспортом и другим имуществом.
Стоит ли заморачиваться с тем, чтобы запоминать свой или чужой код? Знать свой код необходимо, потому что он требуется для заполнения налоговых деклараций и других отчётных документов. Также этот реквизит может попросить контрагент, чтобы указать это значение в платёжных документах. Код обязательно запрашивают при участии в конкурсах и аукционах на государственных закупках.
КПП – один из обязательных реквизитов организаций
Как составляется код
Код включает несколько комбинаций чисел, у каждой есть отдельное значение. Зная, из чего он составлен, можно расшифровать его и получить ценную информацию об обладателе:
Зная, из чего он составлен, можно расшифровать его и получить ценную информацию об обладателе:
- Четыре цифры в начале — данные о территориальном отделении, где налогоплательщик зарегистрировался и куда сдаёт налоговую отчётность.
- Пятая и шестая цифры — непосредственно номер КПП, причина учёта. Используется классификация по единому справочнику СППУНО. Для отечественных налогоплательщиков это значения от 01 до 50, для иностранных организаций — от 51 до 99.
- Седьмая, восьмая и девятая цифры — порядковый номер регистрации по указанному основанию. Например, когда организация регистрируется впервые, ей присвоят код «001».
Таким образом, реквизит связан с регионом регистрации организации. Очевидно, что он может быть одинаковым у нескольких налогоплательщиков из одного региона. Если организация меняет место работы (область, край, республику), ей предстоит поменять КПП. У филиалов ООО в разных субъектах федерации будут разные коды.
Кому присваивают КПП
КПП — это характеристика юридических лиц. Налоговая служба присваивает его только организациям или обществам с ограниченной ответственностью.
Налоговая служба присваивает его только организациям или обществам с ограниченной ответственностью.
В следующем разделе рассмотрим, есть ли КПП у ИП индивидуального предпринимателя.
Есть ли КПП у предпринимателя
Может ли быть КПП у ИП? У частных бизнесменов нет КПП, такой номер им не присваивается. Это значение только для организаций в форме ООО.
Что делать, когда требуется указание КПП
Как узнать свой КПП для ИП? У индивидуальных предпринимателей его нет, следовательно, если ваш контрагент по незнанию спрашивает этот реквизит, укажите ему на это обстоятельство.
Чтобы узнать КПП юридического лица, можно воспользоваться сервисом «Проверь контрагента» на портале налоговой службы и скачать выписку из ЕГРЮЛ.
Где взять КПП для ИП? Иногда деловые партнёры бывают неумолимы и против всякой логики требуют у предпринимателя этот реквизит. Если не получилось объяснить, что у вас его нет, можно воспользоваться хитростью и «сочинить» код самостоятельно:
- указать номер отделения ФНС, в котором получили свидетельство ИП;
- из справочника выбрать подходящее основание;
- указать «001» как самый распространённый вариант.

Некоторые предприниматели используют такой метод, но это не обязательно и не совсем честно с позиции делопроизводства.
Необходимые реквизиты для ИП
Для всех операций и сделок, которые проводят индивидуальные предприниматели, достаточно ИНН и реквизитов банковского счета.
Заключение
Мы разобрали, нужен ли КПП для ИП и для чего используется эта характеристика. Налоговой она нужна больше, чем предпринимателям. Не является случайным набором чисел, каждая комбинация скрывает определенные сведения о месте регистрации и других особенностях налогоплательщика. Данный реквизит у нескольких организаций в одном регионе может совпадать. Запомните, что у частных бизнесменов нет кода причины постановки на учёт, это значение используют только общества с ограниченной ответственностью.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
КПП у ИП есть или нет? Что такое код причины постановки на учет и зачем он нужен :: BusinessMan.ru
Такова реальность, что деятельность отечественных индивидуальных предпринимателей связана и с заполнением большого числа самых разнообразных бумаг. Особенно здесь выделяется налоговая отчетность. Некоторые разделы в бланках документов вызывают вопросы не только у начинающих, но и у давно занятых бизнесом предпринимателей. Например, есть или нет КПП у ИП? Давайте сначала разберемся, что это такое.
КПП — это…
Вы увидели в бланке поле, куда нужно вписать свой КПП. Конечно, первым делом открываете свидетельство о регистрации и такой информации там не находите. Где посмотреть КПП у ИП?
Это аббревиатура, обозначающая код причины постановки на учет. Что это значит? Причина, по которой был зарегистрирован в ФНС тот или иной налогоплательщик. Какие-то коды будут шифровать таким образом организации, их подразделения, недвижимое имущество. Отсюда такой шифр — нужное сведение для отчетности, поэтому поле для него имеется во многих бланках.
Что такое код причины постановки на учет? Это комбинация из девяти символов, в которой зашифрована информация о конкретной организации. В отличие, скажем, от ИНН, который хранит данные именно о лице, владельце-налогоплательщике. КПП обязательно должен присваиваться при регистрации юридического лица вместе с тем же ИНН.
Код нужен для большого спектра платежных, юридических и бухгалтерских документов. Кстати, у одной организации может быть несколько таких кодов, если, например, она ведет деятельность и по месту основной регистрации, и в других регионах. Поэтому 9 символов КПП зашифровывают следующую информацию:
- 1-4 — код органа ФНС, куда юридическое лицо зарегистрировано на учет.
- 5-6 — код причины постановки на учет.
- 7-8 — порядковые цифры учета в налоговых территориальных органах.
Когда присваивается КПП?
Отметим: обладателем КПП может стать только юридическое лицо, но никак не физическое. Вот ряд поводов, являющихся основанием для получения такового кода:
- Регистрация нового юридического лица. КПП присваивается вместе с ИНН.
- При изменении юридического адреса фирмы.
- При открытии нового отделения, обособленного подразделения в другом регионе.
- При изменении адреса местоположения обособленного подразделения организации.
- По местоположению транспортных средств или недвижимости, принадлежащих данному юридическому лицу.
- Иные причины, указанные в НК РФ.
Но определяют ли номер КПП у ИП? Ответ тут достаточно прост.
Есть ли КПП у ИП (индивидуального предпринимателя)?
Регистрируя ИП, частное лицо получает только ИНН. КПП у индивидуального предпринимателя нет! Объясняется его отсутствие просто: причина постановки на учет в налоговой у ИП одна. При этом и регистрация всегда проходит по месту прописки. Отсюда и надобность в присвоении КПП отпадает.
Почему в документах ИП есть поле для КПП?
Возникает закономерный вопрос: если такового кода у предпринимателя нет, почему содержится графа «КПП» у ИП в платежном поручении? Дело в том, что многие документы и отчетные бланки стандартны что для юридических лиц, что для индивидуальных предпринимателей. Отчего и тем, и другим выдаются одинаковые формы для заполнения.
Если вам, ИП, попался такой бланк, то вы без сомнений ставьте в поле «КПП» прочерк или нуль (0). Можно и оставить его пустым — узнайте у работника налоговой службы или иной организации, как правильно обозначить отсутствие этого кода. А вот юридическое лицо в данном разделе должно будет обязательно поставить свой код постановки на учет.
Если требуют КПП…
Порой сама бюрократическая машина может дать сбой, ответив на вопрос «Есть или нет КПП у ИП?» утвердительно. Что делать в случае, если какая-либо организация просит предпринимателя указать в документе данный код, которого он не имеет?
Нужно обосновать свое возражение действующими законодательными нормами и официальными разъяснениями по этому поводу представителей ФНС. Исчерпывающим ответом будет отсылка на данное письмо Министерства финансов РФ: документ от 28.02.2013 № 03-02-08/14. Здесь есть полный ответ на вопрос «Есть или нет КПП у ИП?»
Отметим, что даже по отношению к юридическим лицам КПП не является знаковой информацией для идентификации их как налогоплательщиков. Реквизит носит чисто техническую функцию — он нужен ФНС для осуществления учета, отчего имеет статус дополнительного показателя. А вот уже ИНН предпринимателя помогает выполнить идентификацию.
Общие реквизиты
Отметим также, что КПП не относится к общим реквизитам даже для юридических лиц. Для большинства операций полностью идентифицировать ИП поможет указание следующей информации:
- Наименование вашего бренда (если есть).
- Правовая структура ведения бизнес-деятельности.
- Головная структура.
- Информация из вашего свидетельства о регистрации ИП: номер данного документа, дата регистрации, орган ФНС, выдавший бумагу.
- Фактический адрес.
- Контактный телефон.
- Адрес собственного сайта.
- Электронный почтовый ящик.
Стандартным для ИП также считается указание о себе и своей деятельности следующей информации:
- Ф.И.О.
- Банковский счет.
- Расчетный счет.
- Юридический адрес.
- ИНН.
- ОГРНИП.
- ОКПО.
- ОКАТО.
- Контактный номер телефона.
Если бланк подразумевает указание кода личной категории, то в данной графе нужно просто поставить прочерк.
Банковские реквизиты
Для совершения безналичных банковских расчетов в сопутствующих документах ИП достаточно указать следующую информацию:
- Свое официальное название из свидетельства о регистрации.
- Собственный 20-символьный банковский расчетный счет.
- Название банка, где открыт р/с.
- Корреспондентский счет.
- На стандартном бланке также будут графы для написания КПП, ИНН и ОКПО. Индивидуальный предприниматель здесь вписывает только свой ИНН — таких данных достаточно и для осуществления данного безналичного перевода, и для всей функциональной деятельности ИП вообще.
Когда контрагент настойчив…
Если с документами для налоговой службы и банковскими платежными поручениями все ясно, то с контрагентами не так все просто. Партнер может вообще не принимать возражения, что кода подстановки на учет у предпринимателя быть не может. А бывает и так, что обстановка не позволяет разводить споры по поводу «Есть КПП у ИП или нет».
В таком случае бывалые предприниматели предлагают пойти на небольшую хитрость — придумать для контрагента данный код самим! Конечно, такую комбинацию ни в коем случае нельзя вписывать в официальные бумаги. Сгенерировать КПП просто:
- Числовой код вашего региона.
- Шифр отделения налоговой инспекции по вашему месту прописки.
- Код для юридических лиц, применяемый для постановки оных на учет, — 01001.
В итоге получится девять цифр, которые и можно указать для настойчивого, но непросвещенного контрагента.
Главный вывод из всего сказанного: КПП у ИП нет и быть не может по российскому законодательству и Налоговому кодексу РФ. Главной информацией для идентификации индивидуального предпринимателя как налогоплательщика считается ИНН.
Есть ли КПП у ИП? Что такое код причины постановки на учёт и как его узнать | Своё дело
Начиная свой бизнес в России, первым делом предприниматели выясняют, как правильно зарегистрировать свою деятельность, чтобы потом не возникло проблем с налоговой. Разбираемся, какие реквизиты должен иметь любой индивидуальный предприниматель, что такое код причины постановки на учёт (КПП) и как его узнать.
Что такое КПП и где его найти?КПП (код причины постановки на учёт) — это код из 9 цифр, из которого можно узнать причину постановки на учёт в налоговых органах. Вот расшифровка КПП:
- код региона (первые два символа)
- номер инспекции (3-й и 4-й символы)
- причину постановки на учёт (5-й и 6-й символы)
- порядковый номер постановки на учёт по конкретной причине (7-й, 8-й, 9-й символы).
Для межрегиональных инспекций предназначена кодировка 99.
КПП вместе с ИНН указывают в свидетельстве о постановке организации на учёт. Эти два реквизита прописаны рядом, через дробь. А для идентификации налогоплательщика — физического лица применяется только ИНН.
Интересно, что КПП у разных компаний могут быть одинаковыми. Если компании учитываются в одной налоговой инспекции, по одному основанию и с тем же порядковым номером, то их коды совпадают.
Поэтому для идентификации налогоплательщика одного его КПП недостаточно. Надо ориентироваться на ИНН и ОГРН. А КПП имеет только дополнительную функцию.
Зарегистрируйте ИП в СберБизнесе — бесплатно и всего за полчаса
Как правило, вопросом, где узнать КПП, озадачены бухгалтеры и предприниматели, которые составляют отчётность для Федеральной налоговой службы (ФНС) или направляют платёжные поручения в банк.
Узнать КПП по ИНН организации просто. На сайте ФНС есть сервис «Предоставление сведений из ЕГРЮЛ/ЕГРИП в электронном виде». Укажите ИНН организации, и на экране появится КПП юридического лица по месту его нахождения.
Есть ли КПП у ИП?В соответствии с порядком, утверждённым ФНС, КПП присваивается только организациям.
Так что у индивидуальных предпринимателей отсутствует такой реквизит.
Что делать, если в бланках требуется указать КПП?Бланки деклараций и заявлений, бухгалтерские документы содержат пункт для внесения КПП. Это единые бланки, которые предназначены как для юридических лиц, так и для индивидуальных предпринимателей. Но индивидуальным предпринимателям это поле можно просто не заполнять.
Однако пустой графу тоже нельзя оставлять. Часто в банках и других учреждениях не принимают документы с отсутствующими данными. Правила заполнения бумаг бухгалтерской отчётности (приказ № 148н от 23 сентября 2016 года) не допускают проставления нулевого значения в графах. Если реквизит отсутствует, то проставляется прочерк.
Индивидуальному предпринимателю достаточно знать свой ИНН. Этих данных хватает, чтобы провести бухгалтерский расчёт и подать отчёт в налоговую.
Информацию о номере ИНН можно узнавать на сайте ФНС или посмотреть её в свидетельстве.
Читайте также
Коды бюджетной классификации (КБК) для индивидуальных предпринимателей: что это такое и как их применять
Какие реквизиты точно должны быть у ИП?Реквизиты ИП требуются при подписании договоров с контрагентами и при оказании и получении любых видов услуг.
Для ИП потребуется прописывать в документах следующие данные:
- общие сведения, обозначающие предпринимателя как физическое лицо
- общероссийский классификатор предприятий — ОКПО ИНН
- ОКАТО — индекс расположения
- индивидуальный номер налогоплательщика — ИНН
- ОГРНИП — государственный основной номер регистрации.
Если в банках и других учреждениях чаще всего сотрудники в курсе, что ИП не обязан указывать КПП, так как у него просто нет такого реквизита, то контрагенты иногда приостанавливают сотрудничество, когда ИП не вписывает КПП. Предприниматели из-за юридической безграмотности не могут понять, почему это значение отсутствует. В этом случае можно сослаться на следующие документы:
- Письмо Министерства финансов № 03-02-08-14, которое содержит общие объяснения о правилах присвоения КПП, а также ссылки на все нормативные акты
- Федеральный закон № 129, который устанавливает правила проведения регистрационных действий в отношении бизнесменов
- Приказ ММВ7/6/435, изданный налоговой службой, о том, что индивидуальные предприниматели не получают КПП.
Контрольных точек базы данных — Улучшения в SQL Server 2016
Когда в базе данных вставляется новая строка или обновляется существующая, компонент SQL Server Database Engine сначала сохраняет это изменение в пуле буферов в памяти, не применяя каждое изменение непосредственно к файлам базы данных из соображений производительности ввода-вывода. Эти страницы данных, расположенные в пуле буферов и еще не отраженные в файлах базы данных, называются Dirty Pages . Компонент SQL Server Database Engine использует особый вид процессов для периодической записи этих грязных страниц в файлы базы данных данных и журналов.Эти процессы называются Контрольные точки . Контрольная точка создает метку, которая используется ядром СУБД SQL Server для повторения любой зафиксированной транзакции, записываемой в файл журнала транзакций базы данных без отражения изменений данных в файлах данных из-за неожиданного завершения работы или сбоя. Кроме того, эта точка восстановления, созданная контрольной точкой, будет использоваться для отката любых изменений данных, связанных с незафиксированной транзакцией, путем отмены операции, записанной в файле журнала транзакций.Таким образом, SQL Server Engine гарантирует целостность базы данных. Время, затрачиваемое ядром СУБД SQL Server на повторение и отмену транзакций, называется Время восстановления . Вся информация о контрольных точках будет записана на загрузочную страницу базы данных, чтобы определить, до какой точки файлы базы данных синхронизируются с пулом буферов, когда система просыпается после сбоя или завершения работы.
Компонент SQL Server Database Engine поддерживает четыре типа контрольных точек: внутренние, ручные, автоматические и косвенные.
Внутренние контрольные точки выдаются в ответ на несколько событий сервера, таких как создание резервной копии базы данных, создание моментального снимка базы данных, добавление или удаление файлов базы данных, полное завершение работы службы SQL Server или 70% журнала транзакций базы данных простой модели восстановления заполнена.
Ручные контрольные точки запускаются при выполнении команды CHECKPOINT T-SQL, где вы можете дополнительно указать параметр checkpoint_duration, который определяет количество времени в секундах, которое требуется контрольной точке для завершения.Если параметр длительности контрольной точки не указан, ручная контрольная точка будет работать до завершения, потребляемое количество времени зависит от количества грязных страниц, которые должна записать операция. Приведенный ниже оператор T-SQL вызовет ручную контрольную точку максимум на 10 секунд:
Автоматические контрольные точки выдаются автоматически в фоновом режиме, когда количество записей журнала в буферном пуле достигает расчетного количества журналов, которые ядро СУБД SQL Server может обработать за настраиваемое количество времени, называемое интервалом восстановления .Параметр интервала восстановления на уровне сервера указывает максимальное количество времени, необходимое ядру СУБД SQL Server для восстановления базы данных после перезапуска SQL Server. Значение интервала восстановления по умолчанию — 0, при котором каждые 60 секунд выдается автоматическая контрольная точка.
Значение интервала восстановления можно настроить с помощью команды T-SQL sp_configure, как показано ниже:
USE [master] GO EXEC sp_configure ‘показать дополнительные параметры’, 1; GO RECONFIGURE GO EXEC sp_configure ‘recovery interval’, 0 GO RECONFIGURE GO |
Его также можно настроить с помощью SQL Server Management Studio на вкладке «Настройка базы данных» окна «Свойства сервера» следующим образом:
Автоматические контрольные точки также зависят от количества записей журнала, созданных в базе данных; Создаваемое огромное количество записей журнала будет чаще выдавать автоматические контрольные точки.Автоматическая контрольная точка будет работать до завершения, как и ручная контрольная точка.
Время, необходимое ядру СУБД SQL Server для восстановления базы данных после сбоя системы, в основном зависит от количества времени, необходимого для повторного выполнения грязных страниц, которое в большинстве случаев больше, чем параметр сервера интервала восстановления. Таким образом, изменение значения интервала восстановления по умолчанию может повысить производительность, в основном, если откат длинных транзакций в вашей базе данных занимает более 60 секунд, или если вы заметили очень частые процессы контрольной точки, которые ухудшают производительность базы данных, поскольку автоматическая контрольная точка увеличивается. операции ввода-вывода базы данных при выдаче.Рекомендуется постепенно переопределять значение интервала восстановления по умолчанию с небольшими приращениями каждый раз и тщательно проверять эффект каждого увеличения, так как увеличение этого значения увеличит время, необходимое для восстановления базы данных. Автоматическая контрольная точка — это тип контрольной точки по умолчанию в версиях SQL Server до SQL Server 2016.
Indirect Checkpoints впервые представлен в SQL Server 2012, в котором время восстановления может быть настроено на уровне базы данных, обеспечивая более быстрое и точное время восстановления по сравнению с автоматической контрольной точкой, поскольку это гарантирует, что количество грязных страниц будет всегда быть меньше определенного порога.Косвенные контрольные точки уменьшают всплески ввода-вывода, связанные с контрольными точками, поскольку он продолжает плавно записывать грязные страницы в файлы базы данных в фоновом режиме. Он также учитывает случайный ввод-вывод во время процесса REDO, что позволяет удерживать время восстановления базы данных в пределах верхнего предела.
Если косвенная контрольная точка настроена в базе данных с большой рабочей нагрузкой OLTP и узким местом дисковой системы, это может вызвать снижение производительности, так как она будет продолжать записывать грязные страницы на диск очень часто, чтобы соответствовать настроенному значению интервала восстановления, увеличивая нагрузка записи для SQL Server.
Начиная с SQL Server 2016, тип контрольной точки по умолчанию — это косвенная контрольная точка, а значение по умолчанию для параметра времени восстановления составляет 60 секунд для баз данных, созданных в этой версии SQL Server, и 0 для баз данных, созданных в более старых версиях SQL Server, что означает что база данных использует автоматические контрольные точки.
Передача физических страниц данных в SQL Server 2016 более эффективна в косвенных контрольных точках, поскольку ядро СУБД SQL Server передает страницы данных группами, причем каждый объемный размер составляет до 1 МБ, при этом максимальный размер передачи составляет 256 КБ в более ранней версии. версии.Время, в течение которого компонент SQL Server Database Engine будет ждать перед корректировкой невыплаченного объема ввода-вывода, также увеличилось в SQL Server 2016, где компонент Database Engine будет ждать 20 мс в предыдущих версиях SQL Server, но теперь он будет ждать 50 мс перед применением этого корректирование.
Параметр времени восстановления базы данных можно проверить, запросив системную таблицу sys.databases для свойства базы данных target_recovery_time_in_seconds, как показано ниже:
ВЫБЕРИТЕ имя, target_recovery_time_in_seconds FROM sys.базы данных WHERE name = ‘SQLShackDemo’ |
Результат для нашей тестовой базы данных SQLShackDemo будет таким:
Его также можно проверить с помощью инструмента SQL Server Management Studio на вкладке «Параметры» в свойствах базы данных следующим образом:
Хотя мы используем версию SQL Server 2016, значение 0 в предыдущем результате указывает на то, что база данных SQLShackDemo использует автоматические контрольные точки, поскольку она восстановлена из старой версии SQL Server или текущий экземпляр был обновлен из старой версии SQL Server, что имеет смысл .
SQL Server также позволяет настроить скорость косвенной контрольной точки в качестве параметра запуска, указав (-k), за которым следует десятичное значение, которое указывает скорость контрольной точки в МБ в секунду.
Давайте рассмотрим небольшую демонстрацию, чтобы проверить, как операция записи ввода-вывода улучшена в SQL Server 2016, который по умолчанию использует тип косвенных контрольных точек. Предположим, что нам нужно применить тяжелую операцию DML в базе данных SQLShackDemo, заполнив каждую таблицу в этой базе данных дополнительными 100 строками с помощью инструмента ApexSQL Generate, как показано ниже:
Как мы ранее выяснили, база данных SQLShackDemo использует тип автоматических контрольных точек.Если мы попытаемся отследить Avg. Счетчик производительности Disk Sec / write в группе счетчиков LogicalDisk с использованием инструмента Windows Performance Monitor во время процесса вставки, процесс записи будет иметь форму всплесков, как показано ниже:
Если мы изменим тип контрольных точек на косвенные контрольные точки, изменив параметр базы данных Target_Recovery_Time на 60, а не на 0, используя следующий оператор ALTER DATABASE:
ALTER DATABASE [SQLShackDemo] SET TARGET_RECOVERY_TIME = 60 СЕКУНД С NO_WAIT GO |
Или с помощью SQL Server Management Studio на вкладке «Параметры» окна «Свойства базы данных», как показано ниже:
И примените ту же нагрузку DML к базе данных, отслеживая поведение записи ввода-вывода с помощью инструмента Performance Monitor, «плавный» результат записи будет примерно таким:
Из предыдущих результатов ясно, что при использовании автоматических контрольных точек процесс записи будет иметь форму больших всплесков.Когда база данных настроена на использование косвенных контрольных точек, поток ввода-вывода стал плавными небольшими всплесками, обеспечивающими более согласованное время отклика на диске с лучшей общей производительностью.
Заключение
Контрольная точка — это средство, с помощью которого ядро СУБД SQL Server гарантирует согласованность баз данных, при этом данные не будут потеряны при сбое системы, поскольку грязные страницы, расположенные в памяти и возникшие в результате зафиксированной транзакции, будут повторены, хотя они не были записано в файлы базы данных еще нет.SQL Server предоставляет четыре основных типа контрольных точек; Внутренние, ручные, автоматические и косвенные контрольные точки. Начиная с версии SQL Server 2016, косвенная контрольная точка является типом контрольной точки по умолчанию, который позволяет вам настроить более быстрое и точное время восстановления на уровне базы данных и преодолеть проблему больших пиков записи, записывая плавные небольшие пики, как мы ясно видели в демонстрации. показано в статье.
Следующая статья из серии:
Полезные ссылки
Ахмад Ясин (Ahmad Yaseen) — инженер Microsoft по большим данным с глубокими знаниями и опытом в областях SQL BI, администрирования баз данных SQL Server и разработки.
Он является сертифицированным специалистом по решениям Microsoft в области управления данными и аналитикой, сертифицированным партнером по решениям Microsoft в области администрирования и разработки баз данных SQL, партнером разработчика Azure и сертифицированным инструктором Microsoft.
Кроме того, он публикует свои советы по SQL во многих блогах.
Посмотреть все сообщения от Ahmad Yaseen
Последние сообщения от Ahmad Yaseen (посмотреть все)Митотические повреждения ДНК и контрольные точки репликации в дрожжах
Curr Opin Cell Biol. Авторская рукопись; доступно в PMC 2010 4 мая.
Опубликовано в окончательной отредактированной форме как:
PMCID: PMC2864141
NIHMSID: NIHMS196154
Исследовательский институт Скриппса, 10550 Torrey Pines Road, La Jolla, CA , USA
статья.Abstract
Исследования генетики контрольных точек G 2 / M у почкующихся и делящихся дрожжей привели к появлению многих определяющих концепций биологии контрольных точек. Недавний прогресс в биохимии продуктов генов контрольных точек добавляет механистическое понимание нашим моделям и идентифицирует компоненты нормального механизма клеточного цикла, на которые нацелены контрольные точки.
Введение
Парадигма, согласно которой контрольные точки останавливают клеточный цикл, чтобы дать время для завершения предыдущего события клеточного цикла или восстановления клеточного повреждения, стала рассматриваться как фундаментальная часть регуляции клеточного цикла. Это результат признания широкого распространения контрольных точек и осознания того, что различия между контрольными точками и механизмами, которые обычно управляют синхронизацией переходов клеточного цикла, часто являются семантическими. В последние несколько лет исследования контрольно-пропускных пунктов расцвели в широте [1] и глубине [2].Были идентифицированы контрольные точки, которые регулируют все основные переходы митотического клеточного цикла и несколько переходов мейотического клеточного цикла. Белки контрольных точек также играют роль в регуляции транскрипции, индукции репарации ДНК, восстановлении после остановки клеточного цикла, адаптации и, у многоклеточных животных, в апоптозе. Все более подробные генетические, молекулярные и биохимические анализы продуктов генов, задействованных в контрольных точках, быстро выявляют механизмы, с помощью которых они оказывают свое воздействие.
Этот обзор охватывает последние разработки в этой области, основанные на работе с Saccharomyces cerevisiae и Schizosaccharomyces pombe .Мы фокусируемся на функциях остановки клеточного цикла контрольной точки повреждения ДНК G 2 / M, которая предотвращает митоз в присутствии поврежденной ДНК, и контрольной точке репликации S / M, которая предотвращает митоз, когда репликация ДНК блокируется, имея дело в основном с экспериментами, которые показывают прямое влияние на развитие клеточного цикла.
G 2 Контрольные точки / M предотвращают прохождение клеток через митоз. В некоторых случаях, таких как контрольная точка повреждения ДНК G 2 в S. pombe и позвоночных, клетки задерживаются в G 2 [3,4], в то время как в других, таких как контрольные точки повреждения ДНК и веретена. в с.cerevisiae , клетки останавливаются во время М фазы при переходе от метафазы к анафазе [5,6]. Но, насколько мы можем судить, общая цель контрольных точек G 2 / M состоит в том, чтобы предотвратить разделение сестринских хроматид, которое при наличии повреждения ДНК или неполной репликации является необратимым шагом, который превращает временную неудачу в летальное событие (). Следовательно, контрольные точки G 2 / M должны нацеливаться на событие непосредственно перед разделением сестринских хроматид. У S. pombe и позвоночных для этой цели служит переход G 2 / M, регулируемый ингибирующим фосфорилированием тирозина Cdc2 sp [7 ••, 8 ••, 9].У S. cerevisiae , однако, события, регулируемые фосфорилированием тирозина Cdc28 sc , такие как разделение тела полюса веретена и контрольная точка образования зачатка, происходят намного раньше в клеточном цикле, примерно в конце S-фазы [ 10,11] (). Таким образом, период между фазой S и митозом у S. cerevisiae в некотором смысле больше похож на метафазу, чем на G 2 . Вместо нацеливания на переход контрольные точки S. cerevisiae нацелены на переход от метафазы к анафазе [5,12].Чтобы помочь различить перекрывающуюся номенклатуру двух дрожжей, в этом обзоре названия гена и белка S. cerevisiae и S. pombe идентифицированы с помощью суперскриптов sc и sp, соответственно.
Модели контроля на КПП в ( a ) S. pombe и ( b ) S. cerevisiae . Эти модели регуляторных путей контрольных точек представляют собой интерпретацию множества генетических, молекулярных и биохимических данных.Близость названий белков друг к другу не обязательно подразумевает физическое взаимодействие. (а) Расположение Cut5 sp в двух местах отражает неуверенность в его точной роли. (b) Знаки вопроса представляют неизвестную мишень пути Rad53 sc / Dun1 sc . Неизвестно, не зависит ли эта мишень от роли Dun1 sc в индукции транскрипции.
The
Schizosaccharomyces pombe G 2 Контрольная точка повреждения ДНКБелки, участвующие в контрольной точке повреждения ДНК G 2 , можно разделить на три группы: контрольная точка rad белки, которые также участвуют в S / M контрольная точка репликации, белки, специфичные для контрольной точки повреждения ДНК G 2 , и гены-мишени, которые являются частью нормального митотического аппарата.Гены контрольной точки rad включают в себя гены rad1 sp , rad3 sp , rad9 sp , rad17 sp , rad26 sp
Hus. Они необходимы для всех известных контрольных точек ДНК S. pombe [3,13,14]. По крайней мере, продукты гена checkpoint rad служат в качестве преобразователей сигналов между сигналом первичной контрольной точки и аппаратом клеточного цикла.Они также могут принимать непосредственное участие в распознавании повреждений ДНК, поскольку некоторые из них подобны белкам, участвующим в метаболизме ДНК (). Rad1 sp похож на экзонуклеазу Rec1 Ustilago , предполагаемый человеческий гомолог Rad1 sp (hRad1) проявляет экзонуклеазную активность [15,16 •], а Rad17 sp имеет ограниченное сходство с фактором репликации C (RFC) [17]. Более того, гомологов Rad1 и Rad17 S. cerevisiae, были вовлечены в процессинг повреждений ДНК [18].Наиболее интересным является сходство Rad3 sp с ДНК-зависимой протеинкиназой (ДНК-PK) [19,20]. DNA-PK представляет собой трехсубъединичный фермент, который активируется путем связывания с двух- и одноцепочечными разрывами ДНК [21], что позволяет предположить, что ДНК-PK-подобные киназы могут непосредственно участвовать в распознавании поврежденной ДНК. Каталитическая субъединица ДНК-ПК представляет собой большую и необычную протеинкиназу, которая имеет структурное сходство с липидкиназой [19]. Другие члены семейства ДНК-PK, участвующие в регуляции контрольных точек, включают ATM (мутированная атаксия, телеангиэктазия) и ATR (связанный с ATM) у людей, а также Mec1 в S.cerevisiae [19,22–24]. Однако для эффективной активации ДНК-ПК разрывами ДНК необходимы две регуляторные субъединицы, Ku70 и Ku86 [21]. Гомологи KU не были обнаружены в S. pombe , а субъединицы KU в S. cerevisiae не участвуют в контрольных точках повреждения ДНК [25].Таблица 1
Гены контрольных точек митотической ДНК дрожжей.
| Гомологи контрольных точек * | Функция / сходство | Ссылки | ||||||
|---|---|---|---|---|---|---|---|---|
| Другие дрожжи | Человеческие | 9002 | ||||||
| Повреждение и репликация | ||||||||
| Rad1 sp | Rad17 sc | hRad1 ‡ | Exonuclease | • 3,1355 9003 spDdc1 sc | hRad9 ‡ | [3,81] | ||
| Rad17 sp | Rad24 sc | hRad ‡ 17 аналогичный | [3,17,82 •] | |||||
| Rad26 sp | [14,72 •, 74 ••] | |||||||
| Hus1 sp | 4 hHus1 902 ‡ | [13,26 ••] | ||||||
| Cut5 sp † | Dpb11 sc | XRCC1 как повторы | 9036 2 [27,28,29 •]||||||
| Повреждение | ||||||||
| Chk1 sp | hChk1 | Серин / треониновая протеинкиназа | [30,83 ••] | |||||
| sp | Rad9 sc | BRCT мотив | [33 ••, 34] | |||||
| Rad24 sp | 14–3–3 | 14–3–3 | [43] | |||||
| Репликация | ||||||||
| Pol1 sp | ДНК pol α | [67] | ||||||
| Cds1 sp | Rad53 sc Серин / треониновая протеинкиназа с FHA | [53,73 ••, 74 ••, 75] | ||||||
| Мишени | ||||||||
| Wee1 sp | hWee1 ‡ | Cd 2-Y15 киназа | [36] | |||||
| Cdc25 sp | Cdc25C | Cdc2-Y15 фосфатаза | [36] | |||||
| S.cerevisiae | ||||||||
| Повреждение и репликация | ||||||||
| Mec1 sc | Rad3 sp | ATM | ДНК-PK-подобная протеинкиназа | [2,52] 58 | sc Cds1 sp | Серин / треониновая протеинкиназа с 2 FHA | [48,52,53,57 ••] | |
| Повреждение | ||||||||
| Rad9 sc | Crb2 spМотив BRCT | [18,34,44,51 •, 57 ••, 86] | ||||||
| Rad17 sc | Rad1 sp | hRad1 ‡ | Экзонуклеаза[12,87] | |||||
| Rad24 sc | Rad17 sp | hRad17 ‡ | Ограниченное сходство с RFC | [12,87] | ||||
| Ddc1 sc | Rad9 sp | hRad9 ‡ | ||||||
| Mec3 sc | 9317 | |||||||
| Pol2 sc | DNA pol ε | [78] | ||||||
| Dpb11 sc | Cut5 sp | XRCC1 как повторы 7931] | ||||||
| Rfc5 sc | RFC small subunit | [80] | ||||||
| Цели | ||||||||
| Pds1 sc | ингибитор анафазов •] | |||||||
Являются ли другие контрольные точки Rad белками регуляторными партнерами Rad3 sp ? Слишком рано говорить, но накапливаются доказательства того, что по крайней мере некоторые из белков контрольной точки Rad связывают in vivo с .Rad1 sp и Hus1 sp связаны вместе in vivo , и это взаимодействие зависит от Rad9 sp , указывая тем самым, что они могут образовывать гетеротример [26].
Более того, Hus1 sp фосфорилируется в ответ на повреждение ДНК, и это фосфорилирование зависит от Rad1 sp и Rad9 sp , а также Rad3 sp [26]. Делеции других генов checkpoint rad не влияют на комплекс Rad1 sp -–Hus1 sp .Следовательно, Rad1 sp , Hus1 sp и, возможно, Rad9 sp образуют стабильный комплекс, независимый от других генов контрольной точки rad .
Седьмой ген, cut5 sp , также может принадлежать к классу checkpoint rad , но его анализ осложняется тем, что он необходим для репликации [27]. Таким образом, клетки cut5, sp, Δ являются неактивными, и большая часть анализа была проведена с использованием термочувствительных аллелей, которые могут сохранять некоторую остаточную функцию.Cut5 sp требуется как для S / M, так и для контрольной точки повреждения ДНК, индуцированной G 2 [28,29 •], вызванной гамма-излучением [28,29 •], но, что удивительно, не для контрольной точки повреждения ДНК, индуцированной УФ-излучением G 2 [ 28,29 •]. Указывают ли эти результаты на реальную разницу между контрольными точками γ- и УФ-повреждения или на сложность использования ненулевых мутаций ts cut5 sp , еще предстоит определить.
Одна роль контрольных белков Rad в контрольной точке повреждения ДНК G 2 заключается в регулировании серин / треонинкиназы Chk1 sp .Удаление Chk1 sp полностью инактивирует контрольную точку повреждения ДНК G 2 [14]. Клетки с мутацией chk1 sp Δ не так чувствительны к повреждению ДНК, как клетки с делецией любого из генов контрольной точки rad , предполагая, что белки Rad контрольной точки также имеют независимую роль Chk1 sp , возможно, в активации репарации ДНК [14,30]. Более того, делеция Chk1 sp не влияет на контрольную точку S / M, указывая на то, что гены контрольной точки rad имеют другие мишени в контрольной точке S / M, как обсуждается ниже [14,30].Chk1 sp фосфорилируется в ответ на повреждение ДНК, и это фосфорилирование зависит от контрольных белков Rad [31].
Природа взаимодействия между Chk1 sp и контрольными белками Rad остается неясной, но анализ недавно идентифицированного белка Crb2 sp обещает пролить свет на проблему. Crb2 sp , подобно Chk1 sp , специфичен для контрольной точки повреждения ДНК G 2 и действует ниже контрольной точки Rad белков [32, 33].Как и Rad9 sc , он содержит карбоксиконцевой мотив BRCA1 (BRCT) [32, 33], также обнаруженный в p53-связывающем белке 1 (53BP1) и гене предрасположенности к раку груди BRCA1 [34,35]. Хотя интригует то, что мотив BRCT обнаруживается в ряде других неродственных белков, участвующих в контрольных точках и раке, его роль пока неясна. Crb2 sp фосфорилируется в ответ на повреждение ДНК зависимым от белка контрольной точки, но Chk1 sp независимым образом [33].Это фосфорилирование может высвобождать Crb2 sp из большого комплекса, поскольку Crb2 sp обнаруживается во фракциях с более низкой молекулярной массой после повреждения ДНК. Напротив, фосфорилирование Chk1 sp зависит от Crb2 sp [33]. Эти данные предполагают, что Crb2 sp действует ниже контрольных белков Rad и выше Chk1 sp . Таким образом, Crb2 sp может действовать как посредник между белками контрольной точки Rad и Chk1 sp . В соответствии с этой идеей, Chk1 sp и Crb2 sp взаимодействуют в двухгибридном анализе, хотя это взаимодействие не было обнаружено in vivo [33].Crb2 sp также взаимодействует с Cut5 sp in vitro , обеспечивая потенциальную связь между Crb2 sp / Chk1 sp и белками контрольной точки Rad [33].
Конечной целью контрольной точки повреждения ДНК G 2 является фосфорилирование тирозина циклин-зависимой киназы Cdc2 sp [7]. Время митоза в нормальном клеточном цикле контролируется фосфорилированием Cdc2 sp на Tyr15, которое поддерживает комплексы Cdc2 sp -циклин B на межфазном уровне активности, достаточно высоком, чтобы инициировать репликацию и предотвратить повторную репликацию, но слишком низко. запускать митоз [36].Фосфорилирование Tyr15 катализируется киназами Wee1 sp и Mik1 sp и удаляется фосфатазой Cdc25 sp и в меньшей степени фосфатазой Pyp3 sp [36]. При переходе G 2 → M баланс активности киназы и фосфатазы смещается в пользу дефосфорилирования, активируется Cdc2 sp , и наступает митоз. Во время остановки контрольных точек, вызванной повреждением ДНК, Cdc2 sp сохраняется в своей фосфорилированной тирозином форме [7, 37].Мутация Tyr15 в Phe (который не может быть фосфорилирован) отменяет контрольную точку, показывая, что фосфорилирование Tyr15 Cdc2 sp необходимо для остановки контрольной точки [7]. Тот факт, что нет остаточной контрольной точки в клетках cdc2-Y15F (однобуквенный код для аминокислот), также показывает, что S. pombe не имеет значимой метафазы для контрольной точки анафазного повреждения ДНК.
Для того, чтобы поддерживать Cdc2 sp в его фосфорилированной тирозином межфазной форме, контрольная точка должна быть нацелена либо на Cdc25 sp , Wee1 sp , Mik1 sp , либо на некоторую их комбинацию.В соответствии с этим Chk1 sp может фосфорилировать как Wee1 sp , так и Cdc25 sp in vitro , хотя эффект этого in vivo еще не определен [37, 38]. Роль Cdc25 sp как мишени для контрольной точки повреждения ДНК G 2 была продемонстрирована генетическим анализом [38]; кроме того, дефосфорилирование Cdc2 sp с помощью Cdc25 sp ингибируется контрольной точкой [7]. Неизвестно, вызвано ли такое ингибирование инактивацией Cdc25 sp или механизмом, который предотвращает доступ к Cdc2 sp из Cdc25 sp .Хотя эти данные показывают, что Cdc25 sp является мишенью для контрольной точки повреждения ДНК, они определенно не исключают возможность того, что Wee1 sp или Mik1 sp также могут быть мишенью.
Регулирование Cdc25 sp с помощью контрольной точки повреждения ДНК G 2 может включать белок 14-3-3 Rad24 sp . Название 14-3-3 описывает большое семейство белков, которые связываются с фосфорилированным консенсусным сайтом во множестве белков, включая Cdc25 [39,40,41 •, 42 ••].Делеция rad24 sp способствует митозу, что согласуется с Rad24, действующим как негативный регулятор Cdc25 во время нормального роста, но только частично нарушает контрольную точку повреждения ДНК G 2 [43]. Оставшаяся функция контрольной точки в клетках rad24 sp Δ может быть связана с Rad25, sp , другим белком 14-3-3 и супрессором высокой копии rad24 sp Δ [43]; тем не менее, rad25 sp Δ не имеет дефекта контрольной точки, а клетки rad24 sp Δ rad25 sp Δ являются неактивными, предполагая, что эти гены имеют важные функции, не связанные с контрольными точками [43].
Saccharomyces cerevisiae контрольная точка повреждения метафазной ДНКПять генов в S. cerevisiae , RAD9 sc , RAD17 sc , RAD2 sc2 и DDC1 sc , необходимы для контрольной точки повреждения метафазной ДНК, но не для контрольной точки репликации S / M [12,44,45 ••]. Эти гены можно разделить на две группы: RAD9, sc, , в одной, а остальные — в другой, называемые группой эпистаза RAD24, sc, , .Это различие проводится на основе аддитивных фенотипов rad9 sc Δ в сочетании с делециями членов группы эпистаза RAD24 sc [18,46 •, 47 ••]. Два других гена, необходимые для контрольной точки повреждения метафазной ДНК, MEC1 s c и RAD53 sc , также необходимы для контрольной точки S / M [12,48]. Они также различаются тем, что необходимы для жизнеспособности, но эта роль не зависит от их функций митотических контрольных точек (SJ Elledge, личное общение).
Mec1 sc , как и Rad3 sp , является членом семейства ДНК-PK протеинкиназ [2]. Другой член этого семейства — Tel1 sc , белок, участвующий в поддержании теломер [49]. Хотя номер Tel1 sc не требуется для контрольно-пропускных пунктов в S. cerevisiae , он может заменить Mec1 sc в ряде ситуаций [50,51 •, 52]. Rad53 sc также является протеинкиназой и содержит два домена, ассоциированных с вилкой (FHA), по одному на обоих концах белка [48,53], которые могут участвовать в связывании регуляторных партнеров.Dun1 sc является гомологом Rad53 sc , который также участвует в контрольных точках [54]. В то время как основная роль Dun1 sc , как полагают, находится ниже Rad53 sc в индукции транскрипции генов репарации, клетки dun1 sc Δ действительно имеют дефект частичной остановки контрольной точки, который может быть или не быть связан с роль Dun1 sc в транскрипции [54,55]. Rad53 sc фосфорилируется в ответ на повреждение ДНК, и это фосфорилирование зависит от Mec1 sc , Rad9 sc и белков группы эпистаза Rad24 sc [52,56].Остается определить, является ли Rad53 sc прямым субстратом Mec1 sc .
Считалось, что как Rad9 sc , так и белки группы Rad24 sc функционируют выше Mec1 sc [2]. Некоторые белки группы Rad24 sc структурно сходны с белками, участвующими в метаболизме ДНК (), и необходимы для процессинга поврежденной ДНК [18]. И Rad9 sc , и Ddc1 sc , однако, фосфорилируются после повреждения ДНК зависимым от Mec1 sc образом, указывая тем самым, что они лежат ниже Mec1 sc [45 ••, 51 •, 57 ••].Простая интерпретация этих результатов состоит в том, что Rad9 sc и Ddc1 sc связываются с Mec1 sc таким образом, что они необходимы для активации Mec1 sc и служат субстратами Mec1 sc . Это обычная ситуация для регуляторных субъединиц киназ; однако различия между ролями Rad9 sc и Ddc1 sc подтверждают, что они могут находиться в разных комплексах Mec1 sc [47]. Для обоснования такой модели предстоит проделать большую работу.Первоначальная работа привела к характеристике Rad9 sc и Ddc1 sc . Ddc1 sc взаимодействует in vivo с Mec3 sc , и эта ассоциация требует Rad17 sc [47 ••]. Это напоминает наблюдение, что гомологов S. pombe Rad17 sc и Ddc1 sc , Rad1 sp и Rad9 sp также могут взаимодействовать [26]. Фосфорилирование Ddc1 sc зависит от других членов группы Rad24 sc , но не от Rad9 sc , что согласуется с аддитивными ролями Rad9 sc и Rad24 sc [47].Фосфорилирование Rad9 sc приводит к его ассоциации с Rad53 sc через второй из двух доменов FHA Rad53 sc [51, 57]. Вероятно, что Rad9 sc действует как адаптер, так что при фосфорилировании Mec1 sc он рекрутирует Rad53 sc для фосфорилирования, в свою очередь, с помощью Mec1 sc . Это не может быть единственной ролью Rad9 sc , однако, потому что фосфорилирование Pds1 sc зависит от Rad9 sc , но не от Rad53 sc [58 ••].
Для остановки клеток контрольная точка повреждения метафазной ДНК S. cerevisiae нацелена на стабильность Pds1 sc . Pds1 sc является ограничивающим скорость негативным регулятором анафазы, которая разрушается при переходе от метафазы к анафазе. Экспрессия нерасщепляемого Pds1 sc предотвращает анафазу, тогда как делеция PDS1 sc делает возможным преждевременное разделение сестринских хромосом [59,60], а также ставит под угрозу контрольную точку повреждения метафазной ДНК [5].Pds1 sc фосфорилируется в ответ на повреждение ДНК зависимым от Rad9 sc и Mec1 sc образом [58]. Хотя эффект фосфорилирования Pds1 sc неизвестен, есть соблазн предположить, что он стабилизирует белок, приводя к остановке метафазы. Фосфорилирование Pds1 sc не зависит от Rad53 sc или Ddc1 sc [47 ••, 58 ••]. В соответствии с этим наблюдением, мутации ни в RAD53 sc , ни в PDS1 sc по отдельности полностью не устраняют контрольную точку повреждения метафазной ДНК, хотя обе мутации вместе это делают (R Gardner, C. Putnam, T. Weinert, личное сообщение).Следовательно, Rad53 sc , вероятно, будет иметь независимую мишень Pds1 sc . Этот зависимый арест Rad53 sc также зависит от Dun1 sc . В этом контексте интересно отметить, что поддержание активности Cdc28 sc , по-видимому, необходимо для остановки метафазы у S. cerevisiae . Мутации, которые снижают активность Cdc28, нарушают арест метафазы [61,62]. Эти результаты привели к модели, в которой как активность Cdc28 sc , так и стабильность Pds1 sc необходимы для предотвращения анафазы [62].Если это так, контрольная точка остановки метафазы может действовать как для стабилизации Pds1 sc посредством Rad53 sc независимым образом, так и для поддержания активности Cdc28 sc через Rad53 sc -зависимый механизм.
В дополнение к хорошо изученной контрольной точке митотического повреждения ДНК была идентифицирована вторая контрольная точка, находящаяся в середине анафазы [63]. Эта зависимая от Rad9 sc контрольная точка запускается растяжением дицентрических хромосом в начале анафазы.Это говорит о том, что существует независимая регуляция анафазы A и B. Контрольная точка середины анафазы может предоставлять средства для расчленения этой регуляции.
Контрольная точка S / M репликации
S. pombeКонтрольная точка репликации S / M в S. pombe определяется как контрольная точка, которая предотвращает митоз, если репликация блокируется гидроксимочевиной (HU) [64]. HU является конкурентным ингибитором рибонуклеотидредуктазы, который блокирует репликацию после инициации, предотвращая синтез нуклеотидов.Нереплицированная ДНК per se недостаточна для активации S / M checkpoint, поскольку мутанты, которые не могут инициировать репликацию, тем не менее, находятся в стадии митоза [65]. Таким образом, чтобы показать, что белок репликации играет непосредственную роль в контрольной точке S / M, важно показать, что он необходим для контрольной точки в условиях, в которых он не требуется для репликации. В S. pombe чувствительные к температуре мутации в репликационных белках, таких как полимеразы и лигаза, часто приводят к блокировке, зависящей от контрольной точки, с близким к полностью реплицированным содержанием ДНК.Этот арест, в отличие от HU-индуцированного ареста, зависит от Chk1 и Crb2 и генетически идентичен контрольной точке повреждения ДНК G 2 [33, 66]. Хотя этот тип ареста контрольной точки иногда называют контрольной точкой репликации, он отличается от контрольной точки репликации S / M, вызванной HU. Простое объяснение этого типа остановки контрольной точки состоит в том, что мутантные клетки завершают репликацию основной ДНК и, следовательно, не активируют контрольную точку S / M, но оставляют ДНК в несовершенном состоянии, которое затем запускает контрольную точку повреждения ДНК G 2 .
Первичный сигнал в контрольной точке S / M, вероятно, исходит от самих вилок репликации. В S. pombe ДНК-полимераза, ответственная за инициацию репликации, ДНК-полимераза α (кодируемая pol1 sp ), по-видимому, является одним из белков, участвующих в передаче этого сигнала [67]. Клетки с мутациями pol sp Δ (полученные из проросших спор диплоидов pol1 sp / pol1 sp Δ ) частично реплицируют свою ДНК, вероятно, с использованием остаточного материнского белка pol1 sp , но не имеют белка S / КПП М.Таким образом, ДНК-полимераза а требуется для контрольной точки S / M даже после того, как репликация инициирована. Роль Cut5 sp в S / M checkpoint также не зависит от его требований к репликации [28,29 •]. Следовательно, Cut5 sp может также играть роль в генерации сигнала контрольной точки S / M, хотя это, вероятно, останется неясным до тех пор, пока не будет понятна существенная роль Cut5 sp в репликации. В отличие от S. cerevisiae , ДНК-полимераза ε не требуется для S.pombe КПП [68 •].
Как и в контрольной точке повреждения ДНК G 2 , контрольная точка S / M предотвращает митоз, предотвращая дефосфорилирование тирозина Cdc2 sp [69 •]. Этот механизм не снижает активность Cdc2, а скорее поддерживает ее на межфазном уровне [70]. Генетические исследования показали, что Cdc25 sp является мишенью для контрольной точки S / M [64]; более того, как и в случае повреждения ДНК во время G 2 , обработка HU снижает скорость дефосфорилирования тирозина Cdc2 sp с помощью Cdc25 sp [69 •].Поскольку, как описано ниже, Wee1 также фосфорилируется киназой S / M контрольной точки in vitro , две контрольные точки G 2 / M имеют перекрывающиеся и, возможно, идентичные мишени клеточного цикла.
В дополнение к той же самой конечной цели, контрольная точка S / M разделяет вышестоящие контрольные точки Rad белки с контрольной точкой повреждения ДНК G 2 [13,14]. Возможно, что все гены контрольной точки rad необходимы для обеих контрольных точек G 2 / M, потому что они воспринимают один и тот же первичный сигнал в обоих случаях, возможно, одноцепочечную ДНК.Против этой идеи выступают два наблюдения. Во-первых, ДНК-полимераза sp , по-видимому, специфически участвует в генерации сигнала S / M. Во-вторых, гомологи S. cerevisiae Rad1 sp , Rad9 sp и Rad17 sp не требуются для контрольной точки S / M S. cerevisiae . Альтернативно, было высказано предположение, что белки контрольной точки Rad образуют комплекс, который играет разные роли в двух контрольных точках, и что хотя разные субъединицы функционируют только в одной или другой контрольной точке, все они необходимы для целостности комплекса [14].Гипотеза подтверждается тем фактом, что существуют аллели rad1 sp и rad26 sp , которые нарушают только контрольную точку S / M [14,71,72 •], предполагая, что они играют разные роли в два контрольно-пропускных пункта.
Хотя контрольные белки Rad требуются как для S / M, так и для G 2 контрольных точек повреждения ДНК, они имеют разные нижестоящие эффекторы для разных сигналов контрольных точек. В частности, Chk1 sp не фосфорилируется в ответ на HU [31].Хотя это не обязательно означает, что Chk1 sp не активируется HU, Chk1 sp обычно не требуется для остановки, вызванной HU [14,30]. Вместо этого протеинкиназа Cds1 sp играет аналогичную роль в S / M checkpoint [73 ••, 74 ••, 75]. Cds1 sp является предполагаемым гомологом Rad53 sc , хотя у Cds1 sp отсутствует второй домен FHA, который необходим для функции контрольной точки метафазной ДНК Rad53 sc [75]. Это наблюдение может объяснить тот факт, что в то время как Rad53 sc действует в обеих контрольных точках, Cds1 sp специфичен для контрольной точки S / M.Если домены FHA участвуют в связывании регуляторных партнеров зависимым от фосфорилирования образом, одним из таких партнеров Cds1 sp может быть Rad26 sp . Rad26 sp взаимодействует с Cds1 in vivo , но не с in vitro [74]. Отсутствие взаимодействия in vitro с может указывать на непрямое взаимодействие или на необходимость фосфорилирования Rad26 sp . Cds1 sp фосфорилируется и активируется обработкой HU Rad-зависимым способом [73 ••, 74 ••].Более того, обработка HU заставляет Cds1 sp связывать Wee1 sp и связанный Cds1 sp может фосфорилировать Wee1 sp in vitro [73]. Тот факт, что контрольная точка S / M, по-видимому, также влияет на Cdc25 sp , предполагает, что Cdc25 sp также может быть целью Cds1 sp [69 •]. Делеция cds1 sp не вызывает явного дефекта контрольной точки, потому что в отсутствие Cds1 sp обработка HU приводит к фосфорилированию Chk1 sp и вызывает задержку клеток зависимым от Chk1 образом [73, 74 ••].Таким образом, роль Cds1 sp в предотвращении митоза в ответ на арест репликации маскируется способностью Chk1 sp замещать в его отсутствие. В отсутствие Chk1 sp , однако, Cds1 sp необходим для остановки клеток в ответ на HU, раскрывая его истинную роль в качестве киназы контрольной точки.
Существуют правдоподобные причины, по которым сигналы контрольных точек должны быть разделены на S-фазу и ответвления G 2 , даже если они затем повторно сходятся на тех же целях контрольной точки.Cds1 sp играет роль в сопротивлении HU, которая не зависит от его функции контрольной точки. В отсутствие Cds1 sp или любого из белков контрольной точки Rad клетки быстро теряют жизнеспособность, независимо от неспособности предотвратить митоз [13,75]. Считается, что эта потеря жизнеспособности отражает роль Cds1 sp , называемую его функцией восстановления, в стабилизации застопорившихся репликационных вилок. Кроме того, Cds1 sp необходим для замедления репликации, когда ДНК повреждается во время S фазы [74 ••, 76 •].Очевидно, что эти функции восстановления HU и повреждения ДНК в S фазе Cds1 sp не будут иметь никакого смысла во время G 2 . Напротив, Chk1 sp может играть роль в индукции репарации ДНК, и такая индукция в каждой S-фазе может быть вредной для эффективной репликации.
Chk1 sp необходим для длительной остановки клеточного цикла в HU при 37 ° C, близкой к максимальной температуре, при которой может расти S. pombe [77]. Учитывая зависимость ареста HU от Chk1 sp в отсутствие Cds1 sp , это наблюдение может указывать на то, что зависимая от Cds1 sp функция S / M-ареста не работает при 37 ° C.
Контрольная точка S / M репликации
S. cerevisiaeСигнал контрольной точки S / M в S. cerevisiae , по-видимому, посылается ДНК-полимеразой ε. Роль ДНК-полимеразы ε была выявлена мутациями, затрагивающими карбоксильный конец белка [78]. Эта область содержит мотив цинкового пальца, необходимый для каталитической активности, который может играть роль во взаимодействиях субъединиц. Кроме того, два других белка, RFC5 sc (малая субъединица RFC) и Dpb11 sc (гомолог Cut5 sp ) также необходимы для контрольной точки [79,80].Все три из этих белков выполняют важные функции в репликации, но в каждом случае было показано, что их роль в контрольной точке S / M не зависит от их роли в массовой репликации.
Как и в контрольной точке повреждения метафазной ДНК, Mec1 sc и Rad53 sc оба необходимы для передачи сигнала S / M [12]. Кинетический анализ ответа клеточного цикла мутантных клеток MEC1 sc или RAD53 sc еще предстоит провести, поэтому еще не известно, сохраняют ли эти клетки какой-либо ответ контрольной точки.Как контрольная точка S / M регулирует митоз, неясно. Pds1 sc не требуется, но клетки арестовываются короткими веретенами, указывая тем самым, что они блокируются при переходе от метафазы к анафазе [5,12]. Следовательно, должен существовать независимый механизм Pds1 sc для предотвращения анафазы. Поскольку разрушение Pds1 sc кажется достаточным для анафазы в отсутствие контрольной точки S / M, может быть активное ингибирование анафазы, индуцированное контрольной точкой, которое не играет роли в нормальном контроле митоза.
Сравнение с млекопитающими
В качестве модельных систем для изучения клеточного цикла, S. cerevisiae и S. pombe составляют хорошо подобранную пару. Комбинация S. cerevisiae , с ее контролем клеточного цикла в начале и в метафазе, и S. pombe с контролем клеточного цикла на G 2 / M, охватывает все основные контроли клеточного цикла, наблюдаемые в клетках млекопитающих. То же самое и с контролем на КПП. Все известные контрольные точки млекопитающих присутствуют в одном или обоих дрожжах, и механизмы этих контрольных точек, по-видимому, сохранены.Как и в случае с дрожжами, центральным игроком в контрольных точках млекопитающих является ДНК-PK-подобная протеинкиназа ATM. Первоначально ATM был клонирован как ген, мутировавший при атаксии телеангиэктазии, наследственном заболевании, которое включает предрасположенность к раку [22]. С тех пор было показано, что ATM участвует во многих контрольных точках повреждения ДНК млекопитающих [24]. Помимо ATM, были идентифицированы предполагаемые человеческие гомологи различных вышестоящих белков, включая hRad1, hRad9, hRad17 и hHus1 [16, 26, 81, 82]. Хотя роль этих белков в контроле контрольных точек еще не установлена, hRad1 и hRad17 взаимодействуют в двухгибридном анализе, намекая на то, что гомологи Rad человеческих контрольных точек могут функционировать согласованно [82].
Мишени клеточного цикла G 2 / M также, по-видимому, сохраняются у дрожжей и млекопитающих. Хороший пример этого — управление переходом G 2 → M. Как и в случае S. pombe , клетки млекопитающих регулируют фосфорилирование тирозина Cdc 2 для предотвращения вступления в митоз в присутствии поврежденной или нереплицированной ДНК [8, 9]. Человеческий гомолог Chk1 sp фосфорилируется в ответ на повреждение ДНК и может связываться и фосфорилировать человеческий Cdc25C in vitro [42, 83].Это фосфорилирование было картировано на Ser216, главный сайт межфазного фосфорилирования Cdc25C in vivo , и создает сайт связывания 14-3-3 [41, 42]. Эти результаты вдохновили модель, в которой повреждение ДНК приводит к фосфорилированию Cdc25C с помощью hChk1 на Ser216. Инактивация или секвестрация Cdc25C посредством связывания 14-3-3 затем будет задерживать клетки в G 2 , предотвращая дефосфорилирование тирозина Cdc2. Эта модель подтверждается тем фактом, что при экспрессии в культуре ткани Cdc25C S216A (в однобуквенном коде аминокислот) вызывает дефект как в S / M, так и в G 2 контрольных точках повреждения ДНК [42].Эти эффекты, однако, скромны, и кажется вероятным, что существуют другие уровни регуляции контрольных точек Cdc25 или других мишеней контрольных точек G 2 млекопитающих. В любом случае, большая часть контрольной точки повреждения ДНК S. pombe G 2 , по-видимому, сохраняется в клетках млекопитающих. Контрольная точка повреждения метафазной ДНК не была идентифицирована в клетках млекопитающих, но у них действительно есть контрольная точка метафазного веретена, которая, по-видимому, гомологична контрольной точке веретена S. cerevisiae [61,84,85].Более того, контрольная точка повреждения метафазной ДНК в клетках млекопитающих может объяснить, почему переопределение контрольной точки G 2 / M приводит к некоторым метафазным событиям, но не к аутентичному митозу [8, 9].
Заключение
Обширная информация о контрольно-пропускных пунктах G 2 / M в S. cerevisiae и S. pombe предлагает прекрасную возможность для сравнения и сопоставления. Сравнение двух дрожжей и позвоночных обнаруживает консервативные механизмы для инициирования и отправки сигналов контрольных точек.С некоторыми правдоподобными предположениями можно построить модель того, как этот механизм может работать. В центре всех контрольных точек, по-видимому, находится ДНК-ПК, подобная киназе [2,24]. Эти киназы, вероятно, связаны с разными регуляторными субъединицами, чтобы распознавать различные сигналы, генерируемые повреждением ДНК, арестом репликации и, возможно, другими, еще не идентифицированными сигналами. В S. pombe мы можем увидеть ситуацию, когда повреждение ДНК и субъединицы репликации слились во взаимозависимый комплекс.Основная функция ДНК-PK-подобной киназы, по-видимому, заключается в активации одной или нескольких нижестоящих киназ, которые снова могут связываться с регуляторными партнерами. Эти нижестоящие киназы являются хорошими кандидатами на выполнение основной сигнальной функции в контрольной точке. По крайней мере, в случае Rad53 sc и Cds1 sp кажется, что у них есть несколько независимых целей. Эта большая часть оборудования контрольно-пропускных пунктов, похоже, хорошо сохранена.
Из сравнения двух дрожжей и разных контрольных точек в двух дрожжах становится ясно, что консервативные сигналы контрольных точек могут иметь разные цели.Разница между целями контрольных точек повреждения ДНК G 2 / M — крайний, но полезный пример. Неважно, как задерживается разделение сестринских хроматид; какой бы механизм ни использовался во время нормального клеточного цикла, он станет хорошей контрольной точкой. Похожая ситуация наблюдается для мишени контрольной точки повреждения ДНК G 1 в S. cerevisiae и клетках млекопитающих [2,4], и мы можем ожидать обнаружения гибкости мишеней при других переходах клеточного цикла.В какой степени различия между контрольными точками у двух дрожжей отражают общую пластичность контрольных точек, еще предстоит увидеть. Этот пример — лишь один из многих интересных вопросов, на которые нужно ответить при работе с другими видами, вдохновленной работой, заложенной в дрожжах.
Благодарности
Мы хотели бы поблагодарить членов групп Скриппса по клеточному циклу, особенно Д. Кларка и К. Макгоуэна, за множество интересных дискуссий по этим темам. Мы также благодарны Т. Вайнерту за разрешение включить неопубликованные данные из его лаборатории.
Сокращения
| ATM | Атаксия телеангиэктазия мутировала |
| ATR | Связанный с ATM |
| BRCT | BRCA1 карбоксиконцевой мотив |
| ДНК-зависимый белок | k32 ДНК-PK|
| HU | гидроксимочевина |
| RFC | фактор репликации C |
Сноски
Примечание добавлено в доказательство
Данные, указанные как SJ Elledge, личное сообщение были опубликованы [88].
Список литературы и рекомендуемая литература
Документы, представляющие особый интерес, опубликованные в течение годового периода обзора, были выделены следующим образом:
• представляющие особый интерес
•• представляющие интерес
1. Elledge SJ. Контрольные точки клеточного цикла: предотвращение кризиса идентичности. Наука. 1996; 274: 1664–1672. [PubMed] [Google Scholar] 2. Вайнерт Т. Обновление контрольных точек повреждения ДНК: становится молекулярным. Curr Opin Genet Dev. 1998. 8: 185–193. [PubMed] [Google Scholar] 3. аль-Ходайри Ф, Карр АМ.Мутанты репарации ДНК, определяющие пути контрольных точек G 2 в Schizosaccharomyces pombe . EMBO J. 1992; 11: 1343–1350. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4. О’Коннор П.М. Контрольные точки фазы млекопитающих G 1 и G 2 . Cancer Surv. 1997. 29: 151–182. [PubMed] [Google Scholar] 5. Ямамото А., Гуаччи В., Кошланд Д. Pds1p, ингибитор анафазы у почкующихся дрожжей, играет критическую роль в пути (ах) APC и контрольных точек J Cell Biol. 1996. 133: 99–110. [Бесплатная статья PMC] [PubMed] [Google Scholar] 6.Ли Р., Мюррей А.В. Обратное управление митозом у почкующихся дрожжей. Клетка. 1991; 66: 519–531. [PubMed] [Google Scholar] 7. Rhind N, Furnari B, Russell P. Cdc 2 фосфорилирование тирозина требуется для контрольной точки повреждения ДНК у делящихся дрожжей. Genes Dev. 1997; 11: 504–511. [PubMed] [Google Scholar] Нетирозин-фосфорилируемый мутант Cdc2 sp Tyr15 → Phe не подлежит контролю через контрольную точку. Удаление Wee1 sp и Mik1 sp , киназ Cdc2 sp , в штамме wee1 sp -ts mik1 sp Δ, создает ситуацию, в которой уровень фосфорилирования тирозина Cdc2 sp зависит только от его скорости дефосфорилирования, процесса, катализируемого в основном Cdc25 sp .В такой ситуации повреждение ДНК снижает скорость дефосфорилирования Cdc2 sp , вовлекая дефосфорилирование Cdc2 sp с помощью Cdc25 sp в качестве контрольной точки. Бласина А, Пэгл Э.С., Макгоуэн СН. Роль ингибирующего фосфорилирования CDC 2 после блока репликации ДНК и радиационно-индуцированного повреждения в клетках человека. Mol Biol Cell. 1997; 8: 1013–1023. [Бесплатная статья PMC] [PubMed] [Google Scholar] Эта работа с использованием не фосфорилируемого тирозином мутанта Cdc2, вместе с [9], показывает, что фосфорилирование тирозина Cdc2 необходимо для предотвращения активации Cdc2-циклина B в ответ на повреждение ДНК. или остановка репликации в клетках HeLa.Недостаток фосфорилирования тирозина Cdc2, однако, недостаточен для индукции морфологически нормального митоза, указывая тем самым, что существуют другие уровни митотического контроля в клетках млекопитающих. Джин П, Гу И, Морган ДО. Роль ингибирующего фосфорилирования CDC 2 в радиационно-индуцированной остановке G 2 в клетках человека. J Cell Biol. 1996; 134: 963–970. [Бесплатная статья PMC] [PubMed] [Google Scholar] 11. Lim HH, Goh PY, Surana U. Разделение тела полюса веретена в Saccharomyces cerevisiae требует дефосфорилирования остатка тирозина 19 Cdc28.Mol Cell Biol. 1996. 16: 6385–6397. [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Вайнерт Т.А., Кисер Г.Л., Хартвелл Л.Х. Гены митотических контрольных точек у почкующихся дрожжей и зависимость митоза от репликации и репарации ДНК. Genes Dev. 1994; 8: 652–665. [PubMed] [Google Scholar] 13. Енох Т., Карр А.М., медсестра П. Гены делящихся дрожжей, участвующие в соединении митоза с завершением репликации ДНК. Genes Dev. 1992; 6: 2035–2046. [PubMed] [Google Scholar] 14. аль-Ходайри Ф., Фотоу Э., Шелдрик К.С., Гриффитс Д.Д., Леманн А.Р., Карр А.М.Идентификация и характеристика новых элементов, участвующих в контрольных точках и контроле обратной связи у делящихся дрожжей. Mol Biol Cell. 1994; 5: 147–160. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Long KE, Sunnerhagen P, Subramani S. Ген Schizosaccharomyces pombe rad1 состоит из трех экзонов, а последовательность кДНК частично гомологична кДНК Ustilago maydis REC1. Ген. 1994. 148: 155–159. [PubMed] [Google Scholar] 16. Паркер А.Е., Ван де Вейер I, Лаус М.С., Ооствин I, Йон Дж., Верхассельт П., Луйтен WHML.Человеческий гомолог гена контрольной точки Schizosaccharomyces pombe rad1 + кодирует экзонуклеазу. J Biol Chem. 1998; 273: 18332–18339. [PubMed] [Google Scholar] Rad1 человека кодирует экзонуклеазу bona fide с ферментативными характеристиками, аналогичными гомологичной экзонуклеазе Ustilago REC1. Он соответствует области человеческого генома, которая может содержать опухолевый супрессор. Гриффитс DJ, Барбет Северная Каролина, Маккриди С., Леманн А.Р., Карр А.М. Делящиеся дрожжи rad17: гомолог RAD24 почкующихся дрожжей, который разделяет области сходства последовательностей с дополнительными белками ДНК-полимеразы.EMBO J. 1995; 14: 5812–5823. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Lydall D, Weinert T. Гены контрольных точек дрожжей в обработке повреждений ДНК: последствия для восстановления и остановки. Наука. 1995; 270: 1488–1491. [PubMed] [Google Scholar] 19. Хартли К.О., Гелл Д., Смит Г.С., Чжан Х., Дивеча Н., Коннелли М.А., Адмон А., Лис-Миллер С.П., Андерсон К.В., Джексон С.П. Каталитическая субъединица ДНК-зависимой протеинкиназы: родственник фосфатидилинозитол-3-киназы и продукта гена атаксической телеангиэктазии. Клетка. 1995; 82: 849–856.[PubMed] [Google Scholar] 20. Bentley NJ, Holtzman DA, Flaggs G, Keegan KS, DeMaggio A, Ford JC, Hoekstra M, Carr AM. Ген контрольной точки Schizosaccharomyces pombe rad3. EMBO J. 1996; 15: 6641–6651. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Готтлиб TM, Джексон SP. ДНК-зависимая протеинкиназа: потребность в концах ДНК и ассоциация с Ku-антигеном. Клетка. 1993. 72: 131–142. [PubMed] [Google Scholar] 22. Савицкий К., Бар-Шира А., Гилад С., Ротман Г., Зив И., Ванагайте Л., Тагле Д.А., Смит С., Узиэль Т., Сфез С. и др.Один ген атаксии телеангиэктазии с продуктом, подобным киназе PI-3. Наука. 1995; 268: 1749–1753. [PubMed] [Google Scholar] 23. Wright JA, Keegan KS, Herendeen DR, Bentley NJ, Carr AM, Hoekstra MF, Concannon P. Мутанты протеинкиназы человеческого ATR повышают чувствительность к УФ и ионизирующему излучению и отменяют контроль контрольных точек клеточного цикла. Proc Natl Acad Sci USA. 1998; 95: 7445–7450. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Hoekstra MF. Ответы на повреждение ДНК и регуляция контрольных точек клеточного цикла семейством протеинкиназ ATM.Curr Opin Genet Dev. 1997. 7: 170–175. [PubMed] [Google Scholar] 25. Ларош Т., Мартин С.Г., Надо М., Горхэм ХК, Прайд Ф.Е., Луис Э.Дж., Гассер С.М. Мутация генов Ku дрожжей нарушает субядерную организацию теломер. Curr Biol. 1998. 8: 653–656. [PubMed] [Google Scholar] Гомологи Saccharomyces cerevisiae Ku не требуются для контроля контрольных точек. Kostrub CF, Knudsen K, Subramani S, Enoch T. Hus1p, консервативный белок контрольной точки делящихся дрожжей, взаимодействует с Rad1p и фосфорилируется в ответ на повреждение ДНК.EMBO J. 1998; 17: 2055–2066. [Бесплатная статья PMC] [PubMed] [Google Scholar] В делящихся дрожжах Hus1 sp связывается с Rad1 sp и, возможно, Rad9 sp . Hus1 sp фосфорилируется в зависимости от Rad3 sp . Представлена модель, в которой Hus1 sp , Rad1 sp и Rad9 sp образуют регуляторный комплекс, который рекрутирует Rad3 sp в участки повреждения ДНК. Сообщается о предполагаемых мышиных и человеческих гомологах Hus1 sp .27. Saka Y, Yanagida M. Делящиеся дрожжи cut5 +, необходимые для начала S-фазы и ограничения M-фазы, идентичны гену восстановления радиационных повреждений rad4 + Cell. 1993; 74: 383–393. [PubMed] [Google Scholar] 28. Saka Y, Fantes P, Sutani T, McInerny C, Creanor J, Yanagida M. Cut5 делящихся дрожжей связывает ядерный хроматин и регулятор фазы M в контроле контрольной точки репликации. EMBO J. 1994; 13: 5319–5329. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. McFarlane RJ, Carr AM, Price C. Характеристика фенотипов мутанта Schizosaccharomyces pombe rad4 / cut5: рассечение репликации ДНК и функция контроля контрольной точки G 2 .Mol Gen Genet. 1997; 255: 332–340. [PubMed] [Google Scholar] При полупроницаемой температуре клетки делящихся дрожжей с мутацией cut5 sp -ts могут реплицироваться, но не останавливаются в ответ на гидроксимочевину или гамма-облучение. Таким образом, роль контрольной точки Cut5 sp не зависит от его требований к репликации. В тех же условиях клетки действительно задерживаются в ответ на УФ-облучение. Walworth N, Davey S, Beach D. Протеинкиназа делящихся дрожжей chk1 связывает путь контрольной точки rad с cdc2 .Природа. 1993; 363: 368–371. [PubMed] [Google Scholar] 31. Walworth NC, Bernards R. rad -зависимый ответ кодируемой chk1 протеинкиназы в контрольной точке повреждения ДНК. Наука. 1996. 271: 353–356. [PubMed] [Google Scholar] 32. Уилсон Дж., Уилсон С., Уорр Н., Уоттс Ф.З. Выделение и характеристика гена Schizosaccharomyces pombe rhp9: гена, необходимого для контрольной точки повреждения ДНК, но не для контрольной точки репликации. Nucleic Acids Res. 1997; 25: 2138–2146.[Бесплатная статья PMC] [PubMed] [Google Scholar] См. Аннотацию к [33 ••] .33. Saka Y, Esashi F, Matsusaka T., Mochida S, Yanagida M. Контроль над повреждением и репликацией у делящихся дрожжей обеспечивается взаимодействием Crb2, белка с мотивом BRCT, с Cut5 и Chk1. Genes Dev. 1997; 11: 3387–3400. [Бесплатная статья PMC] [PubMed] [Google Scholar] В этой статье, наряду с [32 •], описывается клонирование crb2 sp , также известного как rhp9 sp . Подобно chk1 sp , crb2 sp требуется для контрольной точки повреждения ДНК G 2 , но не для контрольной точки S / M.Crb2 sp взаимодействует как с Cut5 sp , так и с Chk1 sp в двухгибридных анализах, хотя взаимодействия не наблюдались in vivo ,34. Борк П., Хофманн К., Бухер П., Нойвальд А.Ф., Альтшул С.Ф., Кунин Е.В. Суперсемейство консервативных доменов в белках контрольных точек клеточного цикла, чувствительных к повреждению ДНК. FASEB J. 1997; 11: 68–76. [PubMed] [Google Scholar] 35. Callebaut I, Mornon JP. От BRCA1 до RAP1: широко распространенный модуль BRCT, тесно связанный с репарацией ДНК. FEBS Lett. 1997; 400: 25–30.[PubMed] [Google Scholar] 36. Коулман Т.Р., Данфи РГ. Cdc2 регуляторные факторы. Curr Opin Cell Biol. 1994; 6: 877–882. [PubMed] [Google Scholar] 37. О’Коннелл MJ, Raleigh JM, Verkade HM, Nurse P. Chk1 — это киназа wee1 в контрольной точке повреждения ДНК G 2 , ингибирующая cdc2 путем фосфорилирования Y15. EMBO J. 1997; 16: 545–554. [Бесплатная статья PMC] [PubMed] [Google Scholar] Cdc2 sp Фосфорилирование тирозина поддерживается во время остановки, вызванной повреждением ДНК. Wee1 sp , киназа Cdc2 sp -Tyr15, фосфорилируется in vitro с помощью Chk1 sp .38. Фурнари Б., Райн Н., Рассел П. Митотический индуктор Cdc25, на который нацелена киназа контрольной точки повреждения ДНК Chk1. Наука. 1997; 277: 1495–1497. [PubMed] [Google Scholar] Генетический анализ показывает, что Cdc25 sp является мишенью для контрольной точки повреждения ДНК G 2 . Chk1 sp связывается с Cdc25 sp in vivo и фосфорилирует Cdc25 sp in vitro . 39. Aitken A. 14-3-3 и его возможная роль в координации множественных сигнальных путей. Trends Cell Biol.1996; 6: 341–347. [PubMed] [Google Scholar] 40. Конклин Д.С., Галактионов К., Бич Д. Белки 14-3-3 связываются с фосфатазами cdc25. Proc Natl Acad Sci USA. 1995; 92: 7892–7896. [Бесплатная статья PMC] [PubMed] [Google Scholar] 41. Кумагай А., Яковец П.С., Данфи WG. Белки 14-3-3 действуют как негативные регуляторы митотического индуктора Cdc25 в экстрактах яиц Xenopus . Mol Biol Cell. 1998. 9: 345–354. [Бесплатная статья PMC] [PubMed] [Google Scholar] Белки 14-3-3 связывают Cdc25 в рамках регулируемого клеточного цикла.Это связывание зависит от фосфорилирования Cdc25 Ser287. Мутация этого сайта активирует Cdc25 в экстрактах эмбрионов Xenopus , предполагая, что связывание 14-3-3 негативно регулирует Cdc25.42. Peng CY, Graves PR, Thoma RS, Wu Z, Shaw AS, Piwnica-Worms H. Mitotic и G 2 Контроль контрольной точки : регулирование связывания белка 14-3-3 путем фосфорилирования Cdc25C на серин-216. Наука. 1997; 277: 1501–1505. [PubMed] [Google Scholar] Cdc25C человека фосфорилируется по Ser216 in vivo , создавая сайт связывания 14-3-3.Этот сайт фосфорилируется белком делящихся дрожжей Chk1 sp in vitro . Мутация Ser216 вызывает небольшие дефекты в контрольных точках G 2 / M. См. Также [83 ••] .43. Ford JC, аль-Khodairy F, Fotou E, Sheldrick KS, Griffiths DJ, Carr AM. 14-3-3 белковых гомологов, необходимых для контрольной точки повреждения ДНК у делящихся дрожжей. Наука. 1994; 265: 533–535. [PubMed] [Google Scholar] 44. Вайнерт Т.А., Хартвелл Л.Х. Ген RAD9 контролирует реакцию клеточного цикла на повреждение ДНК в Saccharomyces cerevisiae .Наука. 1988; 241: 317–322. [PubMed] [Google Scholar] 45. Longhese MP, Paciotti V, Fraschini R, Zaccarini R, Plevani P, Lucchini G. Новый белок контрольной точки повреждения ДНК Ddc1p периодически фосфорилируется в течение клеточного цикла и в ответ на повреждение ДНК у почкующихся дрожжей. EMBO J. 1997; 16: 5216–5226. [Бесплатная статья PMC] [PubMed] [Google Scholar] DDC1 — новый член группы эпистаза RAD24 , необходимый для контрольных точек повреждения ДНК. Он фосфорилируется Mec3-зависимым образом в ответ на повреждение ДНК.46. де ла Торре-Руис, Массачусетс, Грин CM, Лаундес, Н. Ф. RAD9 и RAD24 определяют две аддитивные взаимодействующие ветви пути контрольной точки повреждения ДНК у почкующихся дрожжей, которые обычно необходимы для модификации и активации rad53. EMBO J. 1998; 17: 2687–2698. [Бесплатная статья PMC] [PubMed] [Google Scholar] Фенотипы контрольных точек различных мутантов могут быть подавлены сверхэкспрессией других генов контрольных точек. В этой работе представлен широкий спектр комбинаций мутант / избыточная экспрессия и подчеркивается аддитивный характер групп эпистаза RAD9 и RAD24 .47. Пачотти В., Луккини Дж., Плевани П., Лонгезе М.П. Mec1p необходим для фосфорилирования белка контрольной точки повреждения дрожжевой ДНК Ddc1p, который физически взаимодействует с Mec3p. EMBO J. 1998; 17: 4199–4209. [Бесплатная статья PMC] [PubMed] [Google Scholar] В почкующихся дрожжах Ddc1 sc связывается с Mec3 sc и, возможно, также с Rad17 sc . Ddc1 sc фосфорилируется в зависимости от группы Mec1 sc и Rad24 sc , но независимо от Rad9 sc .Напротив, Rad9 sc -зависимое фосфорилирование Pds1 sc не зависит от Ddc1 sc . Таким образом, Ddc1 sc (и, соответственно, другие члены группы Rad24 sc ) и Rad9 sc , по-видимому, играют разные роли в по крайней мере некоторых зависимых от Mec1 sc функций. Аллен Дж. Б., Чжоу З., Зиде В., Фридберг Е. С., Элледж С. Дж. Протеинкиназа SAD1 / RAD53 контролирует множественные контрольные точки и транскрипцию, вызванную повреждением ДНК у дрожжей. Genes Dev.1994; 8: 2401–2415. [PubMed] [Google Scholar] 49. Гринвелл П.В., Кронмал С.Л., Портер С.Е., Гассенхубер Дж., Обермайер Б., Питес Т.Д. TEL1, ген, участвующий в контроле длины теломер в S. cerevisiae , гомологичен гену атаксии-телеангиэктазии человека. Клетка. 1995; 82: 823–829. [PubMed] [Google Scholar] 50. Morrow DM, Tagle DA, Shiloh Y, Collins FS, Hieter P. TEL1, гомолог S. cerevisiae гена человека, мутировавший при телеангиэктазии атаксии, функционально родственен гену контрольной точки дрожжей MEC1.Клетка. 1995; 82: 831–840. [PubMed] [Google Scholar] 51. Эмили А. MEC1 -зависимое фосфорилирование Rad9p в ответ на повреждение ДНК. Mol Cell. 1998. 2: 183–189. [PubMed] [Google Scholar] Эта статья, вместе с [57 ••], показывает, что Rad9 фосфорилируется Mec1-зависимым образом, и что это фосфорилирование приводит к связыванию Rad53 in vivo ,52. Санчес И., Десани Б.А., Джонс В.Дж., Лю К., Ван Б., Элледж С.Дж. Регулирование RAD53 с помощью ATM-подобных киназ MEC1 и TEL1 в путях контрольных точек клеточного цикла дрожжей.Наука. 1996. 271: 357–360. [PubMed] [Google Scholar] 53. Хофманн К., Бухер П. Домен FHA: предполагаемый ядерный сигнальный домен, обнаруженный в протеинкиназах и факторах транскрипции. Trends Biochem Sci. 1995. 20: 347–349. [PubMed] [Google Scholar] 54. Zhou Z, Elledge SJ. DUN1 кодирует протеинкиназу, которая контролирует реакцию на повреждение ДНК у дрожжей. Клетка. 1993; 75: 1119–1127. [PubMed] [Google Scholar] 55. Пати Д., Келлер С., Гроудин М., Плон С.Е. Восстановление MEC1-независимой контрольной точки в дрожжах путем экспрессии новой кДНК вилочной головки человека .Mol Cell Biol. 1997; 17: 3037–3046. [Бесплатная статья PMC] [PubMed] [Google Scholar] 56. Сан Зи, Фэй Д.С., Марини Ф., Фойани М., Стерн Д.Ф. Spk1 / Rad53 регулируется с помощью Mec1-зависимого фосфорилирования белка в путях репликации ДНК и контрольных точек повреждения. Genes Dev. 1996. 10: 395–406. [PubMed] [Google Scholar] 57. Сунь З., Сяо Дж., Фэй Д.С., Стерн Д.Ф. Домен Rad53 FHA, связанный с фосфорилированным Rad9 в контрольной точке повреждения ДНК. Наука. 1998. 281: 272–274. [PubMed] [Google Scholar] См. Аннотацию к [51 •] .58. Коэн-Фикс О., Кошланд Д.Ингибитор анафазы Saccharomyces cerevisiae Pds1p является мишенью пути контрольной точки повреждения ДНК. Proc Natl Acad Sci USA. 1997; 94: 14361–14366. [Бесплатная статья PMC] [PubMed] [Google Scholar] Pds1 sc фосфорилируется после повреждения ДНК в зависимости от Rad9 sc , но независимо от Rad53 sc . Это предполагает, что сам Pds1 sc , а не часть механизма, который регулирует стабильность Pds1 sc , является мишенью для контрольной точки повреждения метафазной ДНК.59. Ямамото А., Гуаччи В., Кошланд Д. Pds1p требуется для точного выполнения анафазы в дрожжах, Saccharomyces cerevisiae . J Cell Biol. 1996. 133: 85–97. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Cohen-Fix O, Peters JM, Kirschner MW, Koshland D. Инициирование анафазы в Saccharomyces cerevisiae контролируется APC-зависимой деградацией ингибитора анафазы Pds1p. Genes Dev. 1996; 10: 3081–3093. [PubMed] [Google Scholar] 61. Li X, Cai M. Инактивация циклин-зависимой киназы Cdc28 отменяет остановку клеточного цикла, вызванную повреждением ДНК и разборкой митотических веретен в Saccharomyces cerevisiae .Mol Cell Biol. 1997; 17: 2723–2734. [Бесплатная статья PMC] [PubMed] [Google Scholar] 62. Миншалл Дж., Страйт А, Руднер А.Д., Дернбург А.Ф., Бельмонт А., Мюррей А.В. Протеиновая фосфатаза 2A регулирует активность MPF и сцепление сестринских хроматид у почкующихся дрожжей. Curr Biol. 1996; 6: 1609–1620. [PubMed] [Google Scholar] 63. Ян С.С., Йе Э., Лосось Э.Д., Блум К. Идентификация контрольной точки средней анафазы у почкующихся дрожжей. J Cell Biol. 1997. 136: 345–354. [Бесплатная статья PMC] [PubMed] [Google Scholar] Используя условную центромеру для создания дицентрических хромосом, авторы идентифицируют Rad9 sc зависимую контрольную точку средней анафазы, которая активируется растяжением или разрывом дицентрической хромосомы.Потребность в покадровой флуоресцентной микроскопии для анализа контрольной точки может помешать будущей работе. Но в той степени, в которой этого не происходит, этот контрольный пункт обещает выявить новые механизмы регуляции анафазы. Енох Т., Медсестра П. Мутация генов контроля клеточного цикла делящихся дрожжей устраняет зависимость митоза от репликации ДНК. Клетка. 1990; 60: 665–673. [PubMed] [Google Scholar] 65. Хамфри Т., Енох Т. Контроль митоза. Curr Biol. 1995; 5: 376–379. [PubMed] [Google Scholar] 66. Карр А.М., Муджу М., Бентли, штат Нью-Джерси, Хаган И.М.Путь chk1 необходим для предотвращения митоза после остановки клеточного цикла при «старте» Curr Biol. 1995; 5: 1179–1190. [PubMed] [Google Scholar] 67. D’Urso G, Grallert B, Nurse P. ДНК-полимераза альфа, компонент комплекса инициации репликации, важен для контрольной точки, связывающей S-фазу с митозом у делящихся дрожжей. J Cell Sci. 1995; 108: 3109–3118. [PubMed] [Google Scholar] 68. Д’Урсо Дж., Медсестра П. Schizosaccharomyces pombe cdc20 + кодирует ДНК-полимеразу эпсилон и требуется для хромосомной репликации, но не для контрольной точки S-фазы.Proc Natl Acad Sci USA. 1997; 94: 12491–12496. [Бесплатная статья PMC] [PubMed] [Google Scholar] Клетки с мутациями в cdc20 sp , гене, кодирующем ДНК-полимеразу ε, задерживаются в середине репликации, но не вступают в митоз. Кроме того, они прекращаются должным образом после воздействия гидроксимочевины. Rhind N, Russell P. Фосфорилирование тирозина cdc2 необходимо для контрольной точки репликации в Schizosaccharomyces pombe . Mol Cell Biol. 1998. 18: 3782–3787. [Бесплатная статья PMC] [PubMed] [Google Scholar] Используя эксперименты, аналогичные тем, что в [9], авторы показывают, что фосфорилирование тирозина Cdc2 sp необходимо для контрольной точки S / M.См. Другую интерпретацию этих событий в [70]. 70. Knudsen KE, Knudsen ES, Wang JY, Subramani S. p34 cdc2 Активность киназы сохраняется после активации контрольной точки репликации в Schizosaccharomyces pombe . Proc Natl Acad Sci USA. 1996; 93: 8278–8283. [Бесплатная статья PMC] [PubMed] [Google Scholar] 71. Кантер-Смолер Г., Кнудсен К.Э., Хименес Г., Саннерхаген П., Субрамани С. Разделение фенотипов в мутантных аллелях Schizosaccharomyces pombe гена контрольной точки клеточного цикла rad1 + Mol Biol Cell.1995; 6: 1793–1805. [Бесплатная статья PMC] [PubMed] [Google Scholar] 72. Uchiyama M, Galli I, Griffiths DJ, Wang TS. Новый мутантный аллель Schizosaccharomyces pombe rad26, неспособный контролировать прогрессирование S-фазы для предотвращения преждевременного митоза. Mol Cell Biol. 1997. 17: 3103–3115. [Бесплатная статья PMC] [PubMed] [Google Scholar] Авторы идентифицируют аллель Rad26 sp , который разрушает контрольную точку S-M, но не G 2 повреждения ДНК. Фенотип этого аллеля подавляется сверхэкспрессией Cdc1 sp .Сходный аллель Rad26 sp описан в [13] .73. Boddy MN, Furnari B, Mondesert O, Russell P. Контрольная точка репликации обеспечивается киназами Cds1 и Chk1. Наука. 1998. 280: 909–912. [PubMed] [Google Scholar] В этой статье описывается идентификация Cds1 sp как стимулируемой гидроксимочевиной киназы, которая связывается с Wee1 sp in vivo . Делящиеся дрожжи, которые представляют собой cds1 sp Δ chk1 sp 3 , двойные мутанты не задерживают гидроксимочевину, демонстрируя роль контрольной точки для Cds1 sp .74. Линдси HD, Гриффитс DJ, Эдвардс RJ, Кристенсен PU, Мюррей JM, Осман F, Уолворт N, Карр AM. S-фаза-специфическая активация киназы Cds1 определяет подпути ответа контрольной точки у Schizosaccharomyces pombe . Genes Dev. 1998. 12: 382–395. [Бесплатная статья PMC] [PubMed] [Google Scholar] Cds1 sp активируется гидроксимочевиной в зависимости от Rad. Это супрессор с высоким числом копий аллеля rad26 sp и связывается с Rad26 sp in vitro .Делеция cds1 sp вызывает фосфорилирование Chk1 sp в ответ на гидроксимочевину и делает арест гидроксимочевины зависимым от Chk1 sp . Авторы представляют иную интерпретацию этих результатов, чем в этом обзоре.75. Мураками Х., Окаяма Х. Киназа делящихся дрожжей, ответственная за блокирование митоза в S-фазе. Природа. 1995; 374: 817–819. [PubMed] [Google Scholar] 76. Ринд Н., Рассел П. Контрольная точка S-фазы Schizosaccharomyces pombe различает различные типы повреждений ДНК.Генетика. 1998; 149 1729-1237. [Бесплатная статья PMC] [PubMed] [Google Scholar] Эта статья, наряду с [74 ••], определяет роль Cds1 sp в замедлении скорости репликации в ответ на повреждение ДНК.77. Francesconi S, Grenon M, Bouvier D, Baldacci G. Протеинкиназа p56 (chk1) необходима для контрольной точки репликации ДНК при 37 ° C у делящихся дрожжей. EMBO J. 1997; 16: 1332–1341. [Бесплатная статья PMC] [PubMed] [Google Scholar] 78. Навас Т.А., Чжоу З., Элледж С.Дж. ДНК-полимераза-эпсилон связывает механизм репликации ДНК с контрольной точкой S-фазы.Клетка. 1995; 80: 29–39. [PubMed] [Google Scholar] 79. Araki H, Leem SH, Phongdara A, Sugino A. Dpb11, который взаимодействует с ДНК-полимеразой II (эпсилон) в Saccharomyces cerevisiae , играет двойную роль в прогрессии S-фазы и в контрольной точке клеточного цикла. Proc Natl Acad Sci USA. 1995; 92: 11791–11795. [Бесплатная статья PMC] [PubMed] [Google Scholar] 80. Сугимото К., Шимомура Т., Хашимото К., Араки Х., Сугино А., Мацумото К. Rfc5, небольшая субъединица комплекса фактора репликации C, объединяет репликацию ДНК и митоз в почкующихся дрожжах.Proc Natl Acad Sci USA. 1996; 93: 7048–7052. [Бесплатная статья PMC] [PubMed] [Google Scholar] 81. Либерман Х. Б., Хопкинс К. М., Насс М., Деметрик Д., Дэйви С. Человеческий гомолог гена контроля контрольной точки Schizosaccharomyces pombe rad9 +. Proc Natl Acad Sci USA. 1996; 93: 13890–13895. [Бесплатная статья PMC] [PubMed] [Google Scholar] 82. Паркер А.Е., Ван де Вейер И., Лаус М.С., Верхассельт П., Лютен В. Идентификация человеческого гомолога гена контрольной точки Schizosaccharomyces pombe rad17 (+).J Biol Chem. 1998; 273: 18340–18346. [PubMed] [Google Scholar] Rad17 человека взаимодействует с hRad1 в двухгибридном анализе.83. Санчес Й., Вонг С., Тома Р.С., Ричман Р., Ву З., Пивница-Вормс Х., Элледж С.Дж. Сохранение пути контрольной точки Chk1 у млекопитающих: связь повреждений ДНК с регуляцией Cdk через Cdc25. Наука. 1997; 277: 1497–1501. [PubMed] [Google Scholar] Chk1 человека фосфорилируется в ответ на повреждение ДНК. In vitro Chk1 связывается с hCdc25 и фосфорилирует его по Ser216. См. Также [42 ••].84. Li Y, Gorbea C, Mahaffey D, Rechsteiner M, Benezra R. MAD2 связывается с комплексом, стимулирующим циклосомы / анафазу, и ингибирует его активность. Proc Natl Acad Sci USA. 1997. 94: 12431–12436. [Бесплатная статья PMC] [PubMed] [Google Scholar] 85. Кэхилл Д. П., Ленгауэр С., Ю. Дж., Риггинс Г. Дж., Уилсон Дж. К., Марковиц С. Д., Кинзлер К. В., Фогельштейн Б. Мутации генов митотических контрольных точек при раке человека. Природа. 1998. 392: 300–303. [PubMed] [Google Scholar] 86. Schiestl RH, Reynolds P, Prakash S, Prakash L. Клонирование и анализ последовательности гена Saccharomyces cerevisiae RAD9 и дополнительные доказательства того, что его продукт необходим для остановки клеточного цикла, вызванной повреждением ДНК.Mol Cell Biol. 1989; 9: 1882–1896. [Бесплатная статья PMC] [PubMed] [Google Scholar] 87. Lydall D, Weinert T. Гены контрольной точки G2 / M Saccharomyces cerevisiae : дополнительные доказательства роли в репликации и / или репарации ДНК. Mol Gen Genet. 1997; 256: 638–651. [PubMed] [Google Scholar] 88. Densany BA, Alcasabas AA, Bachant JB, Elledge SJ. Восстановление после репликационного стресса ДНК является важной функцией пути контрольной точки S-фазы. Genes Dev. 1998; 12: 2956–2970. [Бесплатная статья PMC] [PubMed] [Google Scholar]Для активации контрольной точки повреждения ДНК требуется множественное фосфорилирование Rad9 с помощью CDK.
Cell Cycle.2012 окт 15; 11 (20): 3792–3800.
, 1 , 1 , 2 и 1 , 2 , 3 , *Гуолян Ван
1 Институт исследования рака Людвига; Калифорнийский университет в Сан-Диего; Ла-Хойя, Калифорния, США
Xiangyan Tong
1 Ludwig Institute for Cancer Research; Калифорнийский университет в Сан-Диего; Ла-Хойя, Калифорния, США
Стефани Венг
2 Аспирантура по биомедицинским наукам; Калифорнийский университет в Сан-Диего; Ла-Хойя, Калифорния, США
Хуэйлинь Чжоу
1 Институт исследования рака Людвига; Калифорнийский университет в Сан-Диего; Ла-Хойя, Калифорния, США
2 Программа для аспирантов в области биомедицинских наук; Калифорнийский университет в Сан-Диего; Ла-Хойя, Калифорния, США
3 Департамент клеточной и молекулярной медицины; Калифорнийский университет в Сан-Диего; Ла-Хойя, Калифорния, США
1 Институт рака Людвига; Калифорнийский университет в Сан-Диего; Ла-Хойя, Калифорния, США
2 Программа для аспирантов в области биомедицинских наук; Калифорнийский университет в Сан-Диего; Ла-Хойя, Калифорния, США
3 Департамент клеточной и молекулярной медицины; Калифорнийский университет в Сан-Диего; La Jolla, CA USA
Эта статья цитируется в других статьях в PMC.Abstract
Контрольная точка повреждения ДНК контролирует остановку клеточного цикла в ответ на повреждение ДНК, а активация этой контрольной точки, в свою очередь, регулируется клеточным циклом. Rad9, ортолог 53BP1 млекопитающих, необходим для этого ответа контрольной точки и фосфорилируется циклин-зависимой киназой (CDK) в дрожжах Saccharomyces cerevisiae . Предыдущие исследования показали, что консенсусные сайты CDK Rad9 важны для его активности контрольных точек. Однако точные CDK-сайты участвующих Rad9 не были определены.Здесь мы показываем, что консенсусные сайты CDK Rad9 функционируют параллельно с его доменом BRCT в направлении активации checkpoint, аналогично его ортологу Crb2 делящихся дрожжей. В отличие от Crb2, однако, мутация множественных, а не отдельных CDK сайтов Rad9 необходима для полного устранения его активности контрольной точки in vivo. Хотя Dpb11 взаимодействует с CDK-фосфорилированным Rad9, мы предоставляем доказательства, показывающие, что устранение этого взаимодействия не влияет на активацию контрольной точки повреждения ДНК in vivo, предполагая, что существуют дополнительные пути (пути).Взятые вместе, эти находки подтверждают, что регуляция Rad9 с помощью CDK и роль Dpb11 в активации контрольных точек повреждения ДНК являются более сложными, чем предполагалось ранее. Мы предполагаем, что множественное фосфорилирование Rad9 с помощью CDK может обеспечить более надежную систему, позволяющую Rad9 контролировать активацию контрольной точки повреждения ДНК, зависимой от клеточного цикла.
Ключевые слова: BRCT, CDK, Dpb11, Mec1, Rad53, Rad9
Введение
Контрольная точка повреждения ДНК играет эволюционно консервативную роль в контроле остановки клеточного цикла, вызванной повреждением ДНК. 1 — 3 RAD9 был первым геном контрольной точки повреждения ДНК, идентифицированным в дрожжах Saccharomyces cerevisiae , и было обнаружено, что он контролирует вызванную ионизирующим излучением остановку клеточного цикла G 2 / M. 4 Примечательно, что одинарного двухцепочечного разрыва ДНК (DSB) у дрожжей достаточно, чтобы активировать контрольную точку повреждения ДНК и вызвать остановку G 2 / M, 5 , но как клетки решают эти задачи, полностью не изучено. 53BP1, ортолог Rad9 млекопитающих, опосредует ATM-зависимый ответ на повреждение ДНК в клетках млекопитающих. 6 , 7 И Rad9, и 53BP1 широко фосфорилируются CDK. 8 — 11 Было обнаружено, что мутация 18 сайтов SP / TP, то есть консенсусного мотива фосфорилирования CDK, Rad9 вызывает дефект в индуцированном повреждением ДНК фосфорилировании Rad53, что является признаком активации контрольной точки повреждения ДНК. 12 С другой стороны, мутация Rad9 в Ser-11, сайт фосфорилирования CDK, как было показано, действует синергетически с мутациями метилирования гистонов, снижая ассоциацию Rad9 с хроматином. 13 Совсем недавно было обнаружено, что Dpb11 взаимодействует с CDK-фосфорилированным Rad9 через его N-концевые домены BRCT и две стадии фосфорилирования CDK Rad9, то есть S462 и T474. 14 Однако отсутствуют адекватные доказательства in vivo для функций checkpoint Dpb11 и сайтов фосфорилирования CDK Rad9, участвующих в связывании Dpb11. Точные сайты CDK Rad9, которые ответственны за активацию контрольной точки повреждения ДНК, остаются неопределенными. Исследования Crb2, ортолога Rad9 у делящихся дрожжей, подтвердили, что его C-концевые Tudor и BRCT домены способствуют его рекрутированию на сайт повреждения ДНК посредством модификаций гистонов. 15 — 17 Интересно, что фосфорилирование Thr-215, сайта фосфорилирования CDK Crb2, действует синергетически с его доменом BRCT, чтобы контролировать активацию Chk1, ортолога делящихся дрожжей Rad53, что предполагает избыточную роль между ними. . 16 , 18 Аналогичным образом Cut5, ортолог делящихся дрожжей Dpb11, также взаимодействует с Crb2, 19 , 20 , хотя биохимическая основа этого взаимодействия не исследовалась.В свете этих исследований кажется, что Dpb11 / Cut5 может иметь решающее значение в распознавании фосфорилированного CDK Rad9 / Crb2, чтобы опосредовать активацию контрольной точки повреждения ДНК. Для дальнейшего изучения лежащего в основе механизма мы искали доказательства in vivo роли Dpb11 и CDK фосфорилирования Rad9 в активации контрольной точки повреждения ДНК.
Результаты
Взаимодействие между Dpb11 и Rad9 не требуется для активации Rad53 в фазе G
2 / MМы сначала подтвердили взаимодействие между N-концевыми доменами BRCT Dpb11 и Rad9, как сообщалось ранее (). 13 , 14 Далее, мутация консервативного остатка K55 в первом домене BRCT Dpb11 отменяет его связывание с эндогенным Rad9–3HA, происходящим из G 2 / M клеток с задержкой фазы (). Та же мутация K55E в Dpb11 также устраняет связывание между полноразмерным Dpb11 и Rad9 (). Таким образом, Dpb11 взаимодействует с Rad9 через свои N-концевые домены BRCT, как сообщалось ранее. 14 Мы обнаружили, что та же мутация K55E в Dpb11 также устраняет ее взаимодействие с фосфопептидом, который содержит фосфорилированный Thr-600 из Sld3, что указывает на то, что K55 является критическим остатком, участвующим в распознавании фосфора Dpb11 ().Затем мы исследовали, необходимо ли взаимодействие между Rad9 и Dpb11 для активации контрольной точки повреждения ДНК in vivo. Поскольку Dpb11 необходим для жизнеспособности клеток, который взаимодействует с Sld3 во время репликации ДНК, 21 мы сконструировали слитый мутант SLD3-dpb11 путем слияния dpb11-K55E с эндогенным SLD3 и затем удаления DPB11 из его хромосомы
. локус. Как сообщалось ранее, 21 это слияние Dpb11 с Sld3 обходит важную функцию N-концевых доменов BRCT Dpb11, что позволяет нам исследовать его роль вне репликации ДНК.Затем мы проанализировали индуцированное повреждением ДНК фосфорилирование Rad9 и Rad53, используя их сдвиги подвижности геля, которые являются отличительным признаком активации контрольной точки повреждения ДНК. 22 , 23 Неожиданно, Rad9 и Rad53 все еще гиперфосфорилированы в мутанте SLD3-dpb11-K55E dpb11 Δ, подобно клеткам WT после обработки флеомицином, что вызывает DSB в ДНК (). Чтобы более тщательно проверить роль N-концевых доменов BRCT Dpb11, мы также создали мутант SLD3-dpb11- Δ Ν , в котором укороченный N-концевой Dpb11 (253–764) слит с SLD3. с одновременной делецией эндогенного DPB11 .Еще раз, имеется небольшой дефект в индуцированном флеомицином фосфорилировании Rad9 и Rad53 в этом мутанте SLD3-dpb11 Δ N (). В обоих случаях дополнительная мутация K1088E в домене Rad9 BRCT вызывает небольшой синергетический эффект в сочетании с мутациями dpb11 . Чтобы спросить, может ли мутант SLD3-dpb11 Δ N обойти необходимость в Rad9 для активации контрольной точки повреждения ДНК, мы исследовали эффект rad9 Δ.Как показано на фиг. SLD3-dpb11 Δ N rad9 Δ не может активировать контрольную точку в присутствии флеомицина во время фазы G 2 / M. Следовательно, несмотря на то, что Rad9 специфически связывается с Dpb11 через свои N-концевые домены BRCT, устранение этого взаимодействия вызывает небольшой эффект на Rad9-зависимую активацию контрольной точки в фазе G 2 / M.Рисунок 1. Взаимодействие между Rad9 и N-концевыми доменами BRCT Dpb11 необязательно для активации контрольной точки повреждения ДНК.(A) Рекомбинантный GST-Dpb11 (1-260) (WT или K55E) был связан с гранулами глутатиона и использовался для связывания с Rad9-3HA в клеточных лизатах, полученных из G 2 / M-арестованных клеток. Связанный белок выявляли с помощью антитела против НА. (B) Влияние мутации K55E полноразмерного Dpb11-TAP на его связывание с эндогенным Rad9–3HA из G 2 / M-арестованных клеток. Тег TAP состоит из тега 6xHIS-3xFLAG-Protein-A. 24 Dpb11-TAP сначала связывали с гранулами IgG, а затем использовали для связывания с Rad9. (C) Биотинилированный на N-конце пептид Sld3, соответствующий аминокислотам 588-612 (RVDSEENVQVQAT 600 PAVKKRTVTPNK) с нефосфорилированным или фосфорилированным остатком Т600, иммобилизовали на гранулах страптавидина и использовали для удаления рекомбинантного GST-1–26011 ) фрагменты (WT или мутант K55E).Связанные белки выявляли окрашиванием кумасси синим. (D) Вестерн-блот анализ сдвига подвижности гелей Rad9–3HA и Rad53 в клетках G 2 / M-арестованных WT, SLD3-dpb11- Δ N и SLD3-dpb11-K55E клеток с или без rad9 -K1088E . Клетки обрабатывали флеомицином или без него. Окрашивание по Понсо использовали в качестве контроля загрузки. SLD3-dpb11- Δ N имеет усеченный на N-конце Dpb11 (аминокислоты 253–764). (E) вестерн-блоттинг сдвига подвижности геля Rad53 в G 2 / M-арестованный WT, rad9 Δ, SLD3-dpb11- Δ N и SLD3-dpb11- Δ N rad9 Δ клетки с обработкой флеомицином или без нее.
N-концевые консенсусные сайты CDK Rad9 участвуют в активации контрольной точки
Rad9 содержит C-концевые домены Tudor и BRCT, кластер сайтов TQ, которые фосфорилируются Mec1 и Tel1 22 и 20 сайтов SP / TP, которые являются цели CDK (). Предыдущие исследования идентифицировали S462 и T474 Rad9, которые участвуют в связывании с Dpb11; 14 однако, отсутствует значительный дефект контрольной точки, когда эти остатки Ser / Thr мутируют в Ala. Для дальнейшего понимания взаимодействия между Dpb11 и Rad9 и, что более важно, того, как CDK-фосфорилирование Rad9 контролирует его функцию контрольной точки, мы представили ряд мутаций Ser / Thr-to-Ala для устранения различных сайтов CDK Rad9 в его хромосомном локусе ().Во-первых, мы исследовали роль N-концевых 11 сайтов SP / TP Rad9. Как показано на фиг. 9, ни rad9–10AP , ни rad9–11AP не обнаруживают заметного дефекта в индуцированном флеомицином фосфорилировании Rad53 и Rad9 в фазе G 2 / M. Однако имеется небольшое, но заметное снижение индуцированного флеомицином фосфорилирования Rad9 и Rad53 в мутанте rad9-11AP, K1088E , указывая на синергетическую роль между фосфорилированием CDK и BRCT доменом Rad9. Этот синергетический эффект неудивителен, учитывая, что CDK-фосфорилирование Crb2 у делящихся дрожжей также действует синергетически с его CDK-фосфорилированием T215. 15 , 16 , 18 Поскольку Rad9 и Mrc1 функционируют избыточно, чтобы контролировать активацию Rad53 во время клеточного цикла, 24 — 26 Затем мы проанализировали эти мутанты rad9 в . mrc1 Δ sml1 Δ фон. Как и ожидалось, мутант mrc1 Δ rad9 Δ является сверхчувствительным к генотоксическим агентам, включая всего 2 мМ гидроксимочевины (HU) (). Среди проанализированных мутантов rad9 только мутант rad9–11AP, K1088E mrc1 Δ демонстрирует чувствительность, сравнимую с таковой для mrc1 Δ rad9 Δ (), что указывает на дефектную контрольную точку повреждения ДНК.В соответствии с этим представлением, индуцированное флеомицином фосфорилирование Rad9 и Rad53 в асинхронных клетках значительно нарушено у мутанта rad9-11AP, K1088E mrc1 Δ, тогда как оно гораздо меньше затронуто у мутанта rad9-10AP, K1088E mrc1 Δ ( ).
Рисунок 2. N-концевые сайты SP / TP Rad9 участвуют в активации контрольной точки повреждения ДНК. (A) Схема структуры домена Rad9 и консенсусных сайтов фосфорилирования CDK (серые столбцы). (B) Сводка сайтов фосфорилирования Rad9 SP / TP, которые мутированы, как указано в каждом мутанте rad9-AP .Положения остатков Ser / Thr указаны справа от них. Скобки указывают на фосфорилирование, не обнаруженное МС. 8 «+» указывает на мутации Ser / Thr-to-Ala. «-» означает отсутствие мутации. Анализы сдвига подвижности геля Rad9-3HA и Rad53 проводили в G2 / M-арестованных клетках, как указано в (C и F). Анализы чувствительности планшетов к MMS, флеомицину (Phleo) и HU с WT, mrc1 Δ, rad9 и различными двойными мутантами mrc1 Δ rad9 были выполнены в (D и G).Анализы сдвига подвижности геля проводили с использованием асинхронных клеток, сравнивая WT и различные двойные мутанты mrc1 Δ rad9 , как указано в (E и H).
Учитывая, что один сайт фосфорилирования CDK, то есть T215, Crb2 участвует в его контрольной активности, 15 , 16 , 18 , мы спросили, есть ли это различие между rad9–10AP и rad9-11AP мутанты специфически приписываются T348 Rad9.Как показано на фиг.4, одиночный мутант rad9-T348A не имеет значительного дефекта в активации Rad53 в сочетании с rad9-K1088E , mrc1 Δ или обоими. Интересно, что мутация rad9-T348A действительно вызывает повышенную чувствительность к метилметансульфонату (MMS), когда он сочетается с mrc1 Δ и / или rad9-K1088E , что указывает на то, что T348 Rad9 играет неопределенную роль в Ответ на повреждение ДНК (). Взятые вместе, эти результаты показывают, что N-концевые сайты SP / TP Rad9 действуют избыточно, чтобы регулировать его активность контрольных точек.
C-концевые CDK консенсусные сайты Rad9 также действуют избыточно, чтобы контролировать активацию контрольных точек
Затем мы исследовали, регулируют ли C-концевые шесть SP / TP сайтов Rad9 его функцию контрольных точек (). Мутация всех шести сайтов SP / TP Rad9 нарушает, но не устраняет индуцированное флеомицином фосфорилирование Rad9 и Rad53 в фазе G 2 / M (). Интересно, что мутант rad9–6AP, K1088E почти полностью дефектен в индуцированном флеомицином фосфорилировании Rad53 и Rad9 в фазе G 2 / M (), указывая на потерю активности контрольных точек.В соответствии с этим представлением, мутант rad9–6AP, K1088E mrc1 Δ является гиперчувствительным к различным генотоксическим агентам, как и мутант rad9 Δ mrc1 Δ, тогда как rad9–6AP mrc1 Δ или
8E mrc1 Δ или
8E mrc1 Δ показывает лишь умеренную чувствительность (). Более того, индуцированное флеомицином фосфорилирование Rad53 в асинхронных клетках значительно снижено, но не элиминировано в мутанте rad9-6AP, K1088E mrc1 Δ (), хотя фосфорилирование Rad9 снижено в меньшей степени.Дальнейший мутагенез Rad9 показывает, что ни rad9–2AP-1 , ни rad9–2AP-2 не имеют дефекта в индуцированном флеомицином фосфорилировании Rad53 и Rad9, независимо от мутации rad9-K1088E (). Мутант rad9–2AP-1 содержит такие же мутации S462 и T474 Rad9, как сообщалось ранее. 14 Интересно, что мутант rad9–3AP, K1088E действительно обнаруживает небольшое снижение индуцированного флеомицином фосфорилирования Rad53, хотя и в меньшей степени по сравнению с rad9–6AP, K1088E ().Кроме того, ни rad9–2AP-1 , ни rad9–2AP-2 не показывают повышенной чувствительности в сочетании с rad9-K1088E и mrc1 Δ (). Напротив, мутант rad9–3AP, K1088E mrc1 Δ показывает немного более высокую чувствительность к MMS, хотя и меньше, чем у rad9 Δ mrc1 Δ и rad9–6AP, K1088E mrc1 Δ. Флеомицин-индуцированное фосфорилирование Rad9 и Rad53 в асинхронных клетках практически не затрагивается у мутантов rad9–2AP-1 и rad9–2AP-2 ; однако он умеренно снижен у мутанта rad9–3AP, K1088E mrc1 Δ ().Взятые вместе, несколько сайтов SP / TP в этой области Rad9 также участвуют в регуляции его активности контрольных точек.
Рисунок 3. C-концевые сайты SP / TP Rad9 также участвуют в активации контрольной точки повреждения ДНК. Анализ сдвига подвижности геля Rad9-3HA и Rad53 проводили с использованием G 2 / M-арестованных клеток, как указано в (A и D), и асинхронных клеток, как указано в (C и F). Анализ чувствительности планшета WT, mrc1 Δ, rad9 и различных двойных мутантов mrc1 Δ rad9 проводили в (B и E).
N-концевой и C-концевой консенсусные сайты CDK Rad9 могут функционировать вместе для управления активацией контрольной точки
Приведенные выше результаты демонстрируют, что сайты CDK в двух разных регионах Rad9 участвуют в активации контрольной точки, что повышает вероятность того, что они также могут работать с резервированием. Чтобы проверить это, мы создали мутант rad9-8AP , который сочетает частичные мутации в сайтах SP / TP в обеих областях (). Как показано на фиг. 5, индуцированное флеомицином фосфорилирование Rad9 и Rad53 в значительной степени элиминируется у мутанта rad9-8AP, K1088E , но не у мутанта rad9-8AP .Более того, мутант rad9–8AP, K1088E mrc1 Δ является гиперчувствительным к различным генотоксическим агентам, подобно mrc1 Δ rad9 Δ (). Флеомицин-индуцированное фосфорилирование Rad53 в асинхронных клетках также в основном элиминируется у мутанта rad9-8AP, K1088E mrc1 Δ (), что согласуется с потерей активности контрольных точек Rad9. Поскольку известно, что Rad9 контролирует и индуцирует остановку клеточного цикла в ответ на повреждение ДНК, 4 затем мы исследовали фенотипы ядерного деления различных мутантов rad9 после временной обработки флеомицином.Как показано на фиг.3, процентное содержание двухъядерных клеток неразличимо между WT и различными мутантами rad9 без обработки флеомицином. Однако после временной обработки флеомицином клетки дикого типа демонстрируют сильную задержку образования двухъядерных клеток, тогда как rad9 Δ клетки демонстрируют минимальную такую задержку, как и ожидалось. Обе клетки rad9–8AP, K1088E и rad9–8AP показывают небольшую задержку, такую как rad9 Δ, в то время как клетки rad9-K1088E демонстрируют более сильную задержку, подобную клеткам WT.Удаление RAD9 и MRC1 является летальным, 24 , 27 , которое подавляется удалением SML1 . Удаление SML1 также подавляет летальность rad53 Δ и mec1 Δ. 28 Этот профиль генетического взаимодействия обеспечивает полезный тест способности Rad9 активировать Rad53. Анализ тетрадной диссекции показал, что ни rad9–8AP , ни rad9-K1088E не являются летальными на фоне mrc1 Δ ().Интересно, что rad9–8AP, K1088E является синтетически летальным с mrc1 Δ, которое спасает sml1 Δ. В совокупности эти находки показывают, что способность Rad9 способствовать активации Rad53 по существу устраняется у мутантов rad9-8AP, K1088E .
Рис. 4. N-концевых и C-концевых SP / TP сайтов Rad9 действуют избыточно, чтобы контролировать активацию контрольной точки повреждения ДНК. Анализы сдвига подвижности геля для Rad9–3HA и Rad53 проводили с использованием G 2 / M-арестованных клеток и асинхронных клеток, как указано в (A и C), соответственно.(B) Анализ чувствительности планшета WT, mrc1 Δ, rad9 Δ и различных двойных мутантов mrc1 Δ rad9 . (D) Процентное содержание двухъядерных клеток после высвобождения после обработки флеомицином в фазе G 2 / M при сравнении WT, rad9 Δ, rad9–8AP , rad9-K1088E и rad9–8AP, K1088E мутантов. (E) Тетрадный анализ генетических взаимодействий между различными мутантами rad9 , mrc1 Δ и sml1 Δ.Синтетическая летальность между mrc1 Δ и либо rad9 Δ, либо rad9–8AP, K1088E спасает sml1 Δ. Не было обнаружено синтетической летальности между mrc1 Δ и rad9–8AP или rad9-K1088E . Типичные тетрады показаны здесь для простоты. Немаркированные споры содержат RAD9 MRC1 SML1 .
Множественные сайты CDK Rad9 опосредуют его взаимодействие с Dpb11
Предыдущие исследования показали, что Rad9 взаимодействует с Dpb11 через Ser-11, Ser-462 и Thr-474. 13 , 14 Поскольку мутация этих остатков Rad9 не устраняет его способность опосредовать активацию Rad53, мы решили дополнительно изучить взаимодействие между Dpb11 и Rad9. Поскольку Dpb11 связывается с Rad9 только через свои N-концевые домены BRCT (), мы использовали анализ Dpb11 BRCT-pull-down для изучения его взаимодействия с эндогенным Rad9 в различных мутантных фонах rad9 . Как показано, в то время как Rad9–10AP сохраняет более слабое взаимодействие с Dpb11, и Rad9–11AP, и Rad9–8AP неспособны демонстрировать существенное связывание с Dpb11.Одиночная мутация Rad9 T348A или S462A мало влияет на это взаимодействие. Мы также исследовали влияние мутации на консенсусные сайты C-концевых CDK Rad9. Как показано на фиг. 5, мутации двух или трех сайтов SP / TP Rad9 вызывают только постепенное снижение их взаимодействий с Dpb11, потеря связывания с Dpb11 наблюдается только для Rad9-6AP. Это наблюдение убедительно указывает на то, что множественные CDK консенсусные сайты Rad9 обеспечивают его взаимодействие с Dpb11.
Рисунок 5. Множественные консенсусные сайты CDK Rad9 участвуют в связывании с Dpb11. GST-Dpb11 (1-260) использовали для удаления WT Rad9-3HA и различных мутантных белков Rad9-AP в (A и B), как описано в. В реакциях связывания использовалось в 2,5 раза больше клеточных лизатов rad9–6AP , rad9–8AP , rad9–10AP или rad9–11AP , чтобы компенсировать снижение интенсивности их полос. GST-Dpb11 (1-260) был обнаружен окрашиванием по Понсо.
Обсуждение
Rad9 играет критическую роль в активации контрольной точки повреждения ДНК у дрожжей, особенно во время фазы G 2 / M, когда активность CDK высока. 4 , 5 Предыдущие исследования показали, что одного DSB ДНК в дрожжах достаточно для активации контрольной точки повреждения ДНК Rad9-зависимым образом, 3 указывает на высокочувствительную систему передачи сигнала. Ключевой вопрос заключается в том, как Rad9 обеспечивает эту надежную и чувствительную активацию контрольной точки. Rad9 и его ортологи являются известными целями CDK, и они содержат несколько консенсусных сайтов CDK. 8 — 11 Наблюдения, что CDK-фосфорилированный Rad9 взаимодействует с Dpb11 и Dpb11 может активировать Mec1, привели к модели, согласно которой Dpb11 может быть критическим регулятором Rad9. 14 Однако in vivo доказательства такой роли Dpb11 отсутствуют. Кроме того, мутация сайтов SP / TP Rad9, участвующих в связывании с Dpb11, не может вызвать сильный дефект в активации Rad53, 14 поднимает вопрос о том, как задействовано фосфорилирование CDK Rad9. Здесь мы представляем несколько линий доказательств, которые предполагают, что множественное фосфорилирование Rad9 с помощью CDK отвечает за его способность контролировать активацию контрольной точки повреждения ДНК. Здесь были сделаны и резюмированы несколько новых наблюдений.
Во-первых, несмотря на то, что Dpb11 взаимодействует с Rad9 через свои N-концевые домены BRCT, 13 , 14 устранение этого взаимодействия Rad9-Dpb11 не вызывает каких-либо заметных дефектов в индуцированном повреждением ДНК фосфорилировании Rad9 и Rad53 ( ). Одним из объяснений этого удивительного открытия является то, что могут существовать альтернативные пути (пути), опосредующие функцию CDK-фосфорилированного Rad9, которые еще предстоит идентифицировать в дальнейших исследованиях. Наше наблюдение также не исключает, что Dpb11 может регулировать активацию контрольной точки повреждения ДНК с помощью альтернативного механизма (ов).Например, могут быть задействованы C-концевые домены BRCT Dpb11, учитывая его взаимодействие с комплексом Mec3-Rad17-Ddc1. 29 — 31 Поскольку Rad9 специфически взаимодействует с N-концевыми доменами BRCT Dpb11 (), 14 Dpb11 не может быть единственным белком, который распознает CDK-фосфорилированный Rad9, независимо от его других ролей.
Во-вторых, предыдущие исследования специфичности связывания доменов Dpb11 BRCT показали, что они связываются с CDK-фосфорилированными Sld2 и Sld3 высокоспецифичным образом. 21 , 32 Действительно, фосфопептид Sld3, содержащий фосфорилированный T600 Sld3, демонстрирует устойчивое связывание с N-концевыми доменами BRCT Dpb11 (). 33 Наш анализ связывания между Rad9 и теми же доменами BRCT Dpb11 обнаруживает совершенно другой способ взаимодействия, несмотря на то, что Rad9 также специфически связывается с Dpb11 (). 14 Используя тот же анализ фосфопептида, мы не смогли обнаружить какого-либо заметного связывания между любым отдельным фосфопептидом Rad9, который содержит каждый из фосфорилированных сайтов SP / TP, с N-концевыми доменами BRCT Dpb11 (результаты не показаны ).Это побудило нас вместо этого изучить связывание между доменами Dpb11 BRCT и эндогенным Rad9.
Как показано на, мы наблюдали сложный профиль взаимодействия между Dpb11 и Rad9. Мутация первых 10 сайтов SP / TP Rad9 значительно снижает это взаимодействие. Несмотря на дальнейшее снижение этого взаимодействия, наблюдаемое для Rad9-11AP, мутация только T348 оказывает относительно небольшое влияние на это взаимодействие. С другой стороны, мутация шести C-концевых сайтов SP / TP Rad9 полностью устраняет его связывание с Dpb11, предполагая, что эти остатки Rad9 играют важную роль.Еще раз, мутация S462 и T474 Rad9 частично снижает его взаимодействие с Dpb11, предполагая, что эти остатки частично участвуют в их связывании с Dpb11. 14 Эти наблюдения поднимают вопрос, существует ли какая-либо специфичность последовательности N-концевых доменов BRCT Dpb11 в отношении связывания с Rad9. Мы полагаем, что Rad9 и Sld3 представляют два типа лигандов, которые не обязательно противоречат друг другу. В то время как Sld3 имеет один сайт связывания с высокой аффинностью для Dpb11, Rad9, по-видимому, имеет несколько сайтов связывания с более низким сродством для взаимодействия с Dpb11.Также существует частичная специфичность последовательности среди сайтов фосфорилирования CDK Rad9 для связывания Dpb11. Например, T348, S462 и T474 Rad9, по-видимому, имеют относительно более сильную роль, чем другие. Мы подчеркиваем здесь, что одним из возможных предупреждений является то, что мутация субнабора SP / TP сайтов Rad9 может приводить к непреднамеренным эффектам на фосфорилирование других SP / TP сайтов Rad9. Более того, мы не можем исключить возможность того, что остаточное связывание между Rad9 и Dpb11 может существовать для некоторых белков Rad9-AP, что ниже предела обнаружения используемого здесь анализа связывания.Тем не менее, наши результаты согласуются с представлением о том, что несколько сайтов CDK, а не один или два сайта Rad9 опосредуют его взаимодействие с Dpb11, чтобы гарантировать специфическое межбелковое взаимодействие.
В-третьих, в соответствии с тем, что не все сайты SP / TP Rad9 имеют эквивалентные роли, наш анализ мутантных фенотипов rad9 показал, что они обнаруживают различные степени дефектов контрольных точек. Напр., Шесть C-концевых сайтов SP / TP Rad9, по-видимому, играют более сильную роль, чем его 11 N-концевых сайтов SP / TP в отношении активации Rad53 в фазе G 2 / M (сравнивая и).С другой стороны, частичная активация Rad53 в асинхронных клетках все еще обнаруживается либо у rad9-11AP, K1088E mrc1 Δ, либо у мутантов rad9-6AP, K1088E mrc1 Δ (и). Мы также обнаружили, что сайты CDK в этих двух регионах Rad9 могут функционировать избыточно. Мутант rad9-8AP содержит частичные мутации в сайтах SP / TP в обеих областях Rad9. Мы наблюдали почти полную неспособность rad9–8AP активировать Rad53 в сочетании с rad9-K1088E и mrc1 Δ.Синергетический дефект активации контрольной точки, когда мутации rad9-AP комбинируются с мутацией K1088E в домене BRCT Rad9, также предполагает, что дефекты контрольной точки этих мутантов rad9-AP менее вероятны из-за дефекта стабильности белка. вызванные мутациями в этих консенсусных сайтах CDK Rad9. Вместо этого фосфорилирование CDK и домен BRCT Rad9 действуют избыточно, чтобы контролировать его активность контрольной точки повреждения ДНК, что напоминает наблюдения Crb2 у делящихся дрожжей, 15 , 16 , 18 , хотя Ситуация с регуляцией фосфорилирования CDK Rad9 оказывается гораздо более сложной.
Наконец, учитывая, что Rad9 и его эукариотические ортологи неизменно имеют большое количество сайтов SP / TP, на которые нацелены CDK, механизм, обнаруженный в дрожжах Saccharomyces cerevisiae , может сохраняться и у других эукариот. За счет использования поливалентных взаимодействий, а не одного события фосфорилирования CDK, это может позволить клеткам достичь устойчивости в передаче сигналов, а также сверхчувствительного ответа на повреждения ДНК во время клеточного цикла, аналогично множественному фосфорилированию Sic1 CDK при контроле клеточный цикл. 34
Материалы и методы
Штаммы дрожжей
Для создания мутантов использовали стандартные генетические методы дрожжей. Все мутанты rad9 были введены в эндогенный локус RAD9 с использованием метода трансформации на основе ПЦР и подтверждены секвенированием ДНК. 35 Подробности высылаются по запросу. Все штаммы, использованные в этом исследовании, перечислены в Таблице S1 .
Анализ двухъядерных клеток
Лог-фазные клетки были арестованы в фазе G 2 / M с 15 мкг / мл нокодазола в течение 3 часов при 30 ° C, а затем были разделены на два набора и переведены в комнатную температуру. .Один набор обрабатывали флеомицином 50 мкг / мл в течение 1 часа. Затем клетки промывали и помещали в свежую среду YPD. Образцы отбирали каждые 15 мин, фиксировали 70% этанолом, обрабатывали РНКазой и пепсином и окрашивали йодидом пропидия. Двухъядерные клетки подсчитывали вслепую. Для количественной оценки были выполнены три независимых эксперимента.
Вестерн-блот-анализ Rad9 и Rad53.
Клетки выращивали и задерживали в фазе G 2 / M, как описано выше, или поддерживали асинхронно и обрабатывали флеомицином 50 мкг / мл.Белковые экстракты получали с помощью осаждения трихлоруксусной кислотой. Rad9–3HA и Rad53 зондировали с использованием антител против HA (3F10) и против Rad53 соответственно.
Pull-down анализы
С-концевой TAP-меченный полноразмерный Dpb11 был сверхэкспрессирован из дрожжевого штамма SCY249 и был связан со смолами IgG. GST-меченные N-концевые домены BRCT Dpb11 (аминокислоты 1-260) были сверхэкспрессированы из E.coli и связаны с гранулами глутатион-сефарозы. Затем связанные с Dpb11 шарики инкубировали с равным количеством клеточного лизата, приготовленного из дрожжевых клеток, задержанных в фазе G 2 / M.Связывание проводили в буфере TBSN (50 мМ Трис pH 7,2, 50 мМ NaCl, 0,5% NP-40, 50 мМ β-глицерофосфат, 10 мМ NaF, 10 мМ ЭДТА, 2 мМ PMSF, смесь 2-кратного ингибитора протеазы и 2 мМ DTT. ) при 4 ° C в течение 2 часов, а шарики промывали TBSN (концентрация NaCl была увеличена до 100 мМ во время промывки) три раза. Связанные белки элюировали и затем детектировали вестерн-блоттингом с использованием антитела против НА или окрашиванием по Понсо.
Анализ чувствительности планшетов
10-кратные серийные разведения клеток с логарифмической фазой наносили на планшеты YPD с или без MMS, гидроксимочевины (HU) или флеомицина (Phleo) в указанных концентрациях и инкубировали при 30 ° C в течение 48-72 час
Раскрытие информации о потенциальных конфликтах интересов
О потенциальных конфликтах интересов не сообщалось.
Ссылки
1. Ниберг К.А., Майкельсон Р.Дж., Патнэм К.В., Вайнерт Т.А. На пути к поддержанию генома: повреждение ДНК и контрольные точки репликации. Анну Рев Жене. 2002; 36: 617–56. DOI: 10.1146 / annurev.genet.36.060402.113540. [PubMed] [CrossRef] [Google Scholar] 2. Чжоу BB, Элледж SJ. Реакция на повреждение ДНК: расставляем контрольные точки в перспективе. Природа. 2000; 408: 433–9. DOI: 10.1038/35044005. [PubMed] [CrossRef] [Google Scholar] 3. Харрисон Дж. К., Хабер Дж. Э. Пережить распад: контрольная точка повреждения ДНК. Анну Рев Жене. 2006; 40: 209–35. DOI: 10.1146 / annurev.genet.40.051206.105231. [PubMed] [CrossRef] [Google Scholar] 4. Вайнерт Т.А., Хартвелл Л.Х. Ген RAD9 контролирует реакцию клеточного цикла на повреждение ДНК у Saccharomyces cerevisiae. Наука. 1988; 241: 317–22. DOI: 10.1126 / science.32. [PubMed] [CrossRef] [Google Scholar] 5. Ира Г., Пеллициоли А., Балиджа А., Ван Х, Фиорани С., Каротенуто В. и др.Для резекции конца ДНК, гомологичной рекомбинации и активации контрольной точки повреждения ДНК требуется CDK1. Природа. 2004; 431: 1011–7. DOI: 10,1038 / природа02964. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 6. Ван Б., Мацуока С., Карпентер ПБ, Элледж С.Дж. 53BP1, посредник контрольной точки повреждения ДНК. Наука. 2002; 298: 1435–8. DOI: 10.1126 / science.1076182. [PubMed] [CrossRef] [Google Scholar] 7. Ли Дж. Х., Гударзи А. А., Джегго П. А., Пол ТТ. 53BP1 способствует активности ATM посредством прямого взаимодействия с комплексом MRN.EMBO J. 2010; 29: 574–85. DOI: 10.1038 / emboj.2009.372. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 8. Альбукерке С.П., Смолка М.Б., Пейн С.Х., Бафна В., Энг Дж., Чжоу Х. Технология многомерной хроматографии для углубленного анализа фосфопротеома. Протеомика клеток Mol. 2008; 7: 1389–96. DOI: 10.1074 / mcp.M700468-MCP200. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 9. Vialard JE, Gilbert CS, Green CM, Lowndes NF. Белок контрольной точки Rad9 у почкующихся дрожжей подвергается Mec1 / Tel1-зависимому гиперфосфорилированию и взаимодействует с Rad53 после повреждения ДНК.EMBO J. 1998; 17: 5679–88. DOI: 10.1093 / emboj / 17.19.5679. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 10. ван Вугт М.А., Гардино А.К., Линдинг Р., Остхаймер Г.Дж., Рейнхардт Х.С., Онг С.Е. и др. Сеть обратной связи митотического фосфорилирования соединяет Cdk1, Plk1, 53BP1 и Chk2 для инактивации контрольной точки повреждения ДНК G (2) / M. PLoS Biol. 2010; 8: e1000287. DOI: 10.1371 / journal.pbio.1000287. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 11. Linding R, Jensen LJ, Ostheimer GJ, van Vugt MA, Jørgensen C, Miron IM, et al.Систематическое открытие сетей фосфорилирования in vivo. Клетка. 2007; 129: 1415–26. DOI: 10.1016 / j.cell.2007.05.052. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 12. Bonilla CY, Melo JA, Toczyski DP. Совместной локализации датчиков достаточно, чтобы активировать контрольную точку повреждения ДНК при отсутствии повреждений. Mol Cell. 2008. 30: 267–76. DOI: 10.1016 / j.molcel.2008.03.023. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 13. Граната М., Лаззаро Ф., Новарина Д., Панигада Д., Пудду Ф., Абреу С.М. и др.Динамика связывания хроматина Rad9 и функция контрольной точки опосредуются его димеризацией и регулируются клеточным циклом с помощью активности CDK1. PLoS Genet. 2010; 6: 6. DOI: 10.1371 / journal.pgen.1001047. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 14. Пфандер Б., Диффли Дж. Ф. Dpb11 координирует активацию киназы Mec1 с регулируемым клеточным циклом рекрутингом Rad9. EMBO J. 2011; 30: 4897–907. DOI: 10.1038 / emboj.2011.345. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 15. Du LL, Nakamura TM, Рассел П.Зависящие от модификации и независимые от гистонов пути рекрутирования белка контрольной точки Crb2 на двухцепочечные разрывы. Genes Dev. 2006. 20: 1583–96. DOI: 10.1101 / gad.1422606. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 16. Софуева С., Ду Л.Л., Лимбо О., Уильямс Дж. С., Рассел П. Взаимодействия домена BRCT с фосфогистоном h3A нацелены на Crb2 в хроматин на двухцепочечных разрывах и поддерживают контрольную точку повреждения ДНК. Mol Cell Biol. 2010; 30: 4732–43. DOI: 10.1128 / MCB.00413-10. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 17.Nakamura TM, Du LL, Redon C, Russell P. Фосфорилирование гистона h3A контролирует рекрутирование Crb2 при разрывах ДНК, поддерживает блокировку контрольных точек и влияет на репарацию ДНК у делящихся дрожжей. Mol Cell Biol. 2004; 24: 6215–30. DOI: 10.1128 / MCB.24.14.6215-6230.2004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 18. Nakamura TM, Moser BA, Du LL, Russell P. Совместное управление Crb2 семейством ATM и киназами Cdc2 важно для контрольной точки повреждения ДНК у делящихся дрожжей. Mol Cell Biol. 2005; 25: 10721–30.DOI: 10.1128 / MCB.25.24.10721-10730.2005. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 19. Saka Y, Esashi F, Matsusaka T., Mochida S, Yanagida M. Контроль над повреждением и репликацией у делящихся дрожжей обеспечивается взаимодействием Crb2, белка с мотивом BRCT, с Cut5 и Chk1. Genes Dev. 1997; 11: 3387–400. DOI: 10.1101 / gad.11.24.3387. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 20. Mochida S, Esashi F, Aono N, Tamai K, O’Connell MJ, Yanagida M. Регулирование киназ контрольных точек посредством динамического взаимодействия с Crb2.EMBO J. 2004; 23: 418–28. DOI: 10.1038 / sj.emboj.7600018. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 21. Zegerman P, Diffley JF. Фосфорилирование Sld2 и Sld3 циклин-зависимыми киназами способствует репликации ДНК у почкующихся дрожжей. Природа. 2007; 445: 281–5. DOI: 10,1038 / природа05432. [PubMed] [CrossRef] [Google Scholar] 22. Шварц М.Ф., Дуонг Дж. К., Сан З., Морроу Дж. С., Прадхан Д., Стерн Д. Ф. Сайты фосфорилирования Rad9 связывают Rad53 с контрольной точкой повреждения ДНК Saccharomyces cerevisiae. Mol Cell. 2002; 9: 1055–65.DOI: 10.1016 / S1097-2765 (02) 00532-4. [PubMed] [CrossRef] [Google Scholar] 23. Сунь З., Сяо Дж., Фэй Д.С., Стерн Д.Ф. Домен Rad53 FHA, связанный с фосфорилированным Rad9 в контрольной точке повреждения ДНК. Наука. 1998. 281: 272–4. DOI: 10.1126 / science.281.5374.272. [PubMed] [CrossRef] [Google Scholar] 24. Чен Ш., Смолка МБ, Чжоу Х. Механизм активации Dun1 фосфорилированием Rad53 в Saccharomyces cerevisiae. J Biol Chem. 2007. 282: 986–95. DOI: 10.1074 / jbc.M6000. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 25.Танака К., Рассел П. Mrc1 направляет сигнал остановки репликации ДНК на киназу контрольной точки Cds1. Nat Cell Biol. 2001; 3: 966–72. DOI: 10,1038 / NCB1101-966. [PubMed] [CrossRef] [Google Scholar] 26. Осборн А.Дж., Элледж С.Дж. Mrc1 представляет собой компонент репликационной вилки, фосфорилирование которого в ответ на стресс репликации ДНК активирует Rad53. Genes Dev. 2003. 17: 1755–67. DOI: 10.1101 / gad.1098303. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 27. Тонг А.Х., Евангелиста М., Парсонс А.Б., Сюй Х., Бадер Г.Д., Пейдж Н. и др.Систематический генетический анализ с упорядоченными массивами делеционных мутантов дрожжей. Наука. 2001; 294: 2364–8. DOI: 10.1126 / science.1065810. [PubMed] [CrossRef] [Google Scholar] 28. Zhao X, Muller EG, Rothstein R. Супрессор двух основных генов контрольных точек идентифицирует новый белок, который отрицательно влияет на пулы dNTP. Mol Cell. 1998; 2: 329–40. DOI: 10.1016 / S1097-2765 (00) 80277-4. [PubMed] [CrossRef] [Google Scholar] 29. Ван Х, Элледж SJ. Генетические и физические взаимодействия между DPB11 и DDC1 в пути ответа на повреждение ДНК дрожжей.Генетика. 2002; 160: 1295–304. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Пудду Ф., Граната М., Ди Нола Л., Балестрини А., Пьерджованни Дж., Лаззаро Ф. и др. Фосфорилирование комплекса почкующихся дрожжей 9-1-1 необходимо для функции Dpb11 при полной активации контрольной точки повреждения ДНК, индуцированного УФ-излучением. Mol Cell Biol. 2008. 28: 4782–93. DOI: 10.1128 / MCB.00330-08. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 31. Germann SM, Oestergaard VH, Haas C, Salis P, Motegi A, Lisby M. Dpb11 / TopBP1 играет разные роли в репликации ДНК, ответе контрольных точек и гомологичной рекомбинации.Ремонт ДНК (Amst) 2011; 10: 210–24. DOI: 10.1016 / j.dnarep.2010.11.001. [PubMed] [CrossRef] [Google Scholar] 32. Масумото Х., Мурамацу С., Камимура Й., Араки Х. S-Cdk-зависимое фосфорилирование Sld2, необходимое для репликации хромосомной ДНК у почкующихся дрожжей. Природа. 2002; 415: 651–5. DOI: 10,1038 / природа713. [PubMed] [CrossRef] [Google Scholar] 33. Zegerman P, Diffley JF. Зависимое от контрольных точек ингибирование инициации репликации ДНК фосфорилированием Sld3 и Dbf4. Природа. 2010; 467: 474–8. DOI: 10,1038 / природа09373.[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] 34. Нэш П., Тан X, Орлики С., Чен К., Гертлер Ф. Б., Менденхолл, доктор медицины и др. Мультисайтовое фосфорилирование ингибитора CDK устанавливает порог начала репликации ДНК. Природа. 2001; 414: 514–21. DOI: 10,1038 / 35107009. [PubMed] [CrossRef] [Google Scholar] 35. Longtine MS, McKenzie A, 3rd, Demarini DJ, Shah NG, Wach A, Brachat A, et al. Дополнительные модули для универсального и экономичного удаления и модификации генов на основе ПЦР в Saccharomyces cerevisiae.Дрожжи. 1998. 14: 953–61. DOI: 10.1002 / (SICI) 1097-0061 (199807) 14:10 <953 :: AID-YEA293> 3.0.CO; 2-U. [PubMed] [CrossRef] [Google Scholar]Репликация ДНК, Контрольная точка, Синтез ДНК
Авраам, R. T. Передача сигналов контрольной точки клеточного цикла через киназы ATM и ATR. Genes Dev 15 , 2177–2196 (2001).
Агилера А. и Гомес-Гонсалес Б. Геном нестабильность: механистический взгляд на ее причины и последствия. Nat Rev Genet 9 , 204–217 (2008).
Annunziato, A.T. Разделенное решение: что происходит с нуклеосомы во время репликации ДНК? Дж Biol Chem 280 , 12065–12068 (2005).
Бодди, М. Н. и Рассел, П. Репликация ДНК контрольно-пропускной пункт. Curr. Биол. 11 , R953 – R956 (2001).
Бранзей Д. и Фойани М. Взаимодействие репликации контрольные точки и восстанавливают белки на остановившихся вилках репликации. Восстановление ДНК (Amst) 6 , 994–1003 (2007).
Branzei, D. & Foiani, M. Регулирование репарации ДНК на протяжении клеточного цикла. Нат Рев Мол Cell Biol 9 , 297–308 (2008).
Бранзей Д. и Фойани М. Сохранение генома стабильность на вилке репликации. Нат Rev Mol Cell Biol 11 , 208–219 (2010).
Carr, A. M. Контрольные точки, зависимые от структуры ДНК, как регуляторы репарации ДНК. Ремонт ДНК (Amst) 1 , 983–994 (2002).
Дюроше, Д.И Джексон, С. П. ДНК-ПК, банкоматы и ATR как датчики повреждения ДНК: вариации на тему? Curr Opin Cell Biol 13 , 225–231 (2001).
Groth, A. et al. Проба с хроматином во время репликации и репарации ДНК. Ячейка 128 , 721–733 (2007).
Hartwell, L.H. & Weinert, T.A. Контрольно-пропускные пункты: элементы управления, обеспечивающие порядок событий клеточного цикла. Наука 246 , 629–634 (1989).
Хеллер Р.К. и Мэрианс, К. Дж. Реплисомная сборка и прямой перезапуск застрявших вилок репликации. Nat Rev Mol Cell Biol 7 , 932–943 (2006).
Хеникофф, С., Фуруяма, Т. и Ахмад, К. Хистон варианты, сборка нуклеосом и эпигенетическое наследование. Тенденции Genet 20 , 320–326 (2004).
Кастан, М. Б. и Бартек, Дж. Контрольные точки клеточного цикла и рак. Nature 432 , 316–323 (2004).
Катоу, Ю. и др. Белки контрольной точки S-фазы Tof1 и Mrc1 образуют стабильную репликационную паузу. сложный. Nature 424 , 1078–1083 (2003).
Ламберт С., Фрогет Б. и Карр А. М. Арестованы. обработка вилки репликации: взаимодействие между контрольными точками и рекомбинацией. Восстановление ДНК (Amst) 6 , 1042–1061 (2007).
Leman, A. R. et al. al. Human Timeless и Tipin стабилизируют вилки репликации и облегчают сестринско-хроматидное сцепление. J Cell Sci 123 , 660–670 (2010).
Макфарлейн, Р. Дж., Миан, С. и Далгаард, Дж. З. многие аспекты роли белковых семейств Тим-Типин в биологии хромосом. Cell Cycle 9 , 700–705 (2010).
Nasmyth, K. & Haering, C.H. Cohesin: его роли и механизмы. Annu Rev Genet 43 , 525–558 (2009).
Noguchi, E. et al. al. Swi1 и Swi3 — компоненты комплекса защиты репликационной вилки. в делящихся дрожжах. Mol Cell Biol 24 , 8342–8355 (2004).
Nyberg, K. A. et al. al. НА ПОДДЕРЖКЕ ГЕНОМА: Повреждения ДНК и контрольные точки репликации. Annu Rev Genet 36 , 617–656 (2002).
Паулсен, Р. Д. и Симприх, К. А. Путь ATR: тонкая настройка вилки. Восстановление ДНК (Amst) 6 , 953–966 (2007).
Uhlmann, F. Вопрос выбора: установление сцепления сестринских хроматид. Отчеты EMBO 10 , 1095-1102 (2009).
Новое поколение контрольной иммунной терапии при раке: новые разработки и проблемы | Журнал гематологии и онкологии
Pardoll DM. Блокада иммунных контрольных точек в иммунотерапии рака. Нат Рев Рак. 2012; 12: 252–64.
CAS PubMed PubMed Central Статья Google ученый
Drake CG, Lipson EJ, Brahmer JR. Вдыхая новую жизнь в иммунотерапию: обзор меланомы, рака легких и почек.Нат Рев Клин Онкол. 2014; 11: 24–37.
CAS PubMed Статья Google ученый
Чен Л., Мухи DB. Молекулярные механизмы костимуляции и ко-ингибирования Т-клеток. Nat Rev Immunol. 2013; 13: 227–42.
PubMed PubMed Central Статья CAS Google ученый
Sharma P, Allison JP. Будущее иммунной контрольной терапии. Наука.2015; 348: 56–61.
CAS PubMed Статья Google ученый
Sharma P, Allison JP. Таргетинг на иммунные контрольные точки в терапии рака: к комбинированным стратегиям с лечебным потенциалом. Клетка. 2015; 161: 205–14.
CAS PubMed Статья Google ученый
Препарат Ledford H. Melanoma получил одобрение в США. Природа. 2011; 471: 561.
CAS PubMed Статья Google ученый
Granier C, De Guillebon E, Blanc C и др. Механизмы действия и обоснование использования ингибиторов контрольных точек при раке. Esmo Open. 2017; 2
Марин-Асеведо Дж. А., Сояно А. Э., Дхолария Б. и др. Иммунотерапия рака помимо ингибиторов иммунных контрольных точек. J Hematol Oncol. 2018; 11
Workman CJ, Dugger KJ, Vignali DA. На переднем крае: молекулярный анализ отрицательной регуляторной функции гена-3 активации лимфоцитов. J Immunol. 2002; 169: 5392–5.
CAS PubMed Статья Google ученый
Дхолария Б., Хаммонд В., Шредерс А., Лу Ю. Новые терапевтические агенты для лечения рака легких. J Hematol Oncol. 2016; 9: 138.
PubMed PubMed Central Статья CAS Google ученый
Anderson AC, Joller N, Kuchroo VK. Lag-3, Tim-3 и TIGIT: ко-ингибирующие рецепторы со специализированными функциями в иммунной регуляции.Иммунитет. 2016; 44: 989–1004.
CAS PubMed PubMed Central Статья Google ученый
He Y, Rivard CJ, Rozeboom L, et al. Ген-3 активации лимфоцитов, важный иммунный контрольный пункт при раке. Cancer Sci. 2016; 107: 1193–7.
CAS PubMed PubMed Central Статья Google ученый
Woo SR, Turnis ME, Goldberg MV, et al.Иммунные ингибирующие молекулы LAG-3 и PD-1 синергетически регулируют функцию Т-клеток, способствуя ускользанию от опухолевого иммунитета. Cancer Res. 2012; 72: 917–27.
CAS PubMed Статья Google ученый
Голдберг М.В., Дрейк К.Г. LAG-3 в иммунотерапии рака. Curr Top Microbiol Immunol. 2011; 344: 269–78.
CAS PubMed PubMed Central Google ученый
Andrews LP, Marciscano AE, Drake CG, Vignali DAA. LAG3 (CD223) как мишень иммунотерапии рака. Immunol Rev.2017; 276: 80–96.
CAS PubMed PubMed Central Статья Google ученый
Brignone C, Escudier B, Grygar C и др. Фармакокинетическое и биологическое корреляционное исследование фазы I IMP321, нового агониста MHC класса II, у пациентов с запущенной почечно-клеточной карциномой. Clin Cancer Res. 2009. 15: 6225–31.
CAS PubMed Статья Google ученый
Ван-Гиллам А., Пламбек-Зюсс С., Годегебюре П. и др. Исследование фазы I IMP321 и гемцитабина в качестве терапии первой линии у пациентов с запущенной аденокарциномой поджелудочной железы. Исследуйте новые наркотики. 2013; 31: 707–13.
CAS Статья Google ученый
Brignone C, Gutierrez M, Mefti F, et al.Химиоиммунотерапия первой линии при метастатической карциноме молочной железы: комбинация паклитаксела и IMP321 (LAG-3Ig) усиливает иммунные ответы и противоопухолевую активность. J Transl Med. 2010; 8: 71.
PubMed PubMed Central Статья CAS Google ученый
Nguyen LT, Ohashi PS. Клиническая блокада PD1 и LAG3 — возможные механизмы действия. Nat Rev Immunol. 2015; 15: 45–56.
CAS PubMed Статья Google ученый
Ascierto PA, Melero I, Bhatia S. et al. Начальная эффективность гена активации лимфоцитов-3 (anti-LAG-3; BMS-986016) в комбинации с ниволумабом (nivo) у пациентов с меланомой (MEL), ранее получавших терапию анти-PD-1 / PD-L1. J Clin Oncol 2017; 35: 9520–9520.
Сакуиси К., Нгиов С.Ф., Салливан Дж. М. и др. Регуляторные Т-клетки TIM3 + FOXP3 + являются тканеспецифическими промоторами дисфункции Т-клеток при раке. Онкоиммунология. 2013; 2: e23849.
PubMed PubMed Central Статья Google ученый
Du W, Yang M, Turner A, et al. TIM-3 как мишень для иммунотерапии рака и механизмы действия. Int J Mol Sci. 2017; 18: 645.
PubMed Central Статья Google ученый
Горман СП, Старбек-Миллер Г., Фам Н.Л. и др. Tim-3 непосредственно усиливает ответы Т-лимфоцитов CD8 на острую инфекцию Listeria monocytogenes. J Immunol. 2014; 192: 3133–42.
CAS PubMed PubMed Central Статья Google ученый
Эбрахим А.Х., Алалави З., Мирандола Л. и др. Галектины при раке: канцерогенез, диагностика и терапия. Ann Transl Med. 2014; 2: 88.
PubMed PubMed Central Google ученый
Фиори В., Маньяни М., Чианфрилья М. Экспрессия и модуляция CEACAM1 и трансформация опухолевых клеток. Энн Ист Супер Санита. 2012; 48: 161–71.
CAS PubMed Статья Google ученый
Ohue Y, Kurose K, Nishio Y et al. Abstract A101: роль пути TIM-3 / Galectin-9 в раке легких. Cancer Immunol Res 2016; 4: A101-A101.
Чжу С., Андерсон А.С., Шубарт А. и др. Лиганд Tim-3 галектин-9 отрицательно регулирует иммунитет Т-хелперов 1 типа. Nat Immunol. 2005; 6: 1245–52.
CAS PubMed Статья Google ученый
Yu X, Harden K, Gonzalez LC, et al. Поверхностный белок TIGIT подавляет активацию Т-клеток, способствуя образованию зрелых иммунорегуляторных дендритных клеток.Nat Immunol. 2009; 10: 48–57.
CAS PubMed Статья Google ученый
Станецкий Н., Симич Н., Арапович Дж. И др. Взаимодействие TIGIT с PVR и PVRL2 подавляет цитотоксичность NK-клеток человека. Proc Natl Acad Sci U S. A. 2009; 106: 17858–63.
CAS PubMed PubMed Central Статья Google ученый
Casado JG, Pawelec G, Morgado S, et al.Экспрессия молекул адгезии и лигандов для активации и костимулирующих рецепторов, участвующих в клеточно-опосредованной цитотоксичности в большой панели линий клеток меланомы человека. Cancer Immunol Immunother. 2009; 58: 1517–26.
CAS PubMed Статья Google ученый
Johnston RJ, Yu X, Grogan JL. Ингибитор контрольной точки TIGIT ограничивает противоопухолевые и противовирусные ответы CD8 + Т-клеток. Онкоиммунология. 2015; 4: e1036214.
PubMed PubMed Central Статья CAS Google ученый
Chauvin JM, Pagliano O, Fourcade J, et al. TIGIT и PD-1 повреждают опухолевые антиген-специфические CD8 (+) Т-клетки у пациентов с меланомой. J Clin Invest. 2015; 125: 2046–58.
PubMed PubMed Central Статья Google ученый
Lines JL, Pantazi E, Mak J, et al. VISTA — это молекула иммунной контрольной точки для человеческих Т-клеток. Cancer Res. 2014; 74: 1924–32.
CAS PubMed PubMed Central Статья Google ученый
Ле Мерсье I, Чен В., Лайнс Дж. Л. и др. VISTA регулирует развитие защитного противоопухолевого иммунитета. Cancer Res. 2014; 74: 1933–44.
CAS PubMed Статья Google ученый
Lines JL, Sempere LF, Broughton T. и др. VISTA — это новый регулятор отрицательных контрольных точек широкого спектра действия для иммунотерапии рака. Cancer Immunol Res. 2014; 2: 510–7.
CAS PubMed PubMed Central Статья Google ученый
Picarda E, Охэгбулам KC, Zang XX. Молекулярные пути: нацеливание на B7-h4 (CD276) для иммунотерапии рака человека. Clin Cancer Res. 2016; 22: 3425–31.
CAS PubMed PubMed Central Статья Google ученый
Castellanos JR, Purvis IJ, Labak CM, et al. Роль B7-h4 в иммунном ландшафте рака. Американский журнал клинической и экспериментальной иммунологии. 2017; 6: 66–75.
PubMed PubMed Central Google ученый
Powderly J, Cote G, Flaherty K et al. Промежуточные результаты продолжающейся фазы I исследования повышения дозы MGA271 (Fc-оптимизированное гуманизированное моноклональное антитело против B7-h4) у пациентов с рефрактерными новообразованиями, экспрессирующими B7-h4, или новообразованиями, сосудистая сеть которых экспрессирует B7-h4. J «Иммунотерапия рака» 2015; 3: O8-O8.
Weidle UH, Kontermann RE, Brinkmann U. Опухолевые антигенсвязывающие биспецифические антитела для лечения рака. Семин Онкол. 2014; 41: 653–60.
CAS PubMed Статья Google ученый
Толчер А.В., Элли Э.В., Чичили Г. и др. Фаза 1, первое на людях, открытое исследование повышения дозы MGD009, гуманизированного белка повторного нацеливания с двойной аффинностью B7-h4 x CD3 (DART) у пациентов с новообразованиями, экспрессирующими B7-h4, или опухолью, экспрессирующей B7-h4 сосудистая сеть. J Clin Oncol 2016; 34: TPS3105-TPS3105.
Kramer K, Kushner BH, Modak S, et al. Компартментная интратекальная радиоиммунотерапия: результаты лечения метастатической нейробластомы ЦНС. J Neuro-Oncol. 2010; 97: 409–18.
Артикул Google ученый
Леоне Р. Д., Лоу YC, Пауэлл Дж. Д.. Антагонисты A2aR: блокада контрольных точек нового поколения для иммунотерапии рака. Comput Struct Biotechnol J. 2015; 13: 265–72.
CAS PubMed PubMed Central Статья Google ученый
Чжан Б. CD73: новая мишень для иммунотерапии рака. Cancer Res. 2010; 70: 6407–11.
CAS PubMed PubMed Central Статья Google ученый
Виджаян Д., Янг А., Тенг MWL, Смит MJ. Нацеленность на иммуносупрессивный аденозин при раке (том 17, стр. 709, 2017). Nat Rev Cancer 2017; 17: 724–724.
Эменс Л., Пудерли Дж., Фонг Л. и др. Резюме CT119: CPI-444, пероральный антагонист рецептора аденозина A2a (A2aR), демонстрирует клиническую активность у пациентов с запущенными солидными опухолями. Cancer Res. 2017; 77: CT119.
Антониоли Л., Новицкий С.В., Саксенмайер К.Ф. и др. Отключение CD73: способ повысить активность традиционных и таргетных противоопухолевых препаратов.Drug Discov сегодня. 2017; 22: 1686–96.
CAS PubMed Статья Google ученый
Paulos CM, June CH. Притормозить BTLA в Т-клеточной иммунотерапии рака. J Clin Invest. 2010; 120: 76–80.
CAS PubMed Статья Google ученый
Malissen N, Macagno N, Granjeaud S. et al. HVEM: новая косигнальная молекула, представляющая большой интерес при меланоме.J Clin Oncol 2017; 35: e14591-e14591.
Lan X, Li S, Gao H, et al. Повышение BTLA и HVEM при раке желудка связано с прогрессированием и плохим прогнозом. Onco Targets Ther. 2017; 10: 919–26.
PubMed PubMed Central Статья Google ученый
Massague J. TGF beta при раке. Клетка. 2008; 134: 215–30.
CAS PubMed PubMed Central Статья Google ученый
Вендт МК, Тиан М.З., Шиманн В.П. Разбор механизмов и последствий ТФР-бета-индуцированной ЭМП во время прогрессирования рака. Cell Tissue Res. 2012; 347: 85–101.
CAS PubMed Статья Google ученый
Thomas DA, Massagué J. TGF-β непосредственно воздействует на цитотоксические Т-клеточные функции во время уклонения опухоли от иммунного надзора. Раковая клетка. 2005; 8: 369–80.
CAS PubMed Статья Google ученый
Padua D, Massague J. Роль бета-фактора TGF в метастазировании. Cell Res. 2009. 19: 89–102.
CAS PubMed Статья Google ученый
Neuzillet C, Tijeras-Raballand A, Cohen R, et al. Нацеленность на путь TGFbeta для лечения рака. Pharmacol Ther. 2015; 147: 22–31.
CAS PubMed Статья Google ученый
Смит А.Л., Робин Т.П., Форд Х.Л.Молекулярные пути: нацеливание на путь TGF-бета для лечения рака. Clin Cancer Res. 2012; 18: 4514–21.
CAS PubMed Статья Google ученый
Bogdahn U, Hau P, Stockhammer G, et al. Таргетная терапия глиомы высокой степени злокачественности с использованием ингибитора TGF-бета2 трабедерсена: результаты рандомизированного и контролируемого исследования фазы IIb. Нейроонкология. 2011; 13: 132–42.
CAS PubMed Статья Google ученый
Hwang L, Ng K, Wang W, Trieu VN. OT-101: опухоли, антисмысловые примированные к TGF-бета-2, для последующих химиотерапий. J Clin Oncol 2016; 34: e15727-e15727.
Gulley JL, Heery CR, Schlom J et al. Предварительные результаты фазы 1 испытания M7824 (MSB0011359C), бифункционального слитого белка, нацеленного на PD-L1 и TGF-β, в запущенных солидных опухолях. J Clin Oncol 2017; 35: 3006–3006.
Брандес А.А., Карпентье А.Ф., Кесари С. и др. Рандомизированное исследование фазы II монотерапии галунисертибом или галунисертибом плюс ломустин в сравнении с монотерапией ломустином у пациентов с рецидивирующей глиобластомой.Нейроонкология. 2016; 18: 1146–56.
CAS PubMed PubMed Central Статья Google ученый
Лонг Е.О., Барбер Д.Ф., Бурштын Д.Н. и др. Подавление сигналов активации естественных клеток-киллеров иммуноглобулиноподобными рецепторами клеток-киллеров (CD158). Immunol Rev.2001; 181: 223–33.
CAS PubMed Статья Google ученый
Дальберг К.И., Сархан Д., Чробок М. и др.Терапия на основе естественных клеток-киллеров против рака: возможные стратегии для достижения и поддержания противоопухолевой активности. Фронт Иммунол. 2015; 6: 605.
PubMed PubMed Central Статья Google ученый
Muntasell A, Ochoa MC, Cordeiro L, et al. Ориентация на контрольные точки NK-клеток для иммунотерапии рака. Curr Opin Immunol. 2017; 45: 73–81.
CAS PubMed Статья Google ученый
Бенсон Д.М., Калиджури Массачусетс. Убийца иммуноглобулиноподобных рецепторов и опухолевый иммунитет. Исследования иммунологии рака. 2014; 2: 99–104.
CAS PubMed PubMed Central Статья Google ученый
Leichner R, Kang H, Haddad R, et al. Предварительная эффективность исследования фазы I / II антитела, нацеленного на естественные клетки-киллеры лирилумаба, в комбинации с ниволумабом при плоскоклеточном раке головы и шеи. Журнал иммунотерапии рака.2016; 4
Schmitt C, Marie-Cardine A, Bensussan A. Терапевтические антитела к KIR3DL2 и другим целевым антигенам на кожных Т-клеточных лимфомах. Фронт Иммунол. 2017; 8
Багот М., Порку П., Рам-Вольф С. и др. Исследование фазы I IPh5102, анти-KIR3DL2 Mab, при рецидивирующих / рефрактерных кожных Т-клеточных лимфомах (CTCL): безопасность при повышении дозы, биомаркеры и результаты клинической активности. Гематол Онкол. 2017; 35: 48–9.
Артикул Google ученый
Дьори Д., Чесса Т, Хокинс П.Т., Стивенс Л.Р. Фосфоинозитид-3-киназы класса (I) в микроокружении опухоли. Раки. 2017; 9: 24.
PubMed Central Статья Google ученый
Толчер А., Хонг Д., Салливан Р и др. Резюме CT089: IPI-549-01 — фаза 1 / 1b, первое исследование на людях IPI-549, ингибитора PI3K-γ, в качестве монотерапии и в комбинации с ниволумабом у пациентов с развитыми солидными опухолями. Cancer Res 2017; 77: CT089-CT089.
Лю XJ, Kwon H, Li ZH, Fu YX. Является ли CD47 контрольной точкой врожденного иммунитета для уклонения от опухоли? J Hematol Oncol. 2017; 10
Weiskopf K. Иммунотерапия рака, нацеленная на альфа-ось CD47 / SIRP. Eur J Cancer. 2017; 76: 100–9.
CAS PubMed Статья Google ученый
Sikic BI, Narayanan S, Colevas AD et al. Первое среди людей, первое в своем классе исследование фазы I антитела Hu5F9-G4 к CD47 у пациентов с запущенными формами рака.J Clin Oncol 2016; 34: 3019–3019.
Thompson JA, Akilov O, Querfeld C et al. Испытание фазы 1 повышения дозы внутриопухолевого TTI-621, нового ингибитора иммунных контрольных точек, нацеленного на CD47, у субъектов с рецидивирующими или резистентными чрескожно доступными солидными опухолями и грибовидным микозом. J Clin Oncol 2017; 35: TPS3101-TPS3101.
Уиллоуби Дж., Гриффитс Дж., Тьюс И., Крэгг М.С. OX40: структура и функции — какие вопросы остаются? Мол Иммунол. 2017; 83: 13–22.
CAS PubMed Статья Google ученый
Aspeslagh S, Postel-Vinay S, Rusakiewicz S, et al. Обоснование иммунотерапии рака против OX40. Eur J Cancer. 2016; 52: 50–66.
CAS PubMed Статья Google ученый
Linch SN, McNamara MJ, Redmond WL. Агонисты OX40 и комбинированная иммунотерапия: педаль газа до упора. Фасад Онкол.2015; 5
Тернер Дж. Г., Рахмилевич А. Л., Бурделя Л. и др. Антитело к CD40 вызывает противоопухолевые и антиметастатические эффекты: роль NK-клеток. J Immunol. 2001. 166: 89–94.
CAS PubMed Статья Google ученый
Curti BD, Kovacsovics-Bankowski M, Morris N, et al. OX40 является мощной иммуностимулирующей мишенью для больных раком на поздней стадии. Cancer Res. 2013; 73: 7189–98.
CAS PubMed PubMed Central Статья Google ученый
Infante JR, Hansen AR, Pishvaian MJ et al. Исследование фазы Ib повышения дозы агониста OX40 MOXR0916 и ингибитора PD-L1 атезолизумаба у пациентов с развитыми солидными опухолями. J Clin Oncol 2016; 34: 101–101.
Хамид О., Томпсон Дж. А., Диаб А. и др. Первое исследование на людях (FIH) агонистических моноклональных антител (mAb) к OX40 PF-04518600 (PF-8600) у взрослых пациентов (pts) с избранными распространенными солидными опухолями: предварительная безопасность и фармакокинетические (PK) / фармакодинамические результаты.J Clin Oncol 2016; 34: 3079–3079.
Dempke WCM, Fenchel K, Uciechowski P, Dale SP. Препараты второго и третьего поколения для иммуноонкологического лечения — чем больше, тем лучше? Eur J Cancer. 2017; 74: 55–72.
CAS PubMed Статья Google ученый
Колено DA, Hewes B, Brogdon JL. Обоснование иммунотерапии рака против GITR. Eur J Cancer. 2016; 67: 1–10.
CAS PubMed Статья Google ученый
Кун Х. Б., Шепард Д. Р., Мергоуб Т. и др. Первое исследование с участием людей в фазе 1 однократной дозы TRX-518, моноклонального антитела против рецептора фактора некроза опухоли, индуцированного глюкокортикоидами человека (GITR), у взрослых с развитыми солидными опухолями. J Clin Oncol 2016; 34: 3017–3017.
Siu LL, Steeghs N, Meniawy T. et al. Предварительные результаты исследования фазы I / IIa BMS-986156 (глюкокортикоид-индуцированный агонист гена рецептора фактора некроза опухоли [GITR]) отдельно и в комбинации с ниволумабом у пациентов с развитыми солидными опухолями.J Clin Oncol 2017; 35: 104–104.
Tran B, Carvajal RD, Marabelle A et al. Повышение дозы является результатом первого на людях исследования фазы 1 глюкокортикоид-индуцированного агониста белка рецептора TNF (GITR) AMG 228 у пациентов (пациентов) с развитыми солидными опухолями. J Clin Oncol 2017; 35: 2521–2521.
Санмамед М.Ф., пастор Ф., Родригес А. и др. Агонисты костимуляции при иммунотерапии рака, направленные против CD137, OX40, GITR, CD27, CD28 и ICOS.Семин Онкол. 2015; 42: 640–55.
CAS PubMed Статья Google ученый
Fan XZ, Quezada SA, Sepulveda MA, et al. Включение пути ICOS заметно увеличивает эффективность блокады CTLA-4 в иммунотерапии рака. J Exp Med. 2014; 211: 715–25.
CAS PubMed PubMed Central Статья Google ученый
Харви К., Элпек К., Дуонг Е. и др.Эффективность моноклональных антител к агонистам ICOS на доклинических моделях опухолей дает основание для клинической разработки иммунотерапевтических средств против рака. Журнал иммунотерапии рака. 2015; 3: О9.
PubMed Central Статья Google ученый
Burris HA, Callahan MK, Tolcher AW et al. Безопасность фазы 1 агонистического антитела к ICOS JTX-2011 отдельно и с ниволумабом (nivo) при запущенных солидных опухолях; предсказанная и наблюдаемая фармакокинетика (PK) в ICONIC.J Clin Oncol 2017; 35: 3033–3033.
Chester C, Ambulkar S, Kohrt HE. Агонизм 4-1BB: добавление ускорителя к иммунотерапии рака. Cancer Immunol Immunother. 2016; 65: 1243–8.
CAS PubMed PubMed Central Статья Google ученый
Такеда К., Кодзима Ю., Уно Т. и др. Комбинированная терапия установленных опухолей антителами, нацеленными на молекулы, активирующие и подавляющие иммунную систему. J Immunol.2010; 184: 5493–501.
CAS PubMed Статья Google ученый
Tolcher AW, Sznol M, Hu-Lieskovan S et al. Исследование фазы Ib PF-05082566 в комбинации с пембролизумабом у пациентов с запущенными солидными опухолями. J Clin Oncol 2016; 34: 3002–3002.
Сигал Н.Х., Логан Т.Ф., Ходи Ф.С. и др. Результаты комплексного анализа безопасности урелумаба, агонистического моноклонального антитела к CD137. Clin Cancer Res.2017; 23: 1929–36.
CAS PubMed Статья Google ученый
Massarelli E, Segal N, Ribrag V. Оценка клинической безопасности и эффективности урелумаба, агониста CD137, отдельно и в комбинации с ниволумабом у пациентов с гематологическими злокачественными новообразованиями и солидными опухолями. J Immunother Cancer. 2016; 4: O7.
Артикул Google ученый
Perez-Ruiz E, Etxeberria I, Rodriguez-Ruiz ME, Melero I.Антитела против CD137 и PD-1 / PD-L1 на пути к клиническому синергизму. Clin Cancer Res. 2017; 23: 5326–8.
CAS PubMed Статья Google ученый
Деноуд Дж., Мозер М. Роль пути активации CD27 / CD70 в иммунитете и толерантности. J Leukoc Biol. 2011; 89: 195–203.
CAS PubMed Статья Google ученый
van de Ven K, Borst J.Нацеленность на костимуляторный путь CD27 / CD70 Т-клеток в иммунотерапии рака: обоснование и потенциал. Иммунотерапия. 2015; 7: 655–67.
CAS PubMed Статья Google ученый
Michot J-M, Maerevoet M, Aftimos PG et al. Клинический ответ, наблюдаемый в исследовании фазы I у пациентов с Т-клеточной лимфомой, получавших анти-CD70 SIMPLE антитело ARGX-110. J Clin Oncol 2016; 34: 7556–7556.
Овоникоко Т.К., Хуссейн А., Стадлер В.М. и др.Первое многоцентровое исследование фазы I на людях BMS-
1 (MDX-1203), конъюгата антитело-лекарственное средство, нацеленного на CD70. Cancer Chemother Pharmacol. 2016; 77: 155–62.CAS PubMed Статья Google ученый
Sanborn RE, Pishvain MJ, Callahan MK et al. Резюме CT023: фаза I является результатом комбинации иммуноактивирующего анти-CD27-антитела (варлилумаб) в сочетании с блокадой PD-1 (ниволумаб): активация по нескольким иммунным путям без нежелательных иммунных побочных эффектов.Cancer Res 2016; 76: CT023-CT023.
Vonderheide RH. Перспектива нацеливания на путь CD40 для лечения рака. Clin Cancer Res. 2007; 13: 1083–8.
CAS PubMed Статья Google ученый
Vonderheide RH, Glennie MJ. Агонистические антитела к CD40 и терапия рака. Clin Cancer Res. 2013; 19: 1035–43.
CAS PubMed PubMed Central Статья Google ученый
Dempke WCM, Fenchel K, Uciechowski P, Dale SP. Препараты второго и третьего поколения для иммуноонкологического лечения — чем больше, тем лучше? Eur J Cancer. 2017; 74: 55–72.
CAS PubMed Статья Google ученый
Кабо М., Оффринга Р., Зитвогель Л. и др. Вахта: иммуностимулирующие моноклональные антитела по онкологическим показаниям. Онкоиммунология. 2017; 6: e1371896.
PubMed Статья Google ученый
Moon YW, Hajjar J, Hwu P, Naing A. Нацеленность на путь индоламин-2,3-диоксигеназы при раке. J Immunother Cancer. 2015; 3:51.
PubMed PubMed Central Статья Google ученый
Тулмонд М., Пенел Н., Адам Дж. И др. Использование нацеливания pd-1, инфильтрации макрофагов и активации пути ido в саркомах: клиническое испытание фазы 2. JAMA Онкология. 2017;
Билир К., Сарисозен К.Индолеамин-2,3-диоксигеназа (IDO): только фермент или контроллер контрольной точки? Журнал онкологических наук. 2017; 3: 52–6.
Артикул Google ученый
Сиу Л.Л., Гельмон К., Чу К. и др. Резюме CT116: BMS-986205, оптимизированный ингибитор индоламин-2,3-диоксигеназы 1 (IDO1), хорошо переносится с высокой фармакодинамической активностью, отдельно и в комбинации с ниволумабом (nivo) при запущенных формах рака в фазе 1/2 испытание.Cancer Res. 2017; 77: CT116.
Артикул Google ученый
Zakharia Y, Drabick JJ, Khleif S et al. Обновленная информация о фазе 1b / 2 испытания ингибитора пути индоламин-2,3-диоксигеназы (IDO) индоксимод плюс ингибиторы контрольных точек для лечения неоперабельной меланомы 3 или 4 стадии. J Clin Oncol 2016; 34: 3075–3075.
Bahary N, Garrido-Laguna I, Cinar P et al. Испытание фазы 2 ингибитора пути индоламин-2,3-диоксигеназы (IDO) индоксимод плюс гемцитабин / наб-паклитаксел для лечения метастатического рака поджелудочной железы: промежуточный анализ.J Clin Oncol 2016; 34: 3020–3020.
Jha GG, Gupta S, Tagawa ST et al. Рандомизированное двойное слепое исследование фазы II сипулеуцел-Т с последующим применением ингибитора пути IDO, индоксимода или плацебо в лечении пациентов с метастатическим кастрационно-резистентным раком простаты (mCRPC). J Clin Oncol 2017; 35: 3066–3066.
Hamid O, Bauer TM, Spira AI et al. Безопасность эпакадостата 100 мг 2 раза в день плюс пембролизумаб 200 мг 1 раз в 3 недели при запущенных солидных опухолях: данные фазы 2 из ECHO-202 / KEYNOTE-037.J Clin Oncol 2017; 35: 3012–3012.
Perez RP, Riese MJ, Lewis KD et al. Эпакадостат плюс ниволумаб у пациентов с запущенными солидными опухолями: предварительные результаты фазы I / II исследования ECHO-204. J Clin Oncol 2017; 35: 3003–3003.
Битти Г.Л., Дуайер П.Дж., Кларк Дж. И др. Первое исследование фазы I на людях перорального ингибитора эпакадостата индоламин-2,3-диоксигеназы-1 (INCB024360) у пациентов с запущенными солидными злокачественными новообразованиями. Clin Cancer Res. 2017; 23: 3269.
CAS PubMed Статья Google ученый
Лу Х. Агонисты TLR для иммунотерапии рака: изменение баланса между иммуностимулирующим и ингибирующим эффектами. Фронт Иммунол. 2014; 5: 83.
PubMed PubMed Central Google ученый
Ши М., Чен Х, Е К. и др. Потенциал применения толл-подобных рецепторов в иммунотерапии рака: систематический обзор. Медицина. 2016; 95: e3951.
PubMed PubMed Central Статья Google ученый
Доулинг Дж., Мэнселл А. Толл-подобные рецепторы: швейцарский армейский нож иммунитета и разработки вакцин. Клиническая и трансляционная иммунология. 2016; 5
Li K, Qu S, Chen X, et al. Перспективные мишени для иммунотерапии рака: TLR, RLR и STING-опосредованные пути врожденного иммунитета. Int J Mol Sci. 2017; 18: 404.
PubMed Central Статья Google ученый
Гупта С., Грилли-Олсон Дж., Хонг Д. и др.Резюме CT091: Безопасность и фармакодинамическая активность MEDI9197, агониста TLR 7/8, вводимого внутриопухолево у субъектов с солидными опухолями. Cancer Res. 2017; 77: CT091.
Дредж К., Бреннан Т., Браун М.П. и др. Открытое многоцентровое исследование фазы I безопасности и переносимости нового иммуномодулирующего агента PG545 у пациентов с запущенными солидными опухолями. J Clin Oncol 2017; 35: 3083–3083.
де ла Торре А.Н., Подрядчик С., Кастанеда И. и др.Испытание фазы I с использованием местного регионарного лечения, несмертельного облучения, внутриопухолевого и системного применения полилизин-карбоксиметилцеллюлозы полиинозиновой-полицитидиловой кислоты для лечения рака печени: в поисках абскопального эффекта. Журнал гепатоцеллюлярной карциномы. 2017; 4
Томала Дж., Ковар М. Иммунокомплексы IL-2 / анти-IL-2 mAb: возрождение IL-2 в иммунотерапии рака? Онкоиммунология. 2016; 5
Цзян Т., Чжоу С., Рен С. Роль ИЛ-2 в иммунотерапии рака.Онкоиммунология. 2016; 5: e1163462.
PubMed PubMed Central Статья CAS Google ученый
Su EW, Moore CJ, Suriano S. et al. IL-2Rα опосредует временную регуляцию передачи сигналов IL-2 и усиливает иммунотерапию. Sci Transl Med 2015; 7: 311ra170-311ra170.
Диаб А., Таннир Н.М., Бернатчез С. и др. Исследование 1/2 фазы нового цитокина IL-2, NKTR-214 и ниволумаба у пациентов с избранными местнораспространенными или метастатическими солидными опухолями.J Clin Oncol 2017; 35: e14040-e14040.
Bernatchez C, Haymaker CL, Hurwitz ME et al. Влияние нового иммунного агониста цитокинов IL-2 (NKTR-214) на пролиферирующие CD8 + Т-клетки и экспрессию PD-1 на иммунных клетках в микроокружении опухоли у пациентов, прошедших предшествующую терапию контрольными точками. J Clin Oncol 2017; 35: 2545–2545.
Ананьева Е. Нацеливание на метаболизм аминокислот при росте рака и противоопухолевый иммунный ответ. Мир J Biol Chem. 2015; 6: 281–9.
PubMed PubMed Central Статья Google ученый
Тимосенко Э., Хаджиниколау А.В., Церундоло В. Модуляция онкоспецифических иммунных ответов ферментами, разрушающими аминокислоты. Иммунотерапия. 2017; 9: 83–97.
CAS PubMed Статья Google ученый
Пападопулос К.П., Цай Ф.Ю.-С, Бауэр TM et al. CX-1158-101: первое исследование фазы 1 на людях CB-1158, низкомолекулярного ингибитора аргиназы, в качестве монотерапии и в комбинации с ингибитором контрольной точки анти-PD-1 у пациентов (пациентов) с солидными опухолями.J Clin Oncol 2017; 35: 3005–3005.
Zhou H, Forveille S, Sauvat A, et al. Онколитический пептид LTX-315 вызывает гибель иммуногенных клеток. Cell Death Dis. 2016; 7
Sveinbjornsson B, Camilio KA, Haug BE, Rekdal O. LTX-315: первый в своем классе онколитический пептид, который репрограммирует микросреду опухоли. Future Med Chem. 2017; 9: 1339–44.
CAS PubMed Статья Google ученый
Ямадзаки Т., Питт Дж. М., Ветизу М. и др. Онколитический пептид LTX-315 преодолевает устойчивость рака к иммунотерапии с помощью блокады контрольной точки CTLA4. Смерть клетки отличается. 2016; 23: 1004–15.
CAS PubMed PubMed Central Статья Google ученый
Спайсер Дж. Ф., Борайн Дж. Ф., Авада А. и др. LTX-315, онколитический пептид, для иммуногенного преобразования «холодных» опухолей в «горячие» у пациентов с запущенными или метастатическими опухолями: результаты продолжающегося исследования фазы I.J Clin Oncol 2017; 35: 3085–3085.
Mittal SK, Cho KJ, Ishido S, Roche PA. Опосредованная интерлейкином 10 (ИЛ-10) иммуносупрессия: ИНДУКЦИЯ МАРТА-I РЕГУЛИРУЕТ ПРЕДСТАВЛЕНИЕ АНТИГЕНА МАКРОФАГАМИ, НО НЕ ДЕНДРИТИЧЕСКИМИ КЛЕТКАМИ. J Biol Chem. 2015; 290: 27158–67.
CAS PubMed PubMed Central Статья Google ученый
Miotto D, Lo Cascio N, Stendardo M, et al. CD8 + Т-клетки, экспрессирующие IL-10, связаны с благоприятным прогнозом при раке легких.Рак легких. 2010; 69: 355–60.
CAS PubMed Статья Google ученый
Чжан Х, Ван И, Хван Э.С., Хе Ю. Интерлейкин-10: иммуноактивирующий цитокин в иммунотерапии рака. J Clin Oncol. 2016; 34: 3576.
CAS PubMed Статья Google ученый
Сан З. Дж., Фуркад Дж., Пальяно О. и др. IL10 и PD-1 взаимодействуют для ограничения активности опухолеспецифических CD8 (+) Т-клеток.Cancer Res. 2015; 75: 1635–44.
CAS PubMed PubMed Central Статья Google ученый
Naing A, Wong DJL, Infante JR et al. Пегилированный человеческий IL-10 (AM0010) в комбинации с пембролизумабом при резистентной меланоме к анти-PD1 и CTLA-4. J Clin Oncol 2017; 35: 3084–3084.
Найду Дж., Пейдж ДБ, Ли Б.Т. и др. Токсичность антител иммунной контрольной точки против PD-1 и против PD-L1. Энн Онкол.2015; 26: 2375–91.
CAS PubMed Google ученый
Michot JM, Pruvost R, Mateus C, et al. Реакция лихорадки и гемофагоцитарный синдром, вызванные ингибиторами иммунных контрольных точек. Энн Онкол. 2018; 29: 518–20.
PubMed Статья Google ученый
Picchi H, Mateus C, Chouaid C, et al. Инфекционные осложнения, связанные с применением ингибиторов иммунных контрольных точек в онкологии: реактивация туберкулеза после лечения анти-PD-1.Clin Microbiol Infect. 2017;
Champiat S, Lambotte O, Barreau E, et al. Управление иммунными контрольными точками блокады дисиммунной токсичности: совместный документ с изложением позиции. Энн Онкол. 2016; 27: 559–74.
CAS PubMed Статья Google ученый
Дайн Дж., Гордон Р., Шамес И. и др. Ингибиторы иммунных контрольных точек: инновация в иммунотерапии для лечения и ведения больных раком.Азиатско-Тихоокеанский журнал медсестер онкологии. 2017; 4: 127–35.
PubMed PubMed Central Статья Google ученый
Linardou H, Gogas H. Управление токсичностью иммунотерапии для пациентов с метастатической меланомой. Анналы трансляционной медицины. 2016; 4
Gupta A, De Felice KM, Loftus EV Jr, Khanna S. Систематический обзор: колит, связанный с терапией анти-CTLA-4. Алимент Pharmacol Ther.2015; 42: 406–17.
Шарма П., Ху-Лиескован С., Варго Дж. А., Рибас А. Первичная, адаптивная и приобретенная устойчивость к иммунотерапии рака. Клетка. 2017; 168: 707–23.
CAS PubMed PubMed Central Статья Google ученый
Зарецкий Ю.М., Гарсия-Диас А., Шин Д.С. и др. Мутации, связанные с приобретенной устойчивостью к блокаде PD-1 при меланоме. N Engl J Med. 2016; 375: 819–29.
CAS PubMed PubMed Central Статья Google ученый
Дженкинс Р.В., Барби Д.А., Флаэрти К.Т. Механизмы устойчивости к ингибиторам иммунных контрольных точек. Br J Рак. 2018; 118: 9–16.
CAS PubMed PubMed Central Статья Google ученый
Таубе Дж. М., Андерс Р. А., Янг Г. Д. и др. Совместная локализация воспалительного ответа с экспрессией B7-h2 в меланоцитарных поражениях человека поддерживает механизм адаптивного сопротивления иммунного бегства. Sci Transl Med. 2012; 4: 127ra137.
Артикул CAS Google ученый
Tumeh PC, Harview CL, Yearley JH, et al. Блокада PD-1 вызывает ответы, подавляя адаптивную иммунную резистентность. Природа. 2014; 515: 568–71.
CAS PubMed PubMed Central Статья Google ученый
Lou Y, Diao L, Cuentas ER, et al. Эпителиально-мезенхимальный переход связан с определенным микроокружением опухоли, включая усиление воспалительных сигналов и множественные иммунные контрольные точки при аденокарциноме легкого.Clin Cancer Res. 2016; 22: 3630–42.
CAS PubMed PubMed Central Статья Google ученый
Мяо Д., Марголис, Калифорния, Гао В. и др. Геномные корреляты ответа на терапию иммунными контрольными точками при светлоклеточном почечно-клеточном раке. Наука. 2018; 359: 801–6.
CAS PubMed Статья Google ученый
Лукша М., Риаз Н., Макаров В. и др.Фитнес-модель неоантигена предсказывает ответ опухоли на иммунотерапию блокадой контрольных точек. Природа. 2017; 551: 517.
CAS PubMed Google ученый
Контрольно-пропускные пункты трезвости | Безопасность автотранспортных средств
Контрольно-пропускной пункт трезвости — это заранее определенное место, в котором
сотрудников правоохранительных органов останавливают автомобили в заранее определенном месте, чтобы проверить, не пострадал ли водитель. Они либо останавливают каждую машину, либо останавливают машины через определенные промежутки времени, например, каждую третью или десятую машину.Целью контрольно-пропускных пунктов является сдерживание вождения после пьянства за счет увеличения предполагаемого риска ареста. Для этого контрольно-пропускные пункты должны быть хорошо заметны, широко освещаться и проводиться регулярно. Фелл, Лейси и Воас (2004) предоставляют обзор операций контрольно-пропускных пунктов, их использования, эффективности и проблем. (Центр исследований безопасности дорожного движения UNC, 2011 г., стр. 1-18)
История
Контрольно-пропускные пункты трезвости были впервые введены в Скандинавии в 1930-х годах (Elder, Shults, et al., 2002) и стали обычным явлением в Соединенных Штатах в начале 1980-х годов (Hedlund and McCartt, 2002).В 1990 году Верховный суд США вынес решение в пользу конституционности контрольно-пропускных пунктов трезвости; однако дебаты по поводу контрольно-пропускных пунктов продолжаются, и суды некоторых штатов признали их незаконными за нарушение конституций штатов (IIHS, 2012).
Используйте
КПП «Трезвость» разрешены в 38 штатах и округе Колумбия (НАБДД, [2008g] [см. Таблицу B.3]), но лишь немногие штаты проводят их часто. По данным GHSA ([2014b]), только 13 штатов проводят пропускные пункты еженедельно.Основные причины, по которым контрольно-пропускные пункты не используются более часто, — это нехватка сотрудников правоохранительных органов и недостаток финансирования ([Fell, Ferguson, et al., 2003]). (Центр исследований безопасности дорожного движения UNC, 2011 г., стр. 1-18)
Эффективность
Систематический обзор 11 высококачественных исследований, проведенныйCDC, показал, что контрольно-пропускные пункты снижают количество аварий со смертельным исходом, травмами и материальным ущербом, связанными с употреблением алкоголя, примерно на 20 процентов ([Elder, Shults, et al., 2002]). Точно так же метаанализ показал, что контрольно-пропускные пункты сокращают количество аварий, связанных с употреблением алкоголя, на 17 процентов, а всех аварий — на 10–15 процентов ([Erke, Goldenbeld, and Vaa, 2009]).В последние годы NHTSA поддержало ряд усилий по сокращению вождения в состоянии алкогольного опьянения с помощью контрольно-пропускных пунктов. Оценки недавних кампаний в штате Коннектикут и Западная Вирджиния с участием контрольно-пропускных пунктов трезвости и обширных платных СМИ показали снижение числа смертельных случаев, связанных с употреблением алкоголя, после программы, а также уменьшение количества водителей с положительными значениями BAC в придорожных обследованиях ([Zwicker, Chaudhary, Maloney, et al. , 2007]; [Zwicker, Chaudhary, Solomon, et al., 2007]). Кроме того, исследование, посвященное демонстрационным программам в 7 штатах, выявило сокращение числа смертельных случаев, связанных с употреблением алкоголя, на 11–20 процентов в государствах, где использовались многочисленные контрольно-пропускные пункты или другие операции по обеспечению соблюдения правил вождения с заметными нарушениями, а также интенсивная пропаганда правоприменительной деятельности, включая платную рекламу ([[ Фелл, Лэнгстон и др., 2008]). В государствах с более низким уровнем правоприменения и гласности не наблюдалось снижения количества смертельных случаев по сравнению с соседними государствами. См. Также инициативу NHTSA по стратегической оценке государств (NHTSA, [2007]; Syner et al., 2008), программу Checkpoint Strikeforce ([Lacey, Kelley-Baker, et al., 2008]) и национальную праздничную кампанию, посвященную Дню труда: Вождение в нетрезвом виде. Превышен лимит. Под арестом ([Solomon, Hedlund, et al., 2008]). (Центр исследований безопасности дорожного движения UNC, 2011 г., стр. 1-18)
Недавнее исследование эффективности
Nunn and Newby, 2011, исследовали эффективность 22 контрольно-пропускных пунктов трезвости, реализованных в течение одного года в девяти контрольно-пропускных пунктах в Индианаполисе, штат Индиана, с использованием различных методологий (до / после, разница в различиях и прерывистые временные ряды).Показатели повреждений (количество столкновений с ослабленным водителем на 100 столкновений) незначительно снизились в районах за пределами города и значительно увеличились в районах города. Контрольно-пропускные пункты трезвости также привели к небольшому значительному сокращению количества аварий, связанных с употреблением алкоголя, по сравнению с аналогичными контрольными точками, причем различия более выражены в центре города. Наконец, анализ временных рядов показал, что количество нарушенных столкновений в периоды после контрольной точки было примерно на 19 процентов меньше, чем в периоды до контрольной точки.
Измерение эффективности
Поскольку контрольно-пропускные пункты трезвости предназначены для предотвращения вождения лиц с нарушениями, подходящей мерой могло бы быть количество задержанных водителей с ограниченными возможностями, но это нелегко определить. Вместо этого органы безопасности дорожного движения отслеживают изменения в количестве аварий, травм и смертельных случаев, связанных с употреблением алкоголя. Меры могут также включать количество остановок и количество арестов DWI на контрольно-пропускной пункт или осведомленность или восприятие контрольно-пропускных пунктов, полученные в результате опросов.
Стоимость
Основные затраты приходятся на время правоохранительных органов и на рекламу. Типичный контрольно-пропускной пункт требует от каждого сотрудника правоохранительных органов несколько часов. Затраты на правоохранительные органы могут быть сокращены путем использования контрольно-пропускных пунктов с 3–5 офицерами, возможно, дополненными добровольцами, вместо 10–12 или более офицеров, используемых в некоторых юрисдикциях (NHTSA, 2002; NHTSA, [2006a]; [Stuster and Blowers, 1995] ]). Правоохранительные органы в двух сельских округах Западной Вирджинии смогли поддерживать годичную программу еженедельных контрольно-пропускных пунктов с низким персоналом.Доля ночных водителей с КДК 0,05 и выше в этих округах была на 70 процентов ниже по сравнению с водителями из сравниваемых округов, в которых не было дополнительных контрольно-пропускных пунктов ([Lacey, Ferguson, et al., 2006]). У НАБДД есть руководство, предназначенное для помощи правоохранительным органам в планировании, эксплуатации и оценке пунктов пропуска трезвости с небольшим персоналом (НАБДД, [2006a]). (Центр исследований безопасности дорожного движения UNC, 2011 г., стр. 1-18–1-19)
«Реклама на контрольно-пропускных пунктах может быть дорогостоящей, если используются платные СМИ, хотя реклама может также включать заработанные СМИ» (e.g., бесплатное освещение кампании в новостях) (UNC Highway Safety Research Center, 2011, p. 1-19).
Время реализовать
«Контрольно-пропускные пункты могут быть внедрены очень быстро, если офицеры обучены обнаружению водителей с ограниченными физическими возможностями, SFST [Стандартизированный полевой тест на трезвость] и рабочим процедурам контрольно-пропускных пунктов. См. NHTSA, 2002, для получения информации о реализации »(Исследовательский центр безопасности дорожного движения UNC, 2011, стр. 1-19).
Другие проблемы
Законность
В настоящее времяконтрольно-пропускных пунктов разрешены в 38 штатах и округе Колумбия (NHTSA, [2008g]).Контрольно-пропускные пункты разрешены Конституцией Соединенных Штатов, но суды некоторых штатов постановили, что контрольно-пропускные пункты нарушают конституцию их штата. Законодательные органы некоторых штатов не имеют санкционированных контрольно-пропускных пунктов. Государства, где контрольные точки не разрешены, могут использовать патрулирование насыщения (см. [«Патрулирование насыщения», далее]). (Исследовательский центр безопасности дорожного движения UNC, 2011, стр. 1-19)
Видимость
По данным НАБДД, контрольно-пропускные пункты
должен быть хорошо заметен и широко освещаться, чтобы быть эффективным [(NHTSA, 2011b)].Планы коммуникации и правоприменения должны быть скоординированы. Сообщения должны четко и недвусмысленно поддерживать исполнение. Платные СМИ могут быть необходимы для дополнения новостных статей и других заработанных СМИ, особенно в продолжающейся программе контрольно-пропускных пунктов ([Goodwin, Foss, et al., 2005], Strategy B1). (Исследовательский центр безопасности дорожного движения UNC, 2011, стр. 1-19)
Аресты
Основная цель контрольно-пропускных пунктов — сдерживать водителей с ограниченными возможностями, а не увеличивать количество арестов. Полиция обычно арестовывает инвалидов-водителей, обнаруженных на контрольно-пропускных пунктах, и предает гласности эти аресты, но аресты на контрольно-пропускных пунктах не должны использоваться в качестве меры эффективности контрольно-пропускных пунктов.Число водителей, прошедших оценку на контрольно-пропускных пунктах, было бы более подходящей мерой.
Прочие преступления
Контрольно-пропускные пунктытакже могут использоваться для проверки наличия действительных водительских прав, использования ремней безопасности, невыполненных ордеров, угнанных автомобилей и других нарушений правил дорожного движения и уголовных правонарушений.
Объединение контрольных точек с другими видами деятельности
Чтобы сделать операции правоохранительных органов более заметными, в некоторых юрисдикциях контрольно-пропускные пункты комбинируются с другими видами деятельности, такими как патрулирование в условиях насыщения.Например, некоторые правоохранительные органы проводят патрулирование и контрольно-пропускных пунктов, и патрулирование в течение одних и тех же выходных. Другие чередуют контрольно-пропускные пункты и патрулирование в разные выходные в рамках более масштабных мер по обеспечению соблюдения правил вождения автомобилей с ограниченными возможностями.
Таблица B.3. Государственные законы о пунктах пропуска трезвости, по состоянию на декабрь 2011 г.
| Государство | Проведено контрольно-пропускных пунктов | Частота | Законность |
|---|---|---|---|
| Ала. | Есть | Круглый год | Подтверждено Конституцией США |
| Аляска | Нет | Не применимо | Нет государственного органа |
| Аризона | Есть | Не реже одного раза в месяц | Подтверждено Конституцией США |
| Ковчег | Есть | Еженедельно | Поддерживается конституциями штата и США |
| Калифорния. | Есть | 2,500+ ежегодно | Поддерживается конституциями штата и США |
| Цвет | Есть | Один или два раза в месяц | Поддерживается конституциями штата и США |
| Соединение | Есть | Не применимо | Поддерживается конституцией штата |
| Округ Колумбия | Есть | ежемесячно с января по июнь; еженедельно с июля по декабрь | Подтверждено законодательством штата и U.S. Конституция |
| Дел. | Есть | Один или два раза в месяц | Подтверждено Конституцией США |
| Флорида | Есть | От 15 до 20 в месяц | Подтверждено Конституцией США |
| Ga. | Есть | Еженедельно | Поддерживается конституциями штата и США |
| Гавайи | Есть | Еженедельно | Утверждено законом |
| Айдахо | Нет | Не применимо | Незаконно в соответствии с законодательством штата |
| ил. | Есть | Несколько сотен в год | Подтверждено Конституцией США |
| Инд. | Есть | Не применимо | Поддерживается конституцией штата |
| Айова | Нет | Не применимо | Не допускается; Закон, разрешающий контрольно-пропускные пункты, не разрешает контрольно-пропускные пункты |
| Кан. | Есть | Один или два раза в месяц | Подтверждено законодательством штата и U.S. Конституция |
| Ky. | Есть | Еженедельно | Подтверждено Конституцией США |
| Ла | Есть | Не применимо | Поддерживается конституцией штата |
| Мэн | Есть | Не применимо | Подтверждено Конституцией США |
| мкр. | Есть | Еженедельно | Поддерживается конституциями штата и США |
| Масса. | Есть | Круглый год | Поддерживается конституциями штата и США |
| Мичиган | Нет | Не применимо | Незаконно согласно конституции штата |
| Миннесота | Нет | Не применимо | Незаконно согласно конституции штата |
| Мисс | Есть | Еженедельно | Подтверждено Конституцией США |
| Пн. | Есть | Один или два раза в месяц | Подтверждено Конституцией штата и США |
| Монт. | Нет | Не применимо | Статут разрешает только выборочные проверки безопасности |
| Наб. | Есть | от 6 до 10 в месяц | Подтверждено законом штата |
| Нев. | Есть | Один или два раза в месяц | Утверждено законом |
| Н.H. | Есть | Еженедельно, в хорошую погоду | Утверждено законом (должно быть одобрено в судебном порядке) |
| Нью-Джерси | Есть | Один или два раза в месяц | Поддерживается конституциями штата и США |
| Н.М. | Есть | Не применимо | Соблюдается в соответствии с конституциями штата и США (правоохранительные органы должны следовать руководящим принципам) |
| Нью-Йорк | Есть | Еженедельно | Поддерживается под U.S. Конституция |
| Н.З. | Есть | Еженедельно | Утверждено законом |
| Н. Д. | Есть | Не применимо | Поддерживается конституциями штата и США |
| Огайо | Есть | Круглый год | Поддерживается конституциями штата и США |
| Окла | Есть | Один или два раза в месяц | Поддерживается государством и У.S. Конституции |
| Руда | Нет | Не применимо | Незаконно согласно конституции штата |
| Па. | Есть | Несколько сотен в год | Поддерживается конституциями штата и США |
| Р.И. | Нет | Не применимо | Незаконно согласно конституции штата |
| S.C. | Есть | Не применимо | Нет государственного органа |
| С.Д. | Есть | Еженедельно | Поддерживается конституциями штата и США |
| Тенн. | Есть | Один или два раза в месяц | Поддерживается конституциями штата и США |
| Техас | Нет | Не применимо | Незаконно согласно толкованию Техаса Конституции США |
| Юта | Есть | Примерно через месяц | Утверждено законом |
| Вт. | Есть | Еженедельно | Поддерживается конституциями штата и США |
| Вирджиния. | Есть | Еженедельно | Поддерживается конституциями штата и США |
| Мыть. | Нет | Не применимо | Незаконно согласно конституции штата |
| W.Va. | Есть | Еженедельно | Поддерживается конституциями штата и США |
| Висконсин. | Нет | Не применимо | Запрещено законом |
| Wyo. | Нет | Не применимо | Запрещено толкованием закона о блокпосту |
ИСТОЧНИК: GHSA, 2014b.
Блокировка инициирования срабатывания контрольной точки предотвращает несоответствующую репликацию вне S-фазы
Жизненно важно, чтобы при каждом делении клетки весь геном реплицировался один и только один раз.У эукариот это достигается путем связывания контроля репликации ДНК с клеточным циклом (Siddiqui et al., 2013). Первым шагом в репликации является формирование пререпликативного комплекса (pre-RC) в источниках — процесс, называемый «лицензированием». Лицензирование включает комплекс распознавания происхождения 1-6 (Orc1-6) и Cdc6-зависимую загрузку двойных гексамеров геликазы Mcm2-7 на двухцепочечной ДНК. Лицензирование ограничено поздним митозом / ранней фазой G1 из-за активности APC / C (комплекса, стимулирующего анафазу / циклосома), который устраняет лицензирующие ингибиторы, такие как циклин-зависимая киназа (CDK) и геминин, в этом окне клеточного цикла.В почкующихся дрожжах Saccharomyces cerevisiae , в которых отсутствует геминин, CDK ингибирует лицензирование от поздней фазы G1 до митоза с помощью множества механизмов, включая прямое фосфорилирование Orc2 / Orc6 и ядерное исключение комплекса Mcm2-7, а также опосредуя SCF CDC4 -зависимая деградация Cdc6 (Blow and Dutta, 2005; Nguyen et al., 2001).
Важно отметить, что двойные гексамеры Mcm2-7, загруженные в позднюю M / раннюю G1 фазу, неактивны, и инициация репликации может происходить только после инактивации APC / C при переходе G1 / S.Инактивация APC / C способствует накоплению активности CDK в S-фазе и Dbf4-зависимой киназы (DDK) (Labib, 2010). DDK непосредственно фосфорилирует неактивные двойные гексамеры Mcm2-7, создавая сайт связывания для факторов активации, включая Sld3 / Sld7 и Cdc45, в то время как CDK фосфорилирует Sld3 и дополнительный фактор инициации Sld2, который посредством фосфо-взаимодействий с Dpb11 приводит к сборке реплисомы, плохо понятые механизмы (Riera et al., 2017). Эта двойственность функции CDK, как ингибитора лицензирования и как активатора реплисомы, критична для обеспечения репликации один раз за клеточный цикл (Diffley, 2004).
В свете важности связи между контролем репликации ДНК и развитием клеточного цикла существует несколько контрольных точек для регулирования синтеза ДНК и целостности генома до (контрольная точка G1), во время (контрольная точка S-фазы) и после S-фазы (G2 / Контрольно-пропускной пункт М, Хартвелл и Вайнерт, 1989; Кастан и Бартек, 2004). Эти контрольные точки опосредуются киназами контрольной точки суперсемейства киназ PI3 ATM / ATR (Ataxia telangiectasia mutated / ATM и RAD3-related, называется Tel1 / Mec1 в почкующихся дрожжах) и эффекторными киназами контрольных точек Chk1 / Chk2 (Chk1 / Rad53 в почкующихся дрожжах. ).
В фазе G1 повреждение ДНК, такое как УФ-фотопродукты, вызывает зависящие от контрольных точек задержки в начале репликации ДНК за счет ингибирования активности G1 / S cyclin-CDK (Lanz et al., 2019; Shaltiel et al., 2015). У людей переход G1-S задерживается за счет опосредованной ATM-Chk2 стабилизации p53, что приводит к экспрессии ингибитора CDK p21, а также за счет зависимой от контрольной точки деградации циклина D и активатора CDK Cdc25A (Lanz et al. , 2019; Shaltiel et al., 2015). У почкующихся дрожжей задержка G1-S частично происходит за счет Rad53-зависимого фосфорилирования и ингибирования субъединицы Swi6 транскрипционного активатора SBF (фактора связывания SCB), что приводит к снижению транскрипции циклина (Sidorova and Breeden, 1997).
В S-фазе срабатывание источника в невозмущенных клетках происходит как континуум на протяжении S-фазы, с некоторыми источниками срабатывания в первой половине (раннее начало) или второй половине S-фазы (позднее начало). Когда репликационные вилки, исходящие из ранних источников инициации, останавливаются, например, из-за повреждений ДНК, активация киназного ответа контрольной точки S-фазы приводит к резкому замедлению скорости репликации (Painter and Young, 1980; Paulovich and Hartwell, 1995), что происходит в значительной степени за счет ингибирования происхождения позднего срабатывания (Yekezare et al., 2013).
Подобно фазе G1, активация контрольной точки в S-фазе в клетках человека может предотвращать инициирование активации посредством ингибирования активности CDK, например, посредством Chk1- и Chk2-опосредованной деградации активатора CDK Cdc25A (Bartek et al., 2004). Однако у почкующихся дрожжей киназа контрольной точки Rad53 блокирует запуск позднего ориджина не за счет ингибирования активности CDK, а за счет прямого ингибирования двух факторов инициации репликации: субъединицы DDK Dbf4 и мишени CDK Sld3 (Lopez-Mosqueda et al., 2010; Зегерман и Диффли, 2010). Rad53-зависимое фосфорилирование Sld3 ингибирует его взаимодействия с различными другими факторами репликации, включая Dpb11 (Lopez-Mosqueda et al., 2010; Zegerman and Diffley, 2010), в то время как недавняя работа показала, что прямое взаимодействие между Rad53 и Cdc7-Dbf4 предотвращает распространение DDK. связывание с комплексом Mcm2–7 (Abd Wahab, Remus, 2020). У высших эукариот, помимо ингибирования активности CDK, контрольная точка также может подавлять инициирование импульса посредством прямого нацеливания на ортолога Sld3 Treslin (Boos et al., 2011; Guo et al., 2015) и DDK (Costanzo et al., 2003; Lee et al., 2012). Следовательно, существует множество механизмов, обеспечивающих устойчивое ингибирование инициации репликации в S-фазе путем прямого нацеливания на Sld3 / Treslin и Dbf4-зависимую киназу и путем ингибирования активности CDK (Lanz et al., 2019). Одной из функций такого надежного ингибирования инициирования возбуждения во время S-фазы при наличии повреждений ДНК является предотвращение истощения основных факторов, таких как активность топоизомеразы, чрезмерным количеством реплисом (Morafraile et al., 2019; Толедо и др., 2017).
Ключевой предлагаемой особенностью контрольных точек повреждения ДНК является то, что реакция адаптирована к фазе клеточного цикла, в которой произошло повреждение ДНК (Shaltiel et al., 2015). Несмотря на это, существует очень мало доказательств того, что субстратная специфичность киназ контрольной точки изменяется во время клеточного цикла. В самом деле, у почкующихся дрожжей большинство форм повреждения ДНК и репликационного стресса сходятся на одной эффекторной киназе Rad53, но неизвестно, как разные ответы контрольных точек в разных фазах клеточного цикла могут опосредоваться одной киназой.В этом исследовании мы намеревались изучить специфичность Rad53 в отношении субстратов репликации Sld3 и Dbf4 через клеточный цикл у почкующихся дрожжей, S. cerevisiae . Мы показали, что Rad53 фосфорилирует оба этих субстрата на протяжении клеточного цикла в тех же местах, что и в S-фазе. Исходя из этого, мы предположили, что хотя эти субстраты считаются целями «контрольной точки S-фазы», Rad53 также может предотвращать возгорание аберрантного происхождения вне S-фазы. В самом деле, мы показываем, что Rad53-зависимое ингибирование Sld3 и Dbf4 ограничивает повторную инициацию репликации в фазе G2 / M, а также предотвращает преждевременное срабатывание всех ориджинов, а не только поздних ориджинов, при переходе G1 / S.Это исследование пересматривает наше понимание специфичности фазы клеточного цикла «контрольной точки S-фазы» и обеспечивает новый механизм, который ограничивает инициацию репликации определенным окном клеточного цикла после повреждения ДНК.
.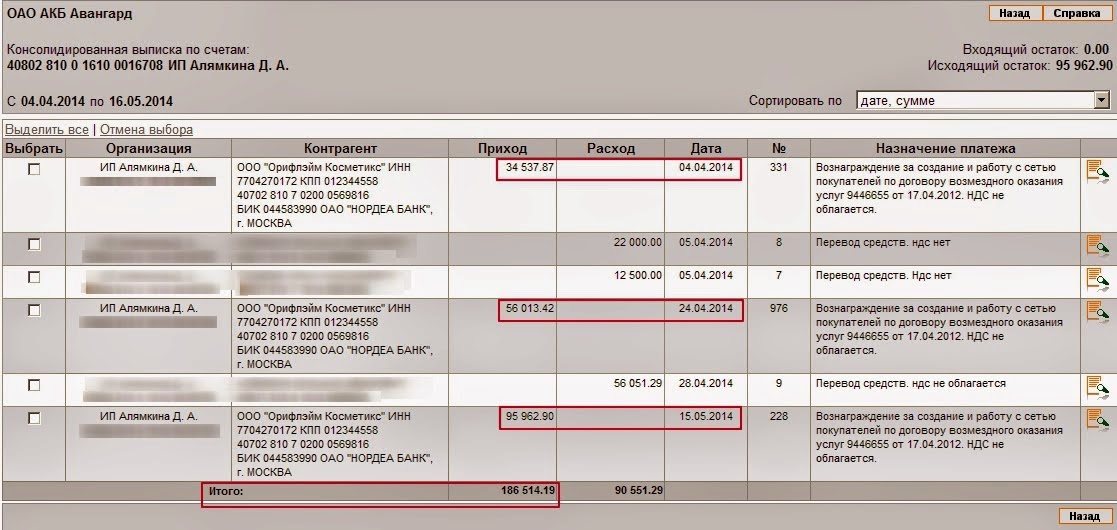 Они очень важны для организаций. Их указывают в декларациях по налогам, бухгалтерских отчетах, платежных формах, при заполнении документов для регистрации недвижимости, филиалов и других материальных объектов, при заключении сделок с контрагентами. Кроме этих данных, учреждения обязательно указывают ОКПО.
Они очень важны для организаций. Их указывают в декларациях по налогам, бухгалтерских отчетах, платежных формах, при заполнении документов для регистрации недвижимости, филиалов и других материальных объектов, при заключении сделок с контрагентами. Кроме этих данных, учреждения обязательно указывают ОКПО.
 В этом правовом акте черным по белому написано, что КПП имеется только в ЕГРЮЛ. А раз в ЕГРИП его нет, то и у предпринимателя быть не может.
В этом правовом акте черным по белому написано, что КПП имеется только в ЕГРЮЛ. А раз в ЕГРИП его нет, то и у предпринимателя быть не может.