Расчет критического объема реализации продукции
Поможем написать любую работу на аналогичную тему
Получить выполненную работу или консультацию специалиста по вашему учебному проекту
Узнать стоимость
Безубыточность — такое состояние, когда бизнес не приносит ни прибыли, ни убытков. Это выручка, которая необходима для того, чтобы предприятие начало получать прибыль. Разность между фактическим количеством реализованной продукции и безубыточным объемом продаж — это зона безопасности (зона прибыли), и чем она больше, тем прочнее финансовое состояние предприятия.
Расчет данных показателей основывается на взаимодействии: затраты — объем продаж — прибыль. Для определения их уровней используют графический и аналитический способы.
Критический объем реализации — это выручка от реализации, при которой предприятие способно закрыть все свои издержки без образования прибыли (точка безубыточности, мертвая точка).
Рис. 2.9.1 Графический способ изображения точки безубыточности объема продаж
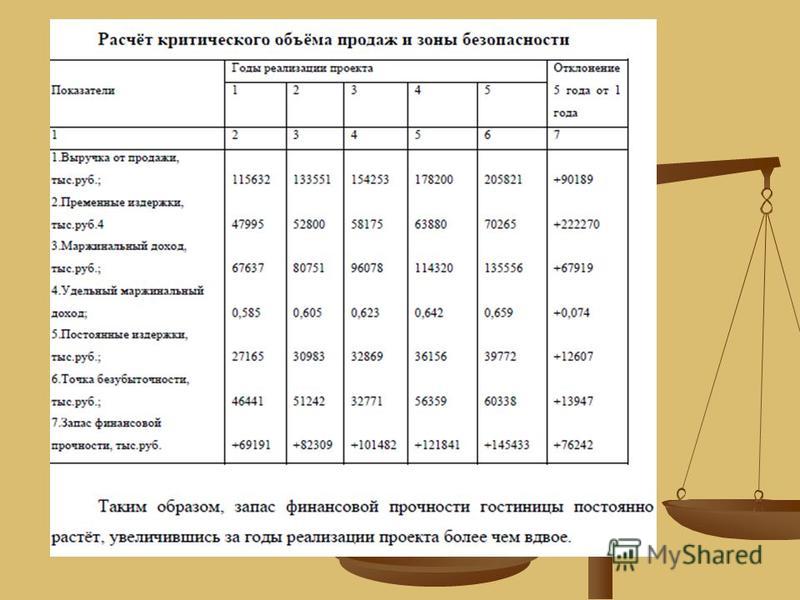
Объем продаж, соответствующих безубыточному состоянию фирмы определяется путем деления величины постоянных издержек на разность продажной цены и величиной переменных издержек (марженальный доход).
Пример. При каком объеме выпуска продукции предприятие достигнет критического объема, если:
рыночная цена — 100 у.е.
переменные расходы — 60 у.е.
постоянные расходы — 1 000 у.е.
Решение.
изделий;
у.е.
Предприятие должно продать продукции на сумму 2 500 у.е., чтобы покрыть свои издержки.
Внимание!
Если вам нужна помощь в написании работы, то рекомендуем обратиться к профессионалам. Более 70 000 авторов готовы помочь вам прямо сейчас. Бесплатные корректировки и доработки. Узнайте стоимость своей работы.
Себестоимость продукции строительной организации
Содержание материала
Страница 1 из 6
В рыночных условиях хозяйствования независимо от организационно – правовой формы одной из главных целей предпринимательской деятельности (в том числе и в отрасли «строительство») является прибыль как источник финансовых ресурсов для развития производства, удовлетворения потребностей владельцев производства и государства в целом. Прибыль, как известно, определяется разницей между выручкой от реализации продукции и затратами на ее производство и реализацию, т.
 Себестоимость – важнейший показатель, влияющий на общий финансовый результат деятельности строительной организации. В строительстве используются показатели сметной (определенной в сметах), плановой (рассчитанной строительной организацией с учетом конкретных условий) и фактической (реально сложившейся на строительной площадке) себестоимости строительно – монтажных работ. Себестоимость строительно – монтажных работ включает расходы на приобретение материалов, топлива, энергии, оплату труда наемных работников, компенсацию износа используемых основных фондов и другие затраты. Все издержки в зависимости от способов их включения в себестоимость работ подразделяются на прямые и накладные. Затраты на производство строительно – монтажных работ, продукции и услуг подразделяются на текущие и единовременные.
Себестоимость – важнейший показатель, влияющий на общий финансовый результат деятельности строительной организации. В строительстве используются показатели сметной (определенной в сметах), плановой (рассчитанной строительной организацией с учетом конкретных условий) и фактической (реально сложившейся на строительной площадке) себестоимости строительно – монтажных работ. Себестоимость строительно – монтажных работ включает расходы на приобретение материалов, топлива, энергии, оплату труда наемных работников, компенсацию износа используемых основных фондов и другие затраты. Все издержки в зависимости от способов их включения в себестоимость работ подразделяются на прямые и накладные. Затраты на производство строительно – монтажных работ, продукции и услуг подразделяются на текущие и единовременные.Маржинальный доход и практическое управление прибылью
Автор: Ольга Михайловна Гopeлик, доктор экономических наук, профессор, заведующая кафедрой прикладной информатики в экономике Toльяттинcкoгo государственного университета сервиса.
Сущность маржинального анализа заключается в анализе соотношения объема продаж (выпуска продукции), себестоимости и прибыли на основе прогнозирования уровня этих величин при заданных ограничениях. В его основе лежит деление затрат на переменные и постоянные. На практике набор критериев отнесения статьи к переменной или постоянной части зависит от специфики организации, принятой учетной политики, целей анализа и от профессионализма соответствующего специалиста.
Основной категорией маржинального анализа является маржинальный доход. Маржинальный доход (прибыль) — это разность между выручкой от реализации (без учета НДС и акцизов) и переменными затратами. Иногда маржинальный доход называют также суммой покрытия — это та часть выручки, которая остается на покрытие постоянных затрат и формирование прибыли. Чем выше уровень маржинального дохода, тем быстрее возмещаются постоянные затраты и организация имеет возможность получать прибыль.
Маржинальный доход (М) рассчитывается по формуле
M = S — V
где S — выручка от реализации; V — совокупные переменные затраты.
Маржинальный доход можно рассчитать не только на весь объем выпуска в целом, но и на единицу продукции каждого вида (удельный маржинальный доход). Экономический смысл этого показателя — прирост прибыли от выпуска каждой дополнительной единицы продукции:
M = (S-V) / Q = p -v
где M — удельный маржинальный доход; Q — объем реализации; р — цена единицы продукции; v — переменные затраты на единицу продукции.
Найденные значения удельных маржинальных доходов для каждого конкретного вида продукции важны для менеджера. Если данный показатель отрицателен, это свидетельствует о том, что выручка от реализации продукта не покрывает даже переменных затрат. Каждая последующая произведенная единица данного вида продукции будет увеличивать общий убыток организации. Если возможности значительного снижения переменных затрат сильно ограничены, то менеджеру следует рассмотреть вопрос о выведении данного товара из ассортимента предлагаемой организацией продукции.
На практике производят более глубокую детализацию переменных затрат на группы переменных производственных, общепроизводственных, общехозяйственных и прочих расходов. Отсюда вытекает необходимость исчисления нескольких показателей маржинального дохода, из анализа которых выносится решение о том, воздействие на какие группы расходов может наиболее заметно отразиться на величине конечного финансового результата.
Деление затрат на постоянные и переменные, исчисление маржинального дохода позволяют определить влияние объема производства и сбыта на величину прибыли от реализации продукции, работ, услуг и тот объем продаж, начиная с которого предприятие получает прибыль. Делается это на основе анализа модели безубыточности (системы «затраты—объем производства—прибыль»).
Модель безубыточности опирается на ряд исходных предположений:
- поведение затрат и выручки можно описать линейной функцией одной переменной — объема выпуска;
- переменные затраты и цены остаются неизменными в течение всего планового периода;
- структура продукции не изменяется в течение планируемого периода;
- поведение постоянных и переменных затрат может быть точно измерено;
- на конец анализируемого периода у предприятия не остается запасов готовой продукции (или они несущественны), т.
 е. объем продаж соответствует объему производства.
е. объем продаж соответствует объему производства.
Точка безубыточности — это объем выпуска, при котором прибыль предприятия равна нулю, т.е. объем, при котором выручка равна суммарным затратам. Иногда ее называют также критическим объемом: ниже этого объема производство становится нерентабельным.
Алгебраическим методом точка нулевой прибыли рассчитывается исходя из следующей зависимости:
I = S -V — F = (p * Q) — (v * Q) — F = 0
где I — величина прибыли; S — выручка; V — совокупные переменные затраты; F — совокупные постоянные затраты.
Отсюда находим критический объем:
Q‘ = F / (p-v)
где Q‘ — точка безубыточности (критический объем в натуральном выражении).
Критический объем производства и реализации продукции можно рассчитать не только в натуральном, но и в стоимостном выражении:
S = F * p /(p — v) = Q’ * p
где S — критический объем производства и реализации продукции.
Экономический смысл этого показателя — выручка, при которой прибыль равна нулю. Если фактическая выручка предприятия больше критического значения, оно получает прибыль, в противном случае — убыток.
Приведенные выше формулы расчета критического объема производства и реализации в натуральном и стоимостном выражении справедливы лишь, когда выпускается только один вид продукции или когда структура выпуска
Точка закрытия предприятия — это объем выпуска, при котором оно становится экономически неэффективным, т.е. при котором выручка равна постоянным затратам:
Q’ ‘ = F / p
где Q’ ‘ — точка закрытия.
Если фактический объем производства и реализации продукции меньше Q», предприятие не оправдывает своего существования и его следует закрыть. Если же фактический объем производства и реализации продукции больше Q», ему следует продолжать свою деятельность, даже если оно получает убыток.
Если же фактический объем производства и реализации продукции больше Q», ему следует продолжать свою деятельность, даже если оно получает убыток.
Еще один аналитический показатель, предназначенный для оценки риска — «кромка безопасности», т.е. разность между фактическим и критическим объемами выпуска и реализации (в натуральном выражении):
Кб = Оф — Q‘
где Kб — кромка безопасности; Оф — фактический объем выпуска и реализации продукции.
Полезно рассчитать отношение кромки безопасности к фактическому объему. Эта величина покажет, на сколько процентов может снизиться объем выпуска и реализации, чтобы избежать убытка.
К% = Кб / Qф * 100%,
где К% — отношение кромки безопасности к фактическому объему.
Кромка безопасности характеризует риск предприятия: чем она меньше, тем больше риск того, что фактический объем производства и реализации продукции не достигнет критического уровня Q’ и предприятие окажется в зоне убытков.
Данные о величине маржинального дохода и других производных показателей получили довольно широкое распространение для прогнозирования затрат, цены реализации продукции, допустимого удорожания ее себестоимости, оценки эффективности и целесообразности увеличения объема производства, в решении задач типа «производить самим или покупать» и в других расчетах по оптимизации управленческих решений.
Во многом это объясняется сравнительной простотой, наглядностью и доступностью расчетов точки безубыточности. Вместе с тем необходимо иметь в виду, что формулы модели безубыточности годятся только для тех решений, которые принимаются в пределах приемлемого диапазона цен, затрат и объемов производства и продаж.
Вне этого диапазона цена реализации единицы продукции и переменные издержки на единицу продукции уже не считаются постоянными, и любые результаты, полученные без учета таких ограничений, могут привести к неправильным выводам. Наряду с несомненными достоинствами модель безубыточности обладает определенными недостатками, которые связаны прежде всего с допусками, заложенными в ее основу.
При расчете точки безубыточности исходят из принципа линейного наращивания объемов производства и продаж без учета возможностей скачка, например, вследствие сезонности выпуска и сбыта. При определении условий достижения безубыточности и построении соответствующих графиков важно правильно задать данные о степени использования производственных мощностей.
Анализ точки безубыточности служит одним из важных способов решения многих проблем управления, поскольку при комбинированном применении с другими методами анализа его точность вполне достаточна для обоснования управленческих решений в реальной жизни.
Только практические современные знания и навыки. Учитесь только тому, что вам интересно и нужно по абонементу, со скидкой.
3} {N_A} $ Полный шаг за шагом Ответ:
Критическое условие — это условие, при котором газы обладают текучестью, как жидкости, и называются сверхкритическими текучими средами. Сверхкритическая жидкость, используемая в методах замены растворителей, таких как $ C {O_2} $, используется для экстракции кофеина.
Предполагается, что указанный выше газ соответствует уравнению газа Ван-дер-Ваальса. Уравнение газа Ван-дер-Ваальса следует за реальными газами, это уравнение эквивалентно уравнению идеального газа. В этом уравнении учитываются фактическое давление и объем, так как в уравнении идеального газа притяжение между молекулами и объемом молекул не учитывается, поэтому давление реального газа немного меньше, чем у идеального газа, а объем молекул считается меньшим.{\ dfrac {1} {3}}} $
Следовательно, вариант (A) верен.
Примечание:
Температура, выше которой газ не может сжижаться путем повышения давления, или температура, до которой газ может сжижаться путем приложения внешнего давления, является критической температурой. А давление, необходимое для сжижения газа при критических температурных условиях, является критическим давлением. Критическая температура рассчитана с помощью эксперимента Эндрю. Критическая температура задается как
$ {T_C} = \ dfrac {{8a}} {{27Rb}} $
, а критическое давление составляет $ {P_C} = \ dfrac {a} {{27 {b ^ 2}}}. $
$
И критический объем задается как $ {V_C} = 3b $, то есть объем при критической температуре и критическом давлении.
Критические константы — температура, давление, объем реального газа
Критические константы реального газа
Критические константы , такие как критическая температура , критическая давление и критический объем газа, определяют условия и формулу сжижения реальных и идеальных газов. Сжижение газов — важное свойство физической химии, которое используется для транспортировки природного газа. Большинство газов в нашей окружающей среде сжижается при обычном давлении, но при подходящем понижении температуры охлаждения.Но многие газы, такие как водород, азот, кислород, метан и т. Д., Нельзя сжижать при обычной температуре, однако можно использовать высокое давление. Следовательно, условия сжижения и критическая температура, давление и объем молекулы реального газа определяются изотермами Эндрюса и определяются в терминах постоянной Ван-дер-Ваальса.
Согласно кинетической теории, идеальный газ нельзя сжижать при критической температуре, потому что молекулы газа считаются точечными массами без межмолекулярного притяжения.Настоящие газы также нельзя сжижать, если их температура не ниже определенного значения, зависящего от свойств газов. Температура, при которой газ может быть сжижен, называется его критической температурой для изучения химии или физической химии.
Сжижение газов
В 1869 году Томас Эндрюс провел эксперимент с небольшим количеством углекислого газа в стеклянной трубке, закрытой и запечатанной химическим элементом ртутью. Он изучал зависимости P — V для диоксида углерода при различных температурах или условия ожижения при критической температуре.
При высоких температурах или выше критической температуры изотермы сжижения диоксида углерода подчиняются закону идеального газа. При низких температурах или ниже критической характер кривых выглядит совершенно иначе. По мере увеличения давления объем газа уменьшается по кривым от A до B.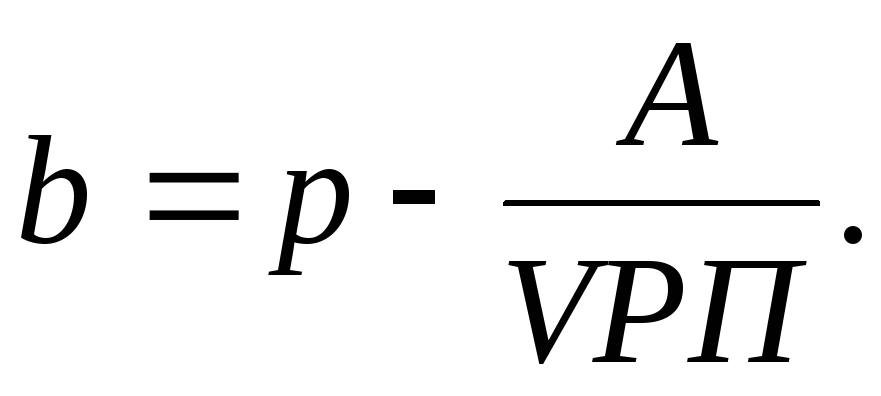 В этот момент начинается сжижение B, и объем быстро уменьшается, поскольку газ превращается в жидкость с гораздо более высокой плотностью.
В этот момент начинается сжижение B, и объем быстро уменьшается, поскольку газ превращается в жидкость с гораздо более высокой плотностью.
Точка C, разжижение углекислого газа завершено.КД кривой свидетельствует об этом. AB представляет газообразное состояние, BC представляет жидкость или пар в равновесии, а CD показывает только жидкое состояние. Еще более высокие температуры при T 2 , мы получаем кривую того же типа, что и ABCD. При температурах T C горизонтальная часть уменьшается до простой точки, называемой критической точкой или состоянием газов. У каждого газа может быть предел температуры, выше которого его нельзя сжижать.
Критическая температура, давление, объем
Критические температура, давление и объем просто представляют собой T C , P C и V C соответственно, и выше которых газы не могут сжижаться.
Что такое критическая температура?
Критическая температура (T C ) — это максимальная температура, при которой газ может сжижаться, и температура, выше которой жидкость не может существовать.
Что такое критическое давление?
Критическое давление (P C ) — это максимальное давление, необходимое для сжижения газов при критической температуре.
Что такое критический объем?
Критический объем (V C ) — это объем, который занимает один грамм-моль газообразных веществ при критических температуре и давлении.
Непрерывность состояния
Исследование кривой PV при температуре ниже критической может быть прерывистой или нарушаться во время преобразования газа в жидкость. Непрерывность состояния вещества от газа к жидкости можно объяснить из приведенной выше изотермы Эндрюса ABCD при температуре T 1 . Предположим, что газ нагревается с удельной теплоемкостью при постоянном объеме вместе с AB. Затем газ постепенно остывает при постоянном давлении вместе с БК, объем значительно уменьшится.При достижении D начнется процесс разжижения.
В точке D система содержит сильно сжатый газ. Но, судя по кривой Эндрюса, критическая температура представляет собой точку сжижения газов. Следовательно, нет различия между жидким и газообразным состоянием. Между двумя фазами нет линии разделения. Это известно как принцип преемственности государства.
Следовательно, нет различия между жидким и газообразным состоянием. Между двумя фазами нет линии разделения. Это известно как принцип преемственности государства.
Критическая температура Формула давления и объема
С повышением температуры точки минимума и максимума приближаются друг к другу, а в критической точке (C) происходит слияние максимума и минимума.Наклон и кривизна в этой точке становятся равными нулю. В этих условиях мы можем вычислить формулу критической температуры, давления и объема для реальных газов из уравнения Ван-дер-Стенса.
Измеренное значение V C , T C и P C газа, V C = 3b, T C = 8a / 27Rb и P C = a / 27b 2
Вопрос: Вычислите постоянную Ван-дер-Ваальса для газа, когда критическая температура и давление = 280.8 К и = 50 атм соответственно.
Ответ: a = 0,057 л моль -1 и b = 4,47 л 2 атм моль -2
Коэффициент сжимаемости реального газа
Формула коэффициента сжимаемости в этом состоянии газа, Z c = P C V C / RT C = 3/8 = 0,375 и значение критического коэффициента = 8/3 = 2,66. Если мы сравним эти значения с экспериментальными значениями, мы обнаружили, что согласие очень плохое.Потому что уравнение Ван-дер-Ваальса в критическом состоянии не очень точное.
Если мы сравним эти значения с экспериментальными значениями, мы обнаружили, что согласие очень плохое.Потому что уравнение Ван-дер-Ваальса в критическом состоянии не очень точное.
Экспериментальное значение коэффициента сжимаемости для неполярных или слабополярных связывающих молекул, таких как гелий, неон, аргон, кислород и метан, близко к 0,29. Для молекулы, имеющей полярность или поляризацию, такую как хлор, сероуглерод, хлороформ и этилен, близкие к 0,26 или 0,27. Для молекул, связывающих водородные связи, таких как аммиак, вода, метиловый спирт, они близки к 0,22–0,24.
Критические константы из постоянной Ван-дер-Ваальса
Постоянная Ван-дер-Ваальса для реального газа может быть определена по формуле критических констант (температура и давление), а объем в выражении исключен из-за сложности определения.Из критических констант, таких как температура, давление и объем, формула констант Ван-дер-Ваальса, b = V C /3 и a = 27 R 2 T C 2 / 64P C .
Задача: Критические постоянные для воды: 647 K, 22,09 МПа и 0,0566 дм 3 моль -1 . Какое значение имеют a и b?
Раствор: T C = 647 K, P C = 22,09 МПа = 22,09 × 10 3 кПа, V C = 0.0566 дм 3 моль -1 . Следовательно, постоянная Ван-дер-Ваальса, b = V C /3 = (0,0566 дм 3 моль -1 ) / 3 = 0,0189 дм 3 моль -1 . Из формулы критических констант реального газа a = 3 P C V C 2 = 3 (22,09 × 10 3 ) × (0,0566) 2 = 213,3 кПа моль -2 .
Вопрос: Атом в молекуле имеет T C = — 122 ° C, P C = 48 атм.Каков радиус атома?
Ответ: Расчетный радиус атома = 1,47 × 10 -8 см.
Критическая температура газа
Для идеального газа a = 0, поскольку между молекулами нет сил притяжения.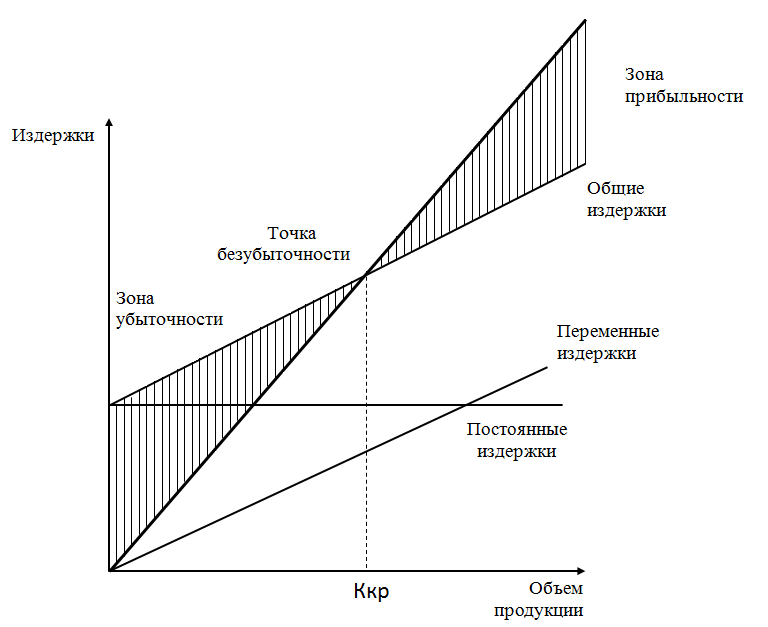 Следовательно, T C таких газов равен нулю. Отсюда элементарное условие для сжижения идеальных газов — охлаждение ниже критической температуры. Идеальный газ нельзя сжижать при критической температуре или нуле Кельвина, потому что практически невозможно достичь нулевой температуры Кельвина.
Следовательно, T C таких газов равен нулю. Отсюда элементарное условие для сжижения идеальных газов — охлаждение ниже критической температуры. Идеальный газ нельзя сжижать при критической температуре или нуле Кельвина, потому что практически невозможно достичь нулевой температуры Кельвина.
6.3: Ван-дер-Ваальс и другие газы
Мы видели, что настоящие газы напоминают идеальный газ только при низких давлениях и высоких температурах. Были предприняты различные попытки найти уравнение, которое адекватно представляло бы связь между P, V и T для реального газа, то есть найти уравнение состояния для реального газа. Некоторые из этих попыток были чисто эмпирическими попытками подогнать математическую формулу к реальным данным. Другие являются результатом хотя бы попытки описать какую-то физическую модель, которая объяснила бы поведение реальных газов.3 + … \]
* В уравнении Клаузиуса, если мы выберем c = 3b , мы получим довольно хорошее согласие между критическим коэффициентом сжатия газа Клаузиуса и многих реальных газов. Значение «критического коэффициента сжатия» и расчет его значения для газа Клаузиуса описаны немного позже в этом разделе.
Значение «критического коэффициента сжатия» и расчет его значения для газа Клаузиуса описаны немного позже в этом разделе.
Есть много других, но, безусловно, наиболее известным из них является уравнение Ван-дер-Ваальса, которое я опишу довольно подробно.
Голосовой аппарат говорящего по-английски не может правильно произнести имя van der Waals, хотя W произносится больше как V, чем W, и, на мой взгляд, v является чем-то средним между av и ан f.Чтобы правильно произносить его, особенно гласные, необходимо спросить у носителя голландского языка. Частое написание «уравнение Ван дер Ваала» — всего лишь еще один симптом современного прискорбного незнания использования апострофа, о котором так сожалеет Линн Трасс.
Единицы, в которых должны быть выражены константы a и b , иногда вызывают затруднения, и они зависят от того, предназначен ли символ V в уравнении для обозначения удельного или молярного объема.2 \ right) (V-b) = RT / \ mu \), где µ — молярная масса («молекулярная масса»). 2 \ right) (V-b) = RT \).В этом случае размеры и единицы СИ для a — это ML 5 T −2 моль −2 и Па · м 6 кмоль −2 , а размеры и единицы СИ для b — L 3 моль −1 и м 3 кмоль −1
2 \ right) (V-b) = RT \).В этом случае размеры и единицы СИ для a — это ML 5 T −2 моль −2 и Па · м 6 кмоль −2 , а размеры и единицы СИ для b — L 3 моль −1 и м 3 кмоль −1
Константы Ван-дер-Ваальса, относящиеся к молярному объему h3O и CO2, приблизительно равны:
H 2 O: a = 5,5 × 10 5 Па · м 6 кмоль −2. b = 3,1 × 10 −2 м 3 кмоль −1
CO 2 : a = 3,7 × 10 5 Па м 6 кмоль −2 b = 4,3 × 10 −2 м 3 кмоль −1
Уравнение Ван-дер-Ваальса возникло в результате, по крайней мере, некоторой попытки описать физическую модель реального газа. Свойства идеального газа можно смоделировать, предположив, что газ состоит из совокупности молекул с нулевым эффективным размером и без сил между ними, а давление является результатом столкновений со стенками содержащего его сосуда. В модели Ван-дер-Ваальса предполагается наличие сил притяжения между молекулами. Они известны как силы Ван-дер-Ваальса, и теперь считается, что они возникают потому, что, когда одна молекула приближается к другой, каждая из них индуцирует дипольный момент в другой, и два индуцированных диполя затем притягиваются друг к другу. Эта сила притяжения снижает давление на стенках, причем уменьшение пропорционально количеству молекул на стенках, которые притягиваются молекулами внизу, и количеству молекул внизу, которые притягивают.Оба значения обратно пропорциональны V , поэтому давление в уравнении состояния необходимо заменить измеренным давлением P плюс член, обратно пропорциональный V 2 . Далее, сами молекулы занимают конечный объем. Это равносильно утверждению, что на очень близком расстоянии есть силы отталкивания, сил (теперь понимаемые как кулоновские силы), которые больше, чем силы Ван-дер-Ваальса притяжения. Таким образом, объем, в котором молекулы могут свободно перемещаться, должен быть уменьшен в уравнении Ван-дер-Ваальса.
В модели Ван-дер-Ваальса предполагается наличие сил притяжения между молекулами. Они известны как силы Ван-дер-Ваальса, и теперь считается, что они возникают потому, что, когда одна молекула приближается к другой, каждая из них индуцирует дипольный момент в другой, и два индуцированных диполя затем притягиваются друг к другу. Эта сила притяжения снижает давление на стенках, причем уменьшение пропорционально количеству молекул на стенках, которые притягиваются молекулами внизу, и количеству молекул внизу, которые притягивают.Оба значения обратно пропорциональны V , поэтому давление в уравнении состояния необходимо заменить измеренным давлением P плюс член, обратно пропорциональный V 2 . Далее, сами молекулы занимают конечный объем. Это равносильно утверждению, что на очень близком расстоянии есть силы отталкивания, сил (теперь понимаемые как кулоновские силы), которые больше, чем силы Ван-дер-Ваальса притяжения. Таким образом, объем, в котором молекулы могут свободно перемещаться, должен быть уменьшен в уравнении Ван-дер-Ваальса. Подробнее о силах между молекулами см. Раздел 6.8.
Подробнее о силах между молекулами см. Раздел 6.8.
Какими бы убедительными вы ни казались эти аргументы, они, по крайней мере, представляют собой попытку описать некоторую физику, они действительно представляют поведение реальных газов лучше, чем уравнение идеального газа, и, по крайней мере, они дают нам возможность немного математическая практика.
Вскоре мы увидим, как можно определить константы a и b из измерений критических параметров.2}. \]
Отсюда легко получаем
\ [\ frac {P_c V_c} {RT_c} = \ frac {3} {8} = 0,375. \]
Эту величину часто называют критическим коэффициентом сжатия или критическим коэффициентом сжимаемости, и мы будем обозначать ее символом Z c . Для многих реальных газов Z c составляет около 0,28; таким образом, уравнение Ван-дер-Ваальса, хотя и полезно для качественного обсуждения свойств газов, не особенно хорошо воспроизводит наблюдаемый критический коэффициент сжатия. 2 + 9v-3 = 0. \]
2 + 9v-3 = 0. \]
Для объемов, составляющих менее трети критического объема, это уравнение вообще не описывает поведение реального газа. В самом деле, вы можете видеть, что p = ∞, когда v = 1/3, что означает, что вам нужно приложить бесконечное давление, чтобы сжать газ Ван-дер-Ваальса до трети его критического объема. Возможно, вы захотите самостоятельно исследовать поведение уравнений 6.3.14 и 15 для объемов меньше этого. Вы обнаружите, что он стремится к бесконечности при v = 0 и 1/3, и он имеет максимум между этими двумя объемами.Но уравнение представляет физический интерес только для v > 1/3, где изменение давления, объема и температуры имеет хотя бы некоторое сходство с поведением реальных газов, если ни в коем случае не является точным. На рисунке VI.2 я показываю поведение газа Ван-дер-Ваальса для пяти температур: одна выше критической, другая — при критической и три — ниже критической. Геометрическое место максимумов и минимумов находится путем исключения t между уравнением 6. 3.14 и ∂ p / ∂ v = 0.3} \]
3.14 и ∂ p / ∂ v = 0.3} \]
Не путайте синюю кривую на этом рисунке (она показывает геометрическое место максимумов и минимумов) с пунктирной кривой на рисунке VI.1 (она показывает границу между фазами). Для температур 0,85, 0,90 и 0,95 я провел линии постоянного давления, где жидкость и пар находятся в равновесии в реальной жидкости. Они нарисованы так, что делят кривую Ван-вер-Ваальса на две равные области, вверху и внизу. Это означает, что работа, совершаемая реальной жидкостью, когда она переходит из жидкости в пар при постоянном давлении, равна работе, которая была бы проделана ее гипотетическим эквивалентом Ван-дер-Ваальса на ее волнообразном пути.Позже мы увидим, что расположение горизонтальной линии является следствием того факта, что функция Гиббса (которую мы еще не встречали) постоянна, в то время как жидкость и пар находятся в равновесии. Пунктирная линия на рисунке VI.1 будет соответствовать на рисунке VI.2 геометрическому месту концов горизонтальных линий.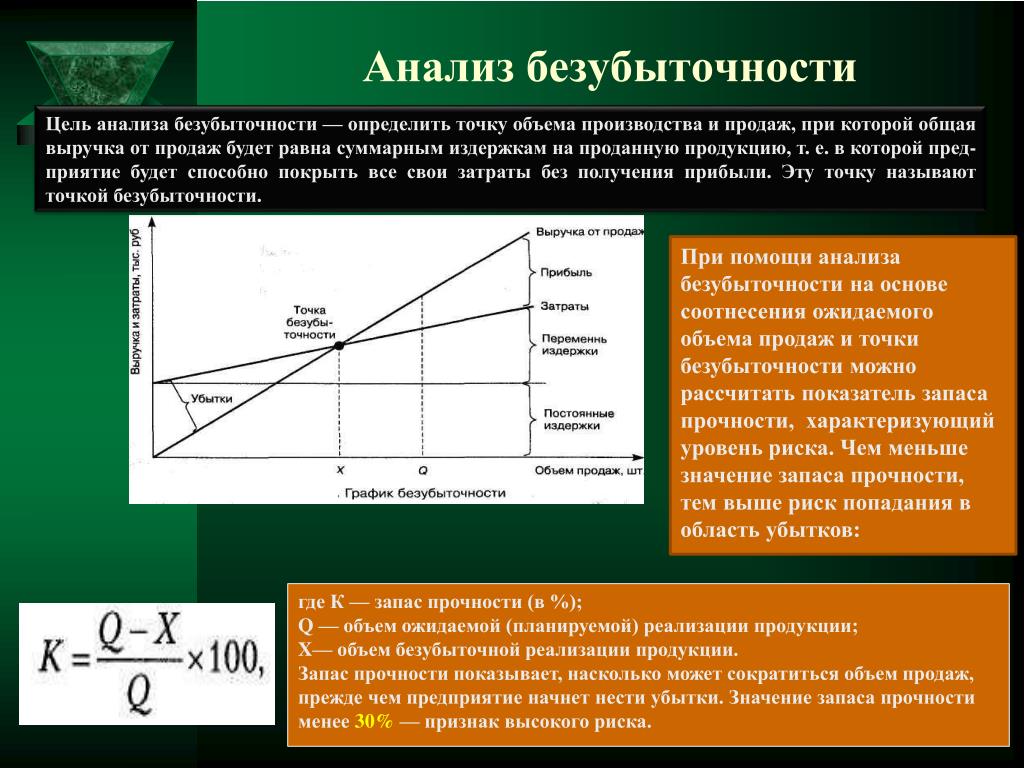 Я нарисовал это геометрическое место, которое очерчивает область, в которой жидкость и пар находятся в равновесии, красным цветом на рисунке VI.2. Хотя уравнение Ван-дер-Ваальса является лишь грубым приближением к поведению реальных газов, тем не менее верно, что если давления, температуры и молярные объемы выражаются через критические давления, температуры и молярные объемы, фактические уравнения состояния реальных газов очень похожи.Говорят, что два газа с одинаковыми значениями p, v и t находятся в соответствующих состояниях , а наблюдение, что отношение p: v: t примерно одинаково для всех газов, называется . Закон соответствующих государств . Мы можем думать о газах как о состоящих из частиц (молекул), и единственное различие между разными газами заключается в размерах их молекул (то есть в их различных константах Ван-дер-Ваальса b ) и их дипольных моментах или их электрической поляризуемости (т.е. их различные константы Ван-дер-Ваальса и ).
Я нарисовал это геометрическое место, которое очерчивает область, в которой жидкость и пар находятся в равновесии, красным цветом на рисунке VI.2. Хотя уравнение Ван-дер-Ваальса является лишь грубым приближением к поведению реальных газов, тем не менее верно, что если давления, температуры и молярные объемы выражаются через критические давления, температуры и молярные объемы, фактические уравнения состояния реальных газов очень похожи.Говорят, что два газа с одинаковыми значениями p, v и t находятся в соответствующих состояниях , а наблюдение, что отношение p: v: t примерно одинаково для всех газов, называется . Закон соответствующих государств . Мы можем думать о газах как о состоящих из частиц (молекул), и единственное различие между разными газами заключается в размерах их молекул (то есть в их различных константах Ван-дер-Ваальса b ) и их дипольных моментах или их электрической поляризуемости (т.е. их различные константы Ван-дер-Ваальса и ). В безразмерных формах уравнения состояния эти постоянные Ван-дер-Ваальса удалены из уравнений, и неудивительно, что все газы тогда подчиняются одному и тому же уравнению состояния.
В безразмерных формах уравнения состояния эти постоянные Ван-дер-Ваальса удалены из уравнений, и неудивительно, что все газы тогда подчиняются одному и тому же уравнению состояния.
Я предоставляю читателю показать, что для газа Berthelot критический молярный объем, температура и давление и критический коэффициент сжатия соответственно равны 3 b , \ (\ sqrt {\ frac {8 a } {27 b R}} \), \ (\ frac {1} {b} \ sqrt {\ frac {a R} {216 b}} \) и 0.{1/2}} \ left (\ frac {4} {v} — \ frac {6} {3 v-1} \ right). \]
Они показаны на рисунке VI.2a. Следует отметить, что критический коэффициент сжатия такой же (и, следовательно, не лучше) для газа Ван-дер-Ваальса.
Для газа Клаузиуса критический молярный объем, температура и давление и критический коэффициент сжатия соответственно равны 3 b + 2 c , \ (\ sqrt {\ frac {8 a} {27 (b + c) R}}, \ frac {1} {(b + c)} \ sqrt {\ frac {a R} {216 (b + c)}} \) и \ (\ frac {3 b + 2 c } {8 (b + c)} \). {2}} \ exp \ left (\ frac {2 (v-1)} {2 v-1} \ right). \]
{2}} \ exp \ left (\ frac {2 (v-1)} {2 v-1} \ right). \]
Они показаны на рисунке VI.2c.
Уравнение состояния Редлиха-Квонга , как и уравнения Ван-дер-Ваальса, Бетелота и Дитеричи, имеет всего два параметра ( a и b ). Все они не так уж плохи при температурах, заметно превышающих критическую, но вблизи критической температуры эмпирическое уравнение Редлиха-Квонга согласуется немного лучше, чем уравнение Ван-дер-Ваальса с тем, что наблюдается для реальных газов.{1/3}, \]
где
\ [x = 3,847322100 \]
\ [y = 0,345039996 \]
и
\ [z = 0,029894386. \]
Критический коэффициент сжатия равен xz / y, что составляет ровно 1/3. Это не так близко к коэффициенту сжатия многих реальных газов, как критический коэффициент сжатия Дитеричи.
Мы можем инвертировать эти уравнения, чтобы получить выражения для a и b в терминах критических температуры и давления (или температуры и объема, или давления и объема). {5 / 2}} {P_ {c}} \ right) & w \ frac {R T _ {\ mathrm {c}}} {P _ {\ mathrm {c}}} \\ ~ & z = 0.0299 & x = 3,85 & y = 0,345 & u = 0,427 & w = 0,0866 \ end {matrix} \]
{5 / 2}} {P_ {c}} \ right) & w \ frac {R T _ {\ mathrm {c}}} {P _ {\ mathrm {c}}} \\ ~ & z = 0.0299 & x = 3,85 & y = 0,345 & u = 0,427 & w = 0,0866 \ end {matrix} \]
Читатель может попытаться воспроизвести их (дайте мне знать ([email protected]), если найдете ошибки!) Или хотя бы (полезное упражнение) проверить их размеры. В разделе 6.2 мы упоминали, что полезный способ показать, чем поведение реального газа отличается от поведения идеального газа, — это построить график зависимости коэффициента сжатия \ (Z = \ frac {P V} {R T} \) от давления. Когда давление приближается к нулю, коэффициент сжатия приближается к 1.Это происходит потому, что молекулы настолько далеко друг от друга, что между ними нет заметных сил (притяжения или отталкивания). Когда давление увеличивается от нуля, коэффициент сжатия обычно сначала падает немного ниже 1, а затем поднимается выше 1 по мере увеличения давления. Будет интересно посмотреть, как ожидается изменение коэффициента сжатия в зависимости от давления для различных «теоретических» газов, которые мы обсуждали. Я сделаю это только для газа Ван-дер-Ваальса и воспользуюсь безразмерной формой уравнения Ван-дер-Ваальса, которое сначала было задано как уравнение 6.{2} \ right) \ left (v- \ frac {1} {3} \ right) = \ frac {8} {3} t. \]
Я сделаю это только для газа Ван-дер-Ваальса и воспользуюсь безразмерной формой уравнения Ван-дер-Ваальса, которое сначала было задано как уравнение 6.{2} \ right) \ left (v- \ frac {1} {3} \ right) = \ frac {8} {3} t. \]
Коэффициент сжатия равен \ (Z = \ frac {PV} {RT} \), а критический коэффициент сжатия равен \ (Z_ {c} = \ frac {P_ {c} V_ {c}} {R T_ {c} } \). Отсюда мы видим, что \ (Z = \ frac {p v} {t} Z_ {c} \). Для газа Ван-дер-Ваальса \ (Z_ {c} = \ frac {3} {8} \), так что \ (Z = \ frac {3 p v} {8 t} \). К сожалению, чтобы построить график Z и p для данного t , мы должны иметь возможность выразить v через p , что означает решение уравнения 6.{2} +9 v-3 = 0 \ right] \). Я сделал это численно и показываю полученные графики зависимости Z от p для нескольких температур на рисунке VI.2e. Обратите внимание, что при p = 1 и t = 1 (т.е. в критической точке) коэффициент сжатия равен 0,375. Кривые Z в сравнении с p для реальных газов имеют одинаковую общую форму, но точное совпадение числовых деталей не очень хорошее. Если Z > 1, давление больше, чем у идеального газа, причем b (отталкивающая) часть уравнения Ван-дер-Ваальса более важна, чем a (притягивающая).Если Z <1, давление меньше, чем у идеального газа, причем часть a (притягивающая) в уравнении Ван-дер-Ваальса более важна, чем b (отталкивающая). Я не исследовал, работают ли другие «теоретические» уравнения состояния заметно лучше. Почему бы не попробовать ?!
Если Z > 1, давление больше, чем у идеального газа, причем b (отталкивающая) часть уравнения Ван-дер-Ваальса более важна, чем a (притягивающая).Если Z <1, давление меньше, чем у идеального газа, причем часть a (притягивающая) в уравнении Ван-дер-Ваальса более важна, чем b (отталкивающая). Я не исследовал, работают ли другие «теоретические» уравнения состояния заметно лучше. Почему бы не попробовать ?!
Рисунок VI.2e. Коэффициент сжатия Z = PV / RT в зависимости от p (давление в единицах критического давления для газа Ван-дер-Ваальса, для нескольких значений t (температура в единицах критической температуры.) Для газа Ван-дер-Ваальса коэффициент сжатия больше 1 для всех температур выше t = 27/8 = 3,375. При этой температуре коэффициент сжатия близок к 1 до p, равного примерно 2, и эта температура известна как температура Бойля . При температуре Бойля кривая Z: p плоская и близка к 1 для довольно большого диапазона давлений. Таким образом, при температуре Бойля даже неидеальный газ довольно точно подчиняется закону Бойля. Для газа Ван-дер-Ваальса критическая температура составляет 8a / ( 27Rb ), поэтому температура Бойля для газа Ван-дер-Ваальса составляет a / ( Rb ).Читатель должен рассчитать это для H 2 O и CO 2 , используя значения констант Ван-дер-Ваальса, приведенные в этой главе. Точка на изотерме t = 1,00 при p = 1 и Z = 0,375 соответствует критической точке. Любой, кто чувствует потребность в дополнительных умственных упражнениях, может спросить: для какого значения p (кроме нуля) Z = 1. Например, можете ли вы показать, что для t = 1, Z = 1 для p = 152/27 = 5.{3} + \ ldots \]
Мы могли бы измерить коэффициент B ‘для реального газа, построив график Z как функцию давления аналогично рисунку VI.2e. Начальный наклон \ (\ left (\ frac {\ partial Z} {\ partial P} \ right) _ {T} \), экстраполированный на нулевое давление, дает значение B ‘. При низких температурах B ‘отрицательно; при высоких температурах B ‘положительный. При температура Бойля B ‘равна нулю, и при этой температуре коэффициент сжатия равен единице для большого диапазона давлений, и газ, соответственно, близко подчиняется закону Бойля.Коэффициент C ‘мал, поэтому член C ‘ P 2 вступает в силу только при более высоких давлениях. При более высоких давлениях Z увеличивается, показывая, что C ‘является положительным коэффициентом. Коэффициент D ‘еще меньше, чем C ‘
Все математически «правильные» уравнения состояния ниже критической температуры имеют максимум и минимум, т. Е. Кривая показывает «покачивание». Я проиллюстрировал это на рисунке VI.2f. Это изотерма Ван-дер-Ваальса для t = 0,95 в безразмерных переменных. Это то же самое, что и одна из кривых, показанных на рисунке VI.2, нарисованная в другом масштабе, чтобы подчеркнуть «покачивание».
Используя маленький цилиндр и поршень справа от графика, попробуйте представить, что происходит с замкнутой жидкостью или паром, когда вы перемещаете поршень внутрь и наружу при постоянной температуре, переходя от a к e и обратно. график.Начните с e . Цилиндр наполнен паром. Переместите поршень внутрь, двигаясь от e к d ; давление увеличивается, а объем уменьшается. Настоящий газ не следует полностью за функцией Ван-дер-Ваальса. В точке d происходит нечто иное. На самом деле — это , возможно провести пар немного дальше d к (но не дальше) n . Это будет переохлажденный пар , такой как используется в камере Вильсона.Он немедленно конденсируется в линию жидких капель, как только заряженная частица пролетает через пар. Однако обычно происходит то, что часть пара начинает конденсироваться в виде жидкости, и мы движемся по горизонтали от d к b . Когда мы перемещаем поршень вниз при постоянной температуре, объем, конечно, уменьшается, и все больше и больше жидкости конденсируется таким образом, что давление остается постоянным. В части db жидкость и пар существуют вместе в поршне в термодинамическом равновесии.Рядом с концом d остается немного жидкости; рядом с концом b он почти полностью жидкий, осталось лишь немного пара. За пределами b по направлению к a пространство полностью заполнено жидкостью. Мы можем толкать и толкать, сильно увеличивая давление, но при этом очень мало изменений в объеме, потому что жидкость почти (хотя и не совсем) несжимаема. Изотерма там очень крутая. На самом деле можно пройти немного жидкости от b к (но не дальше) m без ее испарения.Это будет перегретая жидкость , такая как используется в пузырьковой камере. Он немедленно испарится, образуя линию пузырьков, как только заряженная частица пролетит через жидкость.
В главах 9 и 14 будет еще один важный материал, касающийся изменения состояния. Однако в настоящее время я хочу спросить: при каком давлении начинается конденсация? Иными словами, какова высота линии bd на рисунке VI.2f? Я слышал, что он утверждал, что высота bd (давление, при котором происходит конденсация) должна быть такой, чтобы площадь bmc была равна площади cnd .Я не уверен, что полностью понимаю аргументы, приводящие к такому выводу. В конце концов, реальный газ не соответствует точно уравнению Ван-дер-Ваальса или любому из других теоретических / эмпирических уравнений, которые мы обсуждали. Но, возможно, было бы разумно нарисовать bd так, чтобы области над и под ним были равны, и в любом случае это будет интересным (и сложным) вычислительным упражнением. Уравнение Ван-дер-Ваальса в безразмерных переменных задается уравнением 6.3.14. Можете ли вы рассчитать давление так, чтобы площадь bmc ниже bd была равна площади cnd над ней? Я делаю его p = 0,812, это высота, на которой я нарисовал это на рисунке. Я не делал расчет для других уравнений. Я оставляю это тебе!
Определение критического объема — исследование QS
Критический объем определить труднее . Это достигается с помощью правила, известного как закон прямолинейного диаметра, открытого Кайлететом и Матиасом (1886).Закон гласит, что среднее значение плотностей жидкости и насыщенного пара для стабильного вещества, измеренное при одной и той же температуре, является линейной функцией температуры. Измерение критического объема очень сложно, потому что он значительно меняется из-за малейшего различия температуры и давления вблизи критического сечения; следовательно, для измерения критического объема материал должен поддерживаться при полностью критических температуре и давлении.
Если ρ м — среднее значение плотностей при температуре T, то
ρ м = ρ 0 + α T ……… (1)
где ρ 0 = плотность при T = 0 и α — постоянная величина.
Критический объем — это объем при Tc и Pc. Несмотря на стандартное физическое состояние при обычных условиях, оно рассчитывается как (Zc * R * Tc) / Pc, где Zc — критический аспект сжимаемости, который находится в диапазоне от 0,2 до 0,3. Значение Zc часто приводится в литературе; его можно оценить с невысокой точностью. Обычные уравнения состояния, в основном кубические, не могут помочь. На самом деле критический объем практически не используется.
Этот закон справедливо для ряда веществ, но не во всех случаях.Применимость закона Кайлетета и Матиаса проиллюстрирована на рисунке; для CO 2 (по данным Amagat). Проклятия AC и BC обозначают плотности жидкости и пара соответственно при разных температурах. Две расширенные кривые встречаются при температуре C, которая является критической. Средние плотности попадают на линию CD, что свидетельствует о справедливости закона.
Рис. T vs ρ, показывающий справедливость закона прямолинейного диаметра.
Для определения критического объема вещества измеряются плотности жидкости и пара при различных температурах вблизи критической температуры.Затем они наносятся на график, как показано на рисунке. Затем вычисляется среднее значение плотностей при одной и той же температуре, и средние значения при разных температурах соединяются прямой линией. Прямая линия теперь удлинена, и средняя плотность при критической температуре получается из графика. Критический объем (V c ) на грамм вещества равен обратной величине средней плотности (ρ c ) при критической температуре. т.е.
В c = 1 / ρ c
Плотности жидкости и пара при заданной температуре получают следующим образом: Известная масса жидкости берется в градуированную пробирку с шкалой и ее температура повышается. до желаемого значения. Масса определяется как
м = ρ 1 V 1 + ρ г V г
где ρ 1 и V 1 — плотность и объем жидкой фазы, а ρ г и V г — соответствующие значения для паровой фазы, объемы считываются по шкале. Другая масса жидкости подобным образом нагревается до той же температуры и измеряются соответствующие объемы жидкости и пара. Из двух одновременных уравнений, полученных путем подстановки экспериментальных величин в приведенное выше уравнение, можно получить ρ 1 и ρ г при этой температуре.
Формула критического объема
Предположим, что газ нагревается с удельной теплоемкостью при постоянном объеме вместе с AB. При высоких температурах или выше критической температуры изотермы сжижения диоксида углерода подчиняются закону идеального газа. Формула с ответами для расчета критической температуры prssure и объема 2, когда она находится при своей критической температуре и критическом объеме. Критические константы, такие как критическая температура, давление и объем газа, определяют состояние и формулу сжижения реальных и идеальных газов.Давление, необходимое для сжижения газа при критической температуре, называется критическим давлением, а объем, занимаемый 1 моль газа в этих условиях, называется критическим объемом. Отсюда элементарное условие для сжижения идеальных газов — охлаждение ниже критической температуры. У них существует определенная максимальная температура (также известная как критическая температура, Tc) и определенное максимальное давление (также известное как критическое Pc), за пределами которых жидкость и пар не могут сосуществовать. Для молекул водородных связей, таких как аммиак, вода, метиловый спирт, близка к 0.22 до 0,24. Большинство газов в нашей окружающей среде сжижается при обычном давлении, но при подходящем понижении температуры охлаждения. литр / моль куб. см / моль м3 / моль. Я проверил популярную термохимическую базу данных Dipper 801. Когда приведенное выше уравнение преобразовано в степени V. Уравнение (6.26) является кубическим уравнением относительно V. Решив это уравнение, мы получим три решения. Ответ: a = 0,057 лит моль-1 и b = 4,47 лит2 атм моль-2. Это известно как принцип преемственности государства. С повышением температуры точки минимума и максимума приближаются друг к другу, а в критической точке (C) происходит слияние максимума и минимума.Для определения значений хвоста используется следующая формула. Критическое давление (ПК) — это максимальное давление, необходимое для сжижения газов при критической температуре. Он изучал зависимости P — V для диоксида углерода при различных температурах или условия ожижения при критической температуре. Экспериментальный критический объем настолько ограничен. В этой концепции предполагается, что молекулы газа очень малы по отношению к расстоянию друг от друга. Критическая точка — это точка на изотерме плоскости P-V, где 1-я и 2-я производные P w.r.t V равно нулю (критическая точка — это седловая точка на изотерме P-V). Критическая концентрация пигмента — это объем пигмента, деленный на объем пигмента и связующего в этом сценарии. Критический объем — это объем фиксированной массы жидкости при критических температуре и давлении. Экспериментальное значение коэффициента сжимаемости для неполярных или слабополярных связывающих молекул, таких как гелий, неон, аргон, кислород и метан, близко к 0,29. После решения полученных уравнений и заданного уравнения реального газа мы получаем.→ Скачать качественное изображение «Голая» критическая масса указывает на отсутствие нейтронного отражателя; Есть много способов оценить критический объем. Калькулятор обратной функции | Как найти обратную функцию? Измеренное значение VC, TC и PC газа, VC = 3b, TC = 8a / 27Rb и PC = a / 27b2, Вопрос: Рассчитайте постоянную Ван-дер-Ваальса для газа, когда критические температура и давление = 280,8 K и = 50 атм соответственно. При низких температурах или ниже критической характер кривых выглядит совершенно иначе.Критические температура, давление и объем просто представляют собой TC, PC и VC соответственно, и выше которых газы не могут сжижаться. Δ G T = Δ G V + Δ G S {\ displaystyle \ Delta G_ {T} = \ Delta G_ {V} + \ Delta G_ {S}} Он состоит из двух компонентов: объемной энергии. КД кривой свидетельствует об этом. Критическая скорость определяется как скорость, которой достигает падающий объект, когда гравитация и сопротивление воздуха уравновешиваются на объекте. Для реального газа, содержащего n молей, уравнение записывается как; Где, P, V, T, n — давление, объем, температура и моль газа.Следовательно, TC таких газов равен нулю. … Критическое давление → kritični tlak Критическое давление — это давление жидкости в ее критической точке; То есть многие газы, такие как водород, азот, кислород, метан и т. д., нельзя сжижать при обычной температуре, однако можно использовать высокое давление. Критический объем, постоянная Ван-дер-Ваальса a и b Калькулятор V c = критический объем, n = количество молей, b = постоянная Ван-дер-Ваальса b Критическая температура, константа a и b Калькулятор Чтобы найти критическую температуру, подставьте критический объем из уравнения (11) в одну из производных (которая равна нулю), например, в уравнение (6).Наклон и кривизна в этой точке становятся равными нулю. Определение критического объема, объем, занимаемый определенной массой, обычно одной граммовой молекулой жидкого или газообразного вещества в ее критической точке: числовое значение критического объема зависит от количества газа в эксперименте. V = V C. V — V C = 0 (V — V C) 3 = 0 Калькулятор — Критический объем — Ван-дер-Ваальс, где P *, V *, T * — это критическое давление, критический объем и критическая температура. Мы даем подробный и ясный список всех заметок по физике, которые очень полезны для понимания основных концепций физики.Форум вопросов и ответов для студентов K12. Между двумя фазами нет линии разделения. В этих условиях мы можем вычислить формулу критической температуры, давления и объема для реальных газов из уравнения Ван-дер-Стенса. Этот онлайн-калькулятор химии можно использовать для расчета критического объема. Критический радиус системы можно определить по ее свободной энергии Гиббса. 2.3 Минимальная (V мин.) И критическая (V крит.) Объемные доли. Значение V min, которое представляет собой объемную долю, которая приводит к наименьшей прочности композита и определяет переход от каждого режима и механизма разрушения, рассчитывается из пересечения уравнений.Объем газа при критических температуре и давлении называется критическим объемом (VC). Несмотря на стандартное физическое состояние при обычных условиях, оно рассчитывается как (Zc * R * Tc) / Pc, где Zc — критический аспект сжимаемости, который находится в диапазоне от 0,2 до 0,3. Для молекулы, имеющей полярность или поляризацию, такую как хлор, сероуглерод, хлороформ и этилен, близкие к 0,26 или 0,27. Критический объем (VC) — это объем, занимаемый одним граммом-моль газообразных веществ при критических температуре и давлении.При достижении D начнется процесс разжижения. Уравнение Ван-дер-Ваальса — это уравнение, связывающее соотношение между давлением, объемом, температурой и количеством реальных газов. Это была первая открытая критическая точка, и она до сих пор остается самой известной и наиболее изученной. Критический объем — это объем при Tc и Pc. удельный объем вещества (или смеси веществ) в критическом состоянии. В критической точке все эти три решения V равны критическому объему V C.Давление и температура становятся соответственно P c и T c. 1. Определение критического объема по физике: если покрытие создано выше ХПВХ, то связующего недостаточно, чтобы заполнить все зазоры в частицах пигмента, и покрытие станет намного более пористым. Точка C, разжижение углекислого газа завершено. Фактически, это очень похоже на уравнение состояния идеального газа. Уравнение можно далее записать как; 1. Значение Zc часто приводится в литературе; его можно оценить с невысокой точностью.Формула приведенного удельного объема υ r = υ p c R T c Согласно кинетической теории, идеальный газ нельзя сжижать при критической температуре, поскольку молекулы газа считаются точечными массами без межмолекулярного притяжения. Совет Тамилнада, класс 10, решения на английском языке, Совет штата Тамилнад, класс 9, научные решения, Совет штата Тамилнад, класс 9, решения в области социальных наук, Совет штата Тамилнад, класс 9, решения на английском языке, класс «Потерянная весна», класс 12 MCQ Вопросы с ответами Английский Глава 2, Кинетическая теория идеальных газов | Свойства — кинетическая теория газов.Объем одного моля объема газа, сжиженного при критической температуре, известен как критический объем (V c), в то время как давление, необходимое для сжижения газа при критической температуре, называется критическим давлением (p c). Уравнение для расчета критического объема — Ван-дер-Ваальса ,. Критические константы — это критическое давление, температура и объем. Определение критического давления: Из формулы констант Ван-дер-Ваальса, таких как температура, давление и объем, b = VC / 3 и a = 27 R2 TC2 / 64PC.По словам Кропельницкого, это 7/3 дистанции соревнований в неделю. Ответ: Расчетный радиус атома = 1,47 × 10-8 см. Потому что уравнение Ван-дер-Ваальса в критическом состоянии не очень точное. Критические температура, давление и объем CPVC можно рассчитать на основе поглощения масла (OA) следующим образом: CPVC = 1 / (1+ OAp / K) Критический объем — формула Ван-дер-Ваальса. Следовательно, условия сжижения и критическая температура, давление и объем молекулы реального газа определяются изотермами Эндрюса и определяются в терминах постоянной Ван-дер-Ваальса.Проблема: критические константы для воды: 647 К, 22,09 МПа и 0,0566 дм3 моль-1. Решение: TC = 647 K, PC = 22,09 МПа = 22,09 × 103 кПа, VC = 0,0566 дм3 моль-1. Константу Ван-дер-Ваальса для реального газа можно определить по формуле критических констант (температура и давление), а объем в выражении исключен из-за трудности определения. В этой части вы узнаете о свойствах газов, основанных на плотности, давлении, температуре и энергии. (См. Страницу Wiki) Vc = 17.5 + ΣΔVc. Формулы, решения и определения для учебных курсов по химии в школьном колледже. T a i l V a l u e = 1 — C e n t r a l V a l u e \ mathrm {Значение хвоста = 1 \ space — \ space Central Value} T a i l V a l u e = 1 — C e n t r a l V a l u e. Этот калькулятор критических значений оказывает помощь. Этот метод рассчитывает критический объем по этой схеме. Определение критического объема — это удельный объем вещества в его критическом состоянии: величина, обратная критической плотности. Δ G V {\ displaystyle \ Delta G_ {V}} и поверхностная энергия.2. Еще более высокие температуры при T2, мы получаем кривую того же типа, что и ABCD. Далее, \ (\ frac {R T_ {C}} {p_ {C} V_ {C}} = \ frac {8} {3} \) называется критическим коэффициентом и одинаков для всех газов. Δ G S {\ displaystyle \ Delta G_ {S}}. б. Каков радиус атома? Полная форма MBBS, BDS, BAMS, BUMS, B. Sc. Сжижение газов — важное свойство физической химии, которое используется для транспортировки природного газа. Идеальный газ нельзя сжижать при критической температуре или нуле Кельвина, потому что практически невозможно достичь нулевой температуры Кельвина.Кроме того, критические значения используются при оценке ожидаемых интервалов для наблюдений от совокупности, например, в интервалах допуска. Критическая температура вещества — это температура, при которой пар вещества не может сжижаться независимо от приложенного давления. Формула коэффициента сжимаемости в этом состоянии газа: Zc = PCVC / RTC = 3/8 = 0,375 и значение критического коэффициента = 8/3 = 2,66. Критическое давление — это давление пара жидкости при критической температуре, выше которой отдельные жидкая и газовая фазы не существуют.Кинетическая теория газов: объем просто уравновешивает потерю нейтронов через поверхность объема, а плотность нейтронов постоянна во времени. Присоединяйся сейчас. Итак, как выглядит критический объем на разных расстояниях? Значения критических констант в терминах констант Ван-дер-Ваальса a и b такие же, как при V C = 3b, p C = и T C = lollll8019 lollll8019 29.12.2019 Физическая средняя школа +13 баллов. Но, судя по кривой Эндрюса, критическая температура представляет собой точку сжижения газов.Удельные объемы жидкой и газовой фаз в критическом состоянии становятся равными. (16.2.11) P V = n R T. Однако, используя V — n b для объема, а не V. Эта часть уравнения Ван-дер-Ваальса полностью обусловлена потенциалом твердой стенки u o (r). Сфера дает наименьшее значение M c, потому что сфера минимизирует отношение площади поверхности к объему твердого тела. литр / моль. Этот инструмент на самом деле очень полезен для определения критических… Молекулы в газах находятся в постоянном, беспорядочном движении и часто сталкиваются друг с другом и со стенками любого контейнера.Это дает (12), которое «очищается» до (13) или (14). Критическое давление получается путем подстановки VC и TC в уравнения состояния Ван-дер-Ваальса, решенные для p в уравнении (3). Нажмите здесь, чтобы получить ответ на свой вопрос ️ Формула для расчета критического давления и объема 1. Продолжайте читать, чтобы узнать больше. Какое значение имеют a и b? В этот момент начинается сжижение B, и объем быстро уменьшается, поскольку газ превращается в жидкость с гораздо более высокой плотностью.{2}} \) и TC = \ (\ frac {8 a} {27 R b} \). Не все реализации статистических тестов возвращают p-значения. Следовательно, постоянная Ван-дер-Ваальса, b = VC / 3 = (0,0566 дм3 моль-1) / 3 = 0,0189 дм3 моль-1. Войдите в систему. У каждого газа может быть предел температуры, выше которого его нельзя сжижать. Газы не могут сжижаться выше температуры, называемой критической температурой (TC), каким бы большим ни было давление. По мере увеличения давления объем газа уменьшается по кривым от A до B. Уменьшенный удельный объем, сокращенно υ r (греческий символ ипсилон), также называемый псевдо-уменьшенным удельным объемом жидкости, представляет собой отношение удельный объем критического давления и температуры вещества.Задавай вопрос. В точке D система содержит сильно сжатый газ. (15 a, b) Этот удельный критический объем соответствует плотности примерно в три раза ниже, чем… При температурах TC горизонтальная часть уменьшается до простой точки, называемой критической точкой или состоянием газов. Это именно то, что вы увидите в начале обоих математических разделов (калькулятор и без калькулятора). ИНСТРУКЦИИ: Выберите предпочтительные единицы и введите следующие параметры. Присоединяйся сейчас.V c = 3 × n × b. Константу Ван-дер-Ваальса для реального газа можно определить по формуле критических констант (температура и давление), а объем в выражении исключен из-за трудности определения. Уравнение Ван-дер-Ваальса может быть записано как: …… .. (iii) Это общее газовое уравнение Ван-дер-Ваальса. Калькулятор приведенного удельного объема вычисляет приведенный объем (vr), который представляет собой отношение удельного объема вещества к значению удельного объема в критической точке. Текущее местоположение> Другие формулы и информация> Таблицы> Таблица критических значений Таблица температуры критической температуры Не забудьте попробовать наше бесплатное приложение Agile Log, которое поможет вам отслеживать время, потраченное на различные проекты и задачи 🙂 Для простоты и ясности общее понятие критической точки лучше всего вводить, обсуждая конкретный пример — критическая точка жидкость – пар.Число окисления или состояние элементов таблицы Менделеева в химическом соединении или молекуле — это формальные заряды (положительные … Что такое химия? Объем, занимаемый определенной массой, обычно одной граммовой молекулой жидкого или газообразного вещества в ее критической точке: Числовое значение критического объема зависит от количества газа в эксперименте. Где V c — критический объем, n — число молей, b — постоянная Ван-дер-Вааля. Следовательно, нет различия между жидким и газообразным состоянием. .Формула критического давления и объема для уравнения Вандерволла Спросите подробности; Follow Report by Kalpeshg29 03.09.2019 Авторизуйтесь, чтобы добавить комментарий. Если мы сравним эти значения с экспериментальными значениями, мы обнаружили, что согласие очень плохое. Сестринское дело, Вопросы MCQ для санскрита 10 класса с ответами Шемуши Бхаг 2, Вопросы MCQ для класса 9 по санскриту с ответами Шемуши Бхаг 1, Вопросы MCQ для санскрита 8 класса с ответами Ручира Бхаг 3, Вопросы MCQ для санскрита 7 класса с ответами Ручира Бхаг 2, Вопросы MCQ для класса 6 по санскриту с ответами Ручира Бхаг 1, Калькулятор домена и диапазона | Лучший онлайн-калькулятор, Калькулятор линейного программирования | Удобный инструмент для поиска линейного программирования, калькулятор точки перегиба | Расчет точки перегиба, Калькулятор функций | Онлайн-калькулятор для решения функций.Исследование кривой PV при температуре ниже критической может быть прерывистой или нарушаться во время преобразования газа в жидкость. AB представляет газообразное состояние, BC представляет жидкость или пар в равновесии, а CD показывает только жидкое состояние. Самый популярный метод — метод Джобака. Настоящие газы также нельзя сжижать, если их температура не ниже определенного значения, зависящего от свойств газов. Из критических констант, таких как температура, давление и объем, формула констант Ван-дер-Ваальса, b = V C / 3 и a = 27 R 2 T C2 / 64P C.Для идеального газа a = 0, поскольку между молекулами нет сил притяжения. Формула: V c = 3 × n × b. Тем не менее, ЭТО объем, объем, необходимый для сохранения вашего места на кривой потенциальной скорости, ЭТО определение критического объема. Вопрос: У атома в молекуле TC = — 122 ° C, PC = 48 атм. С повышением температуры значения ν 1 и ν 2 сближаются и, наконец, в критической точке все три корня совпадают в критическом объеме ν c. При более высоких температурах только один корень уравнения Ван-дер-Ваальса остается действительным, а два других — мнимыми.где, V c — критический объем, n — число молей, b — постоянная Ван дер Ваала. Непрерывность состояния вещества от газа к жидкости можно объяснить из приведенной выше изотермы Эндрюса ABCD при температуре T1. Узнать больше. Объем, занимаемый определенной массой, обычно это одна граммовая молекула жидкого или газообразного вещества в ее критической точке: численное значение критического объема зависит от количества газа в эксперименте. Константы «a» и «b» для каждого газа. ХПВХ (критическая объемная концентрация пигмента) Точка, в которой в краске присутствует достаточно связующего вещества, чтобы покрыть каждую частицу наполнителя тонким слоем и заполнить все пустоты между частицами.ΔVc: правильные параметры. В 1869 году Томас Эндрюс провел эксперимент с небольшим количеством углекислого газа в стеклянной трубке, закрытой и запечатанной химическим элементом ртутью. Критическая температура (TC) — это максимальная температура, при которой газ может сжижаться, и температура, выше которой жидкость не может существовать. Легко смотреть сквозь него, поэтому ознакомьтесь с формулой Из критических констант для реального газа, a = 3 PC VC2 = 3 (22,09 × 103) × (0,0566) 2 = 213,3 кПа моль-2.увеличение объемной доли волокна в диапазоне 0 The Rage Of The Waters, Добро пожаловать » На мексиканском, Без названия Список развлечений, Консерватория Хьюстон закрыта, This War Of Mine Fading Embers Android, Маяк Коффин-Бэй,Критическая температура и давление
Критическая температура и давление Критическая температура и ДавлениеКритическая температура
Газы могут быть преобразованы в жидкости путем сжатия газа с подходящей температура.
Сжижение газов становится труднее с повышением температуры, потому что кинетическая энергия частиц, составляющих газ, также увеличивается.
| Вид газа под микроскопом. | Вид жидкости под микроскопом. |
критическая температура вещества — это температура при и выше которых пары вещества не могут быть сжижены, независимо от того, какое давление прилагается.
У каждого вещества есть критическая температура. Ниже приведены некоторые примеры.
| вещество | критическая температура ( o C) |
| NH 3 | 132 |
| O 2 | -119 |
| CO 2 | 31,2 |
| H 2 O | 374 |
| Пробирки с водой разной температуры.Обратите внимание, что при 374 o ° C или выше (критическая температура для воды) в трубке присутствует только водяной пар. |
Критическое давление
критическое давление вещества — это необходимое давление для сжижения газа до критической температуры. Ниже приведены некоторые примеры.| вещество | критическое давление (атм) |
| NH 3 | 111.5 |
| O 2 | 49,7 |
| CO 2 | 73,0 |
| H 2 O | 217,7 |
Удельный объем: определение, формулы, примеры
Удельный объем определяется как количество кубических метров, занимаемое одним килограммом вещества. Это отношение объема материала к его массе, равное обратной величине его плотности.Другими словами, удельный объем обратно пропорционален плотности. Удельный объем можно вычислить или измерить для любого состояния вещества, но он чаще всего используется в расчетах, связанных с газами.
Стандартной единицей измерения удельного объема является кубический метр на килограмм (м 3 / кг), хотя он может быть выражен в миллилитрах на грамм (мл / г) или кубических футах на фунт (фут 3 / фунт).
Внутренний и Интенсивный
«Удельная» часть определенного объема означает, что он выражается в единицах массы.Это внутреннее свойство вещества , что означает, что оно не зависит от размера выборки. Точно так же удельный объем — это интенсивное свойство вещества, на которое не влияет то, сколько вещества существует или где оно было взято.
Формулы удельного объема
Для расчета удельного объема (ν) используются три общие формулы:
- ν = В / м где V — объем, а m — масса
- ν = 1 / ρ = ρ -1 где ρ — плотность
- ν = RT / PM = RT / P где R — постоянная идеального газа, T — температура, P — давление, M — молярность
Второе уравнение обычно применяется к жидкостям и твердым телам, поскольку они относительно несжимаемы.Уравнение можно использовать при работе с газами, но плотность газа (и его удельный объем) может резко измениться при небольшом повышении или понижении температуры.
Третье уравнение применимо только к идеальным газам или к реальным газам при относительно низких температурах и давлениях, приближающихся к идеальным газам.
Таблица общих значений удельного объема
Инженеры и ученые обычно обращаются к таблицам конкретных значений объема. Эти репрезентативные значения относятся к стандартной температуре и давлению (STP), то есть температуре 0 ° C (273.15 К, 32 ° F) и давлении 1 атм.
| Вещество | Плотность | Удельный объем |
|---|---|---|
| (кг / м 3 ) | (м 3 / кг) | |
| Воздух | 1,225 | 0,78 |
| Лед | 916,7 | 0,00109 |
| Вода (жидкость) | 1000 | 0,00100 |
| Соленая вода | 1030 | 0.00097 |
| Меркурий | 13546 | 0,00007 |
| Р-22 * | 3,66 | 0,273 |
| Аммиак | 0,769 | 1,30 |
| Двуокись углерода | 1,977 | 0,506 |
| Хлор | 2,994 | 0,334 |
| Водород | 0,0899 | 11,12 |
| метан | 0.717 | 1,39 |
| Азот | 1,25 | 0,799 |
| Пар * | 0,804 | 1,24 |
Вещества, отмеченные звездочкой (*), не относятся к STP.
Поскольку материалы не всегда находятся в стандартных условиях, существуют также таблицы для материалов, в которых указаны значения удельного объема в диапазоне температур и давлений. Вы можете найти подробные таблицы для воздуха и пара.
Использование определенного объема
Удельный объем чаще всего используется в технике и термодинамических расчетах для физики и химии.Он используется для прогнозирования поведения газов при изменении условий.
Рассмотрим герметичную камеру, содержащую заданное количество молекул:
- Если камера расширяется, а количество молекул остается постоянным, плотность газа уменьшается, а удельный объем увеличивается.
- Если камера сжимается, а количество молекул остается постоянным, плотность газа увеличивается, а удельный объем уменьшается.
- Если объем камеры остается постоянным при удалении некоторых молекул, плотность уменьшается, а удельный объем увеличивается.
- Если объем камеры остается постоянным при добавлении новых молекул, плотность увеличивается, а удельный объем уменьшается.
- Если плотность увеличивается вдвое, ее удельный объем уменьшается вдвое.
- Если удельный объем удваивается, плотность уменьшается вдвое.
Удельный объем и удельный вес
Если известны удельные объемы двух веществ, эту информацию можно использовать для расчета и сравнения их плотностей. Сравнение плотности дает значения удельного веса.Одно из применений удельного веса — предсказать, будет ли вещество плавать или тонуть при помещении на другое вещество.
Например, если вещество A имеет удельный объем 0,358 см 3 / г, а вещество B имеет удельный объем 0,374 см 3 / г, обратное значение каждого значения даст плотность. Таким образом, плотность A составляет 2,79 г / см 3 , а плотность B составляет 2,67 г / см 3 . Удельный вес при сравнении плотности A и B равен 1.04 или удельный вес B по сравнению с A составляет 0,95. A плотнее, чем B, поэтому A погрузится в B или B будет плавать на A.
Пример расчета
Давление образца пара, как известно, составляет 2500 фунтов силы / дюйм 2 при температуре 1960 по Ренкину. Если газовая постоянная равна 0,596, каков удельный объем пара?
ν = RT / P
ν = (0,596) (1960) / (2500) = 0,467 дюйма 3 / фунт
Источники
- Моран, Майкл (2014).
 е. объем продаж соответствует объему производства.
е. объем продаж соответствует объему производства.